C57BL/6 J小鼠黑色素瘤肺转移模型的构建
2018-05-04孟星君李孝东刘俊周康熙崔庆亚胡仁萍闫荣戴克胜
孟星君,李孝东,刘俊,周康熙,崔庆亚,胡仁萍,闫荣,戴克胜
(苏州大学附属第一医院,江苏省血液研究所,卫生部血栓与止血重点实验室,血液学协同创新中心, 江苏 苏州 215006)
恶性黑色素瘤(malignant melanoma, MM)是皮肤黑色素细胞来源的恶性肿瘤,具有转移快、预后差、生存期短等特点[1]。近年来,我国黑色素瘤发病率逐年上升,每年约2万新发病例,晚期黑色素瘤患者平均生存期短于1年, 5年生存率低于10%[2]。因此,通过构建小鼠黑色素瘤模型来研究黑色素瘤的转移和治疗具有重要意义。
肿瘤细胞顺利转移,需要经历以下几个阶段:首先,肿瘤细胞脱离原发灶,然后渗入血管系统中,或者通过淋巴结和淋巴管在体内循环中存活。之后,肿瘤细胞穿透内皮细胞和血管壁,迁移到远处部位或器官存活并增殖,形成转移灶[3]。人类利用小鼠模型进行癌症研究已有110多年的历史[4]。目前,国内外许多学者构建小鼠黑色素瘤模型,研究肿瘤的转移和治疗[5],但是种瘤部位不同,细胞接种数量(105~107)差别很大,肿瘤的生长时间(1~3周)也不尽相同。本文旨在构建一种成熟、可靠的小鼠黑色素瘤肺转移模型,为相关科研工作者提供参考。
1 材料与方法
1.1 实验动物及材料
1.1.1 动物
C57BL/6 J雄性小鼠,6~8周龄,体重20~22 g。购于昭衍(苏州)新药研究有限公司【SCXK(苏)2013-0003】,饲养于苏州大学独墅湖校区905 SPF(specific pathogen free,SPF)级动物房中【SYXK(苏)2017-0043】。所有操作均符合实验动物伦理学要求(伦理审批号:2016-1000)。
1.1.2 实验材料
小鼠黑色素瘤细胞B16F10购于中科院细胞所(目录号:TCM36)。胎牛血清、HyClone1640培养基均购于Thermo公司(美国)。细胞培养瓶、培养皿、无菌离心管均购于Corning公司(美国)。
1.2 方法
1.2.1 细胞培养
体外培养小鼠黑色素瘤细胞B16F10,使用HyClone1640培养基(含10%胎牛血清)培养细胞于5% CO2,37℃细胞培养箱中。取对数生长期细胞,除去培养基,用无菌PBS洗涤2次,0.25%胰酶消化细胞,加入含10% 胎牛血清1640培养基终止消化,用移液管吹打均匀,细胞悬液转至15 mL无菌离心管中,800 r/min离心5 min,弃去上清,加入2 mL培养基,吹打混匀,随后细胞计数,调整细胞浓度为3×107/mL。
1.2.2 细胞克隆形成
取对数生长期B16F10细胞400个,接种到细胞培养皿中,培养10 d,除去培养基,无菌PBS洗涤2次,加入2 mL甲醇固定3 min,倒去甲醇,加入Giemsa染液,15 min后,去除Giemsa染液,清水冲洗培养皿,晾干后拍照。
1.2.3 肿瘤模型制备
1)取6~8周龄,雄性小鼠18只,随机分三组,每组6只,分别采取尾静脉注射、腹腔注射和皮下注射,每只小鼠注射100 μL(3×106个细胞)黑色素瘤细胞悬液,饲养2周后,解剖小鼠并观察黑色素瘤的生长和转移情况。2)取6~8周龄,雄性小鼠18只,随机分三组,每组6只,通过尾静脉分别注射3×106个细胞、1×106个细胞、3×105个细胞,饲养2周后,解剖小鼠并观察黑色素瘤的生长和转移情况。3)取6~8周龄,雄性小鼠18只,随机分三组,每组6只,通过尾静脉注射1×106个细胞,分别于1周、2周、3周时解剖小鼠,观察黑色素瘤的生长和转移情况。
1.3 统计学分析
数据统计采用SPSS 18.0软件进行分析。所有数据以均数±标准差表示,两组数据之间采用配对t检验,P<0.05代表有统计学差异。
2 结果
2.1 小鼠黑色素瘤细胞B16F10的形态及增殖
小鼠黑色素瘤细胞B16F10是来源于C57BL/6小鼠自发性肿瘤细胞,具有增殖快,侵袭性强,成瘤率高等特点,是构建肿瘤模型理想的细胞,也是国内外科学工作者建立肿瘤模型广泛使用的一种细胞株[6]。小鼠黑色素瘤细胞B16F10在显微镜下呈成纤维细胞样(图1A),接种少量细胞,经数天培养,便可形成克隆(图1B),由此可见,该细胞增殖能力很强。
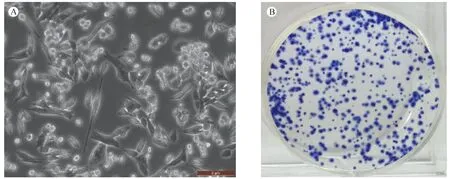
注:A:200倍显微镜下对数生长期B16F10细胞(右下角红色标尺为5 μm)。B:接种400个对数生长期B16F10细胞至培养皿中,培养10 d后,去培养基,经PBS洗涤,甲醇固定后,使用Giemsa染色。图1 小鼠黑色素瘤细胞B16F10的形态及增殖Note. A: Long-term cultured B16F10 cells growing at logarithmic phase. ×200, Bar=5 μm.B: 400 B16F10 cells growing at logarithmic growth phase were inoculated into the culture dish and cultured for ten days. The culture medium was washed by PBS and fixed by methanol. Giemsa staining.Fig.1 Morphology and proliferation of mouse melanoma B16F10 cells
2.2 不同种瘤部位结果比较
腹腔注射(图2 A)和皮下注射(图2B)在原位(接种部位)形成肿瘤,成瘤率为100%,但没有发生肺部转移(图2C2,2C3);通过尾静脉注射黑色素瘤细胞,发生明显的肺部转(图2C1),成瘤率为100%。
2.3 接种不同数量细胞结果比较
当接种3×106个B16F10细胞时,肺部肿瘤转移灶异常多(图3A1),难以准确计算转移灶的数量;当接种1×106个B16F10细胞时,肺部肿瘤转移灶数量适中(图3A2),较易于计算转移灶的数量;而当接种3×105个B16F10细胞时,肺部肿瘤转移灶数量较少(图3A3)。以上结果均有统计学差异(图3B)。
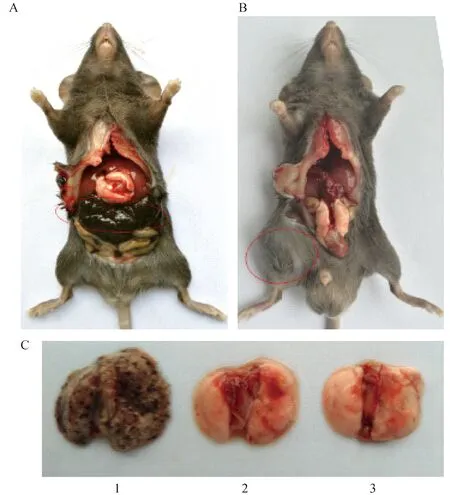
注:A:腹腔注射3×106个B16F10细胞,2周后解剖,红色圆圈表示肿瘤部位;B:皮下注射3×106个B16F10细胞,2周后处死小鼠解剖,红色圆圈表示肿瘤部位;C1:经尾静脉注射后取出的肺;C2:经皮下注射后取出的肺;C3:经腹腔注射后取出的肺。图2 接种不同部位结果比较Note. A: 3×106 B16F10 cells were injected intraperitoneally and the mice were killed at two weeks after tumor cell inoculation. The red circle indicates the tumor location. B: 3×106 B16F10 cells were injected subcutaneously, and the mice were killed two weeks later. The red circle indicates the tumor location. C1: The lungs taken from a mouse after intravenous injection. C2: The lungs taken from a mouse after subcutaneous injection. C3: The lungs taken out from a mouse after intraperitoneal injection.Fig.2 Comparison of the tumor growth after melanoma cell inoculation through different routes of inoculation
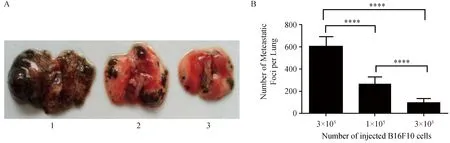
注:A1:接种3×106个B16F10细胞;A2:接种1×106个B16F10细胞;A3:接种3×105个B16F10细胞,种瘤后,均饲养2周,处死小鼠解剖取出肺。B:为统计图。****P<0.0001。图3 接种不同数量细胞结果比较Note. A1: Inoculation with 3×106B16F10 cells. A2: Inoculation with 1× 106B16F10 cells. A3: Inoculation with 3×105 B16F10 cells. The mice were killed and the lungs were taken at two weeks after tumor cell inoculation. B: Statistical chart.**** P<0.0001.Fig.3 Comparison of the results of inoculating different numbers of cells
2.4 肿瘤生长时间结果比较
种瘤3周后,解剖小鼠,黑色素瘤细胞肺部转移数量多(图4A1),小鼠死亡过半(种瘤6只,死亡4只);种瘤2周后,解剖小鼠,黑色素瘤细胞肺部转移数量适中(图4A2),小鼠未死亡;种瘤1周后,解剖小鼠,黑色素瘤细胞肺部转移数量较少(图4A3)。以上结果差异均有显著性(图4B)。

注:A1:接种1×106个B16F10细胞后,饲养3周,解剖取出的肺;A2:饲养2周,解剖取出的肺;A3:饲养1周,处死小鼠解剖取出的肺。B:为统计图。***P<0.001,****P<0.0001。图4 肿瘤生长时间结果比较Note. A1: The lungs of a mouse killed at 3 weeks after inoculation of 3×106 B16F10 cells. A2: The lungs of a mouse killed at 2 weeks after tumor cell inoculation. A3: The lungs of a mouse killed at one week after tumor cell inoculation. B: Statistical chart.***P<0.001,**** P<0.0001.Fig.4 Comparison of tumor growth after different growth time durations
3 讨论
大约有90%的肿瘤患者死于肿瘤转移,影响该过程的因素有很多,包括:遗传因素、干细胞、生长因子、血小板、细胞间的相互作用等[7]。因此,抑制肿瘤转移对肿瘤的治疗具有重大意义。肿瘤动物模型在研究人类肿瘤的发生、发展及治疗中发挥着不可替代的作用。小鼠作为常见的模式生物,具有繁殖快、饲养方便、成本低等优点,为越来越多的科学工作者所使用。常用的肿瘤模型有三种,分别为:致癌物诱导的肿瘤模型、移植肿瘤模型(包括同种移植和异种移植)和基因工程小鼠模型[8],然而,建立致癌物诱导的肿瘤模型耗时周期较长,个体差异较大。因此,移植肿瘤模型和基因工程小鼠模型应用更为普遍。
通过多次尝试,本文摸索到一种成瘤率高、重复性好的体外建立小鼠黑色素瘤肺转移模型方法。实验证明小鼠黑色素瘤细胞是通过血液循环实现肺部转移,皮下注射和腹腔注射在2周内均未发生肺转移。肿瘤转移的效率很低,只有不到0.1%的肿瘤细胞通过循环系统,最终形成转移灶[3]。这提示可以考虑从血液循环途径着手,抑制肿瘤的转移。王红阳等[9]建立小鼠黑色素瘤模型,使用阿司匹林和氯吡格雷成功抑制了黑色素瘤细胞的肺部转移。聂广军等[10]利用纳米材料包裹替格瑞洛后注射荷瘤小鼠,发现该复合物能抑制肿瘤向小鼠肺部转移。同样,基因工程小鼠模型也有广泛应用,Camerer等[11]利用小鼠黑色素瘤细胞,尾静脉注射到PAR基因敲除小鼠中,发现肺部转移较野生型明显减少。Jain等[12]发现,GPIbα基因缺失小鼠,经尾静脉注射小鼠黑色素瘤细胞B16F10后,肺部转移较野生型小鼠减少约15倍。Terranbe等[13]发现,vWF基因缺失小鼠,在肿瘤模型试验中,肺部转移较野生型小鼠显著增加。高苒等[14]将小鼠黑色素瘤细胞B16F10接种到绿色荧光蛋白转基因小鼠皮下,成功建立了GFP小鼠肿瘤模型。
此外,本研究还尝试过通过眼内眦静脉丛注射的方式建立肿瘤模型,结果注射后几分钟,小鼠均死亡。可能的原因是:注射小鼠黑色素瘤细胞后,大量细胞在小鼠眼球内形成栓塞,堵塞血管,导致小鼠死亡。因此,不推荐该方法。当然,如果只是建立普通肿瘤模型,使其形成原发灶,不形成转移灶,通过皮下注射或者腹腔注射是更为简单的操作方法。赵勇等[15]通过大量实验,总结了小鼠荷瘤实验中常见的问题。
综上所述,尾静脉注射1×106个小鼠黑色素瘤细胞B16F10,生长2周时间,为构建C57BL/6 J小鼠黑色素瘤肺转移模型的推荐方法。
(致谢:感谢沈莹、沈飞老师在细胞培养技术上给予的帮助和指导。)
参考文献(References)
[1] 祖丽胡玛尔·莫沙, 康晓静. 恶性黑素瘤的免疫治疗研究进展 [J]. 国际皮肤性病学杂志, 2017, 43(2): 117-120.
ZuLihumaer·Mosha, Kang XJ. lmunotherapy for malignant melanoma [J]. Int J Dermatol Venereol, 2017, 43(2): 117-120.
[2] 徐婧雯, 蒋惠慈, 陈汐敏, 等. 抗体药物治疗黑色素瘤的现状及进展 [J]. 中国医科大学学报, 2014, 45(3): 259-266.
Xu JW, Jiang HC, Chen XM, et al. Advances in antibody drugs for treatment of melanoma [J]. J China Pharmaceutical University, 2014, 45(3): 259-266.
[3] Omar E, Michael C, Marco F. Targeting platelets for the treatment of cancer [J]. Cancers, 2017, 9(7): 83-94.
[4] 王硕, 苏杭, 袁经权, 等. 实验小鼠在癌症研究中的应用及其进展 [J]. 中国比较医学杂志, 2011, 21(9): 63-67.
Wang S, Su H, Yuan JQ, et al. Application and recent advances of laboratory mouse in cancer research[J]. Chin J Comp Med, 2011, 21(9): 63-67.
[5] Mirzaei H, Salehi H, Oskuee RK, et al. The therapeutic potential of human adipose-derived mesenchymal stem cells producing CXCL10 in a mouse melanoma lung metastasis model [J]. Cancer Lett, 2018, pii: S0304-3835(18)30051-X.
[6] Gerber SA, Sorensen EW, Sedlacek AL, et al. Local expression of interleukin-2 by B16 melanoma cells results in decreased tumour growth and long-term tumour dormancy [J]. Immunology, 2013, 138(3): 280-292.
[7] Qiu W, Su G. Challenges and advances in mouse modeling for human pancreatic tumorigenesis and metastasis [J]. Cancer Metast Rev, 2013, 32(1-2): 83-107.
[8] Annalisa C, Angela S, Rosalia G, et al. Platelets as crucial partners for tumor metastasis: from mechanistic aspects to pharmacological targeting [J]. Cellul Mol Life Scis, 2017, 56(4): 108-117.
[9] Le X, Yu LY, Wen Y, et al. Platelets promote tumour metastasis via interaction between TLR4 and tumour cell-released high-mobility group box1 protein [J]. Nature Commun, 2014,5: 5256.
[10] Zhang YL, Wei JY, Liu SL, et al. Inhibition of platelet function using liposomal nanoparticles blocks tumor metastasis [J]. Theranostics, 2017, 7(5): 1062-1071.
[11] Eric C, Aisha A, Qazi D, et al. Platelets, protease-activated receptors, andbrinogen in hematogenous metastasis [J]. Blood, 2004, 104(2): 397-401.
[12] Shashank J, Masahiko Z, Liu JL, et al. Platelet glycoprotein Ib supports experimental lung metastasis [J].PNAS, 2007, 104(21): 9024-9028.
[13] Terraube R, Pendu D. Increased metastatic potential of tumor cells in von Willebrand factor-decient mice [J]. J Thromb Haemos, 2006, 4(3): 519-526.
[14] 高苒, 刘学丽, 冯娟, 等. 荧光标记技术在肿瘤模型研究中的应用 [J]. 中国比较医学杂志, 2008, 18(5): 59-63.
Gao R, Liu XL, Feng J, et al. Research of fluorescence-labeled technique on tumor mouse model [J]. Chin J Comp Med, 2008, 18(5): 59-63.
[15] 赵勇, 伍静, 毛峰峰, 等. 裸鼠荷瘤实验中常见问题的解析和总结 [J]. 中国比较医学杂志, 2012, 22(7): 17-20.
Zhao Y, Wu J, Mao FF, et al. Summaries of the common problems in experiments with tumor-bearing nude mice [J]. Chin J Comp Med, 2012, 22(7): 17-20.
