肉豆蔻-8散提取物对过氧化氢诱导心肌细胞损伤的影响
2018-05-04张媛彦肖云峰李文妍王玉华
张媛彦,肖云峰,李文妍,王玉华*
(1内蒙古医科大学药学院,呼和浩特010110;2内蒙古医科大学新药安全评价研究中心,呼和浩特010110;3内蒙古自治区人民医院,呼和浩特010110)
肉豆蔻-8散是由沉香、肉豆蔻、丁香、广枣、木香、旋覆花、阿魏和牦牛心八味药材组成,该方最早收录于《普济方集》中[1]。目前该方剂被《内蒙古蒙药制剂规范》第二册收录[2]。该方具有镇“赫依”、止痛、温胃、祛“巴达干”、燥“协日乌素”的功效,临床用于各种“赫依”病、心“赫依”热、心烦、气短、失眠、心供血不足、心区疼痛、风湿性心脏病等。目前,本课题组对于肉豆蔻-8散的研究主要包括有效成分的含量测定、动物实验模型的药效学研究和药代动力学分析等[3-6]。课题组还对肉豆蔻-8散提取物的主要成分进行指认和定量分析,其有效成分包括丁香酚、鞣花酸、木香烃内酯、去氢木香内酯和去氢二异丁香酚等。肖云峰等[7]运用整体动物试验及测定内源性物质含量的方法,已从体内评价了该方剂对实验动物心脏的保护作用。
乳鼠原代心肌细胞的培养是一种可以排除体液、神经等干扰因素并保持心肌结构和功能稳定的体外实验研究模型。高效、稳定的培养原代心肌细胞有助于从细胞层面探讨心血管疾病的发病机制及其治疗手段[8]。H2O2作为高活性反应分子性氧簇(ROS)之一,极易通过细胞膜,它可以通过Haber-Weiss反应产生OH-,从而导致膜脂过氧化、DNA链断裂和蛋白质的损伤[9]。H2O2易获得、性质稳定且应用方便,常被用做体外氧化应激损伤模型建立的工具[10]。因此,本实验采用体外培养原代心肌细胞的方法,利用H2O2模拟体内的氧化应激损伤,首次从细胞层面进一步研究肉豆蔻-8散提取物对心肌的保护作用,以综合评价肉豆蔻-8散的临床应用价值及其可能的作用机制。
1 材 料
1.1 肉豆蔻-8散提取物的制备
称取肉豆蔻-8散10.0 g于500 mL圆底烧瓶中,加入75%乙醇250 mL,加热回流2次,每次30 min,合并滤液,蒸干得浸膏约3 g。取肉豆蔻-8散提取物约10 mg,精密称定,置10 mL量瓶中,加入DMSO 100μL使其完全溶解,用无血清培养液稀释至刻度,配成1 mg/mL肉豆蔻-8散提取物原液。用0.22μm微孔滤膜过滤除菌,4℃保存,使用时稀释成相应浓度。
1.2 试 剂
肉豆蔻-8散(内蒙古医科大学药学院制备);DMEM/F12培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);胰蛋白酶(中国Biotopped公司);Ⅱ型胶原酶(德国Sigma公司);30%过氧化氢(天津永晟精细化工有限公司);DMSO(中国Coolaber公司);MTT(美国 Amresco公司);RIPA裂解液(上海碧云天生物技术研究所);BCA试剂盒(上海碧云天生物技术研究所);lactate dehydrogenase(LDH)、creatine kinase(CK)、aspartate aminotransferase(AST)(宁波美康生物科技股份有限公司);Superoxide dismutase(SOD)、malonydialdehyde(MDA)、NO试剂盒(南京建成生物工程研究所);细胞凋亡试剂盒(美国BD公司)。
1.3 仪 器
超纯水系统(美国Millipore公司);台式高速冷冻离心机(德国Sigma公司);倒置式生物显微镜(德国Leica公司);酶标仪(日本Bio-rad公司);全自动生化分析仪(爱尔兰Sapphire公司);流式细胞仪(美国BD公司)。
1.4 动 物
清洁级,Wistar乳鼠,1~3 d龄,体重(6.66±2.00)g,购自内蒙古大学实验动物中心,实验动物生产许可证编号:SCXK(蒙)2014-0001。
2 方 法
2.1 原代乳鼠心肌细胞培养
实验操作在无菌条件下进行。取1~3 d龄Wistar乳鼠,浸泡75%酒精消毒。用眼科剪沿剑突正中线略偏左侧剪取心脏心尖部,置预冷的PBS缓冲溶液中清洗3遍,将其转移入0.1%胰酶中,均匀剪成约1 mm3的碎块,弃上清液。加入0.1%胰酶6 mL吹打管吹打,37℃水浴消化6 min,不断振摇,自然沉降后,弃上清液。再加入0.08%胰酶与0.05%Ⅱ型胶原酶的混合酶5 mL于37℃水浴消化5 min,中间振摇3 min,吸取上清液,用等体积预冷含10%FBS的DMEM/F12培养基终止消化,重复消化10次。细胞悬液经200目筛网过滤至离心管中,1 000 r/min,离心 10 min。用含 20%FBS的完全培养基重悬细胞后,将细胞转移至培养瓶中,37℃、5%CO2孵箱中培养1 h,以差速贴壁的方法去除已贴壁的成纤维细胞。吸出细胞悬液转移至另一培养瓶中,加入终浓度为0.1 mmol/L的5-溴脱氧尿嘧啶40μL,以抑制成纤维细胞的生长,继续培养,48 h后换液。取培养3 d同步搏动的心肌细胞用于实验。
2.2 分组及给药
实验共分为5组:正常对照组、模型组、肉豆蔻-8散(高、中、低)剂量组。正常对照组加入无血清培养液培养,作用12 h后换液,继续用无血清培养液培养2 h;模型组加入无血清培养液培养,作用12 h后换液,加入终浓度为100μmol/L H2O2的无血清培养液,作用2 h;肉豆蔻-8散低、中、高剂量组分别加入终浓度为25、50、100μg/mL含肉豆蔻-8散提取物的无血清培养液,作用12 h后换液,再加入终浓度为100μmol/L H2O2的无血清培养液,作用2 h。
2.3 MTT法检测心肌细胞活力
2.3.1 H2O2诱导心肌细胞损伤模型的建立 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度每毫升3×105个,在96板上每孔接种100μL。在培养箱中培养24 h后,吸弃原培养液。正常对照组每孔加入无血清培养液100μL;模型组每孔加入H2O2终浓度分别为25、50、100、200、400μmol/L无血清培养液 100μL。在孵箱中继续培养2 h后,每孔加入 MTT溶液(0.5 mg/mL)20μL,继续孵育4 h,吸弃原培养液,每孔加入 DMSO 150μL,振荡10 min,于酶标仪490 nm处读取吸收度,计算细胞抑制率。
2.3.2 肉豆蔻-8散提取物对正常心肌细胞的影响取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度为每毫升3×105个,在96板上每孔接种100μL。在培养箱中培养24 h后,吸弃原培养液。正常对照组每孔加入无血清培养液100μL;给药组每孔加入含肉豆蔻-8散提取物终浓度分别为 25、50、100μg/mL的无血清培养液100μL。在孵箱中继续培养12 h后,采用MTT法检测心肌细胞活力。
2.3.3 肉豆蔻-8散提取物对H2O2诱导心肌细胞损伤的影响 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度为每毫升3×105个,在96板上每孔接种100μL。在培养箱中培养24 h,吸弃原培养液。实验分组及给药按照“2.2”项下操作,孵育2 h结束后,于倒置显微镜下观察各孔中细胞的形态学变化,并采用MTT法检测细胞存活率。细胞存活率为各组吸收度和正常组吸收度的比值。
2.4 生化指标检测
2.4.1 培养液中LDH、CK、AST含量的检测 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度为每毫升6×105个,在6板上每孔接种2 mL。在培养箱中培养24 h,吸弃原培养液。实验分组及给药按照“2.2”项下操作,孵育2 h结束后,分别收集各孔培养液。1 000 r/min,离心7 min,吸取上清液至离心管中,每组平行处理6份。采用全自动生化分析仪对处理好的样本进行检测,检测指标包括LDH、CK和AST。
2.4.2 细胞中MDA、SOD、NO含量的检测 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度为每毫升6×105个,在6板上每孔接种2 mL。在培养箱中培养24 h,吸弃原培养液。实验分组及给药按照“2.2”项下操作,孵育2 h结束后,弃去每孔培养液,每孔加入PBS缓冲液2 mL,用细胞刮刀收集各组细胞并重悬,1 000 r/min,5 min,弃上清液。用 RIPA裂解液于冰台上裂解细胞,进行BCA定量,严格按照试剂盒操作说明书测定细胞中MDA、SOD、NO的含量。
2.5 肉豆蔻-8散提取物对H2 O2诱导的心肌细胞损伤凋亡的影响
2.5.1 Hoechst染色观察心肌细胞凋亡形态 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调细胞密度为每毫升2×105个,在24孔板上每孔接种0.5 mL,在培养箱中培养24 h,吸弃原培养液。实验分组及给药按照“2.2”项下操作,孵育2 h结束后,弃去每孔培养液。每孔加入Hoechst 33342染液250μL,避光孵育30 min,弃去染液,PBS缓冲液清洗3次,于荧光显微镜下观察心肌细胞凋亡形态。
2.5.2 流式细胞仪检测心肌细胞凋亡率 取培养3 d同步搏动的心肌细胞,用0.25%胰酶消化细胞。调整细胞密度为每毫升1×106个,在6板上每孔接种2 mL。在培养箱中培养24 h,吸弃原培养液。实验分组及给药按照“2.2”项下操作,孵育2 h结束后,分别收集各孔培养液。1 000 r/min,离心5 min,弃去上清液。用0.25%胰酶消化不同组别孔底的心肌细胞。消化过程终止后,1 000 r/min,离心5 min,弃去上清液。合并以上两次所得细胞,用PBS缓冲液清洗2次,弃去PBS缓冲液,加入1×结合缓冲液100μL重悬细胞,按照AnnexinV/PI凋亡检测试剂盒操作说明,1 h内完成检测。
2.6 统计学分析
采用SPSS 22.0软件进行数据分析和统计,所有数据均用¯x±s表示,组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异具有统计学意义。
3 结 果
3.1 H2O2诱导的心肌细胞损伤模型的建立
与正常对照组比较,不同浓度的H2O2组均有极显著性差异(P<0.01)。随H2O2剂量增大,心肌细胞损伤率增加且呈浓度依赖性。其中,加入100μmol/L H2O2抑制率达到50%左右,符合实验要求。因此,选择100μmol/L H2O2作为实验损伤模型。结果见图1。
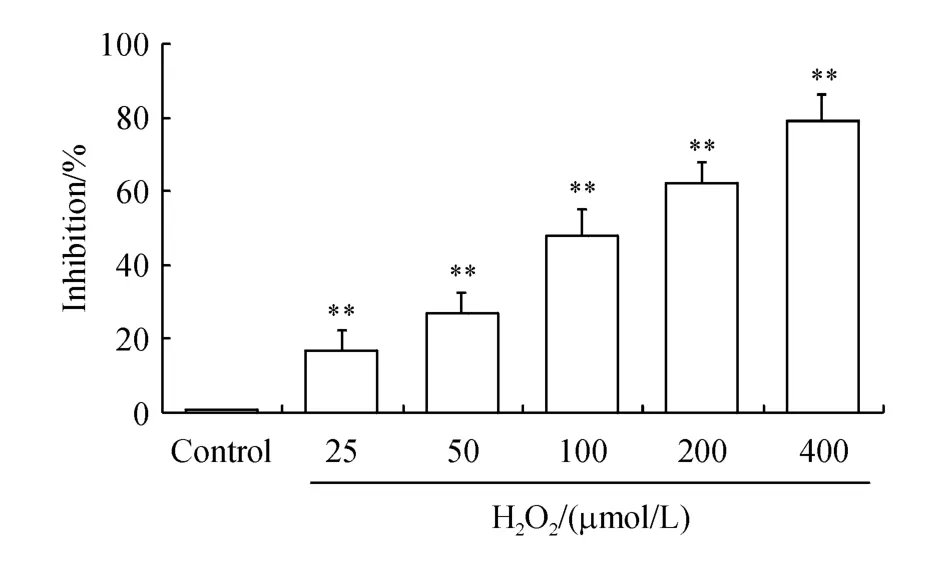
Figure 1 H2 O2-induced cardiomyocyte injurymodel**P<0.01 vs control group
3.2 肉豆蔻-8散提取物对正常心肌细胞的影响
与正常对照组比较,各给药组对心肌细胞活力无明显影响(P>0.05)。这表明肉豆蔻-8散提取物对正常心肌细胞没有影响,不会干扰后续肉豆蔻-8散提取物对H2O2诱导心肌细胞损伤影响的实验结果。结果见图2。
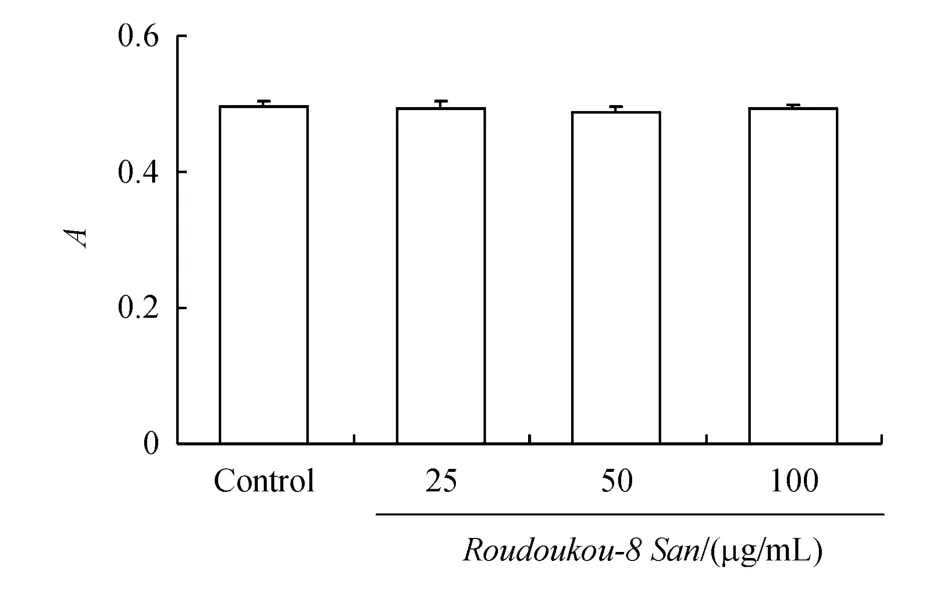
Figure2 Effectof Roudoukou-8 San on normal cardiomyocytes(¯x±s,n=6)
3.3 肉豆蔻-8散提取物对H2 O2诱导心肌细胞损伤的影响
如图3所示,与正常对照组比较,模型组吸收度显著降低,细胞存活率显著下降,说明模型组心肌细胞活力明显下降(P<0.01)。25、50、100 μg/mL肉豆蔻-8散各剂量组与模型组相比,其细胞存活率均有所提高,且具有极显著性差异(P<0.01)。肉豆蔻-8散低剂量组与高剂量组之间具有极显著性差异(P<0.01),中剂量组与高剂量组之间具有显著性差异(P<0.05)。说明肉豆蔻-8散提取物能明显提高H2O2损伤心肌细胞的活力,且作用呈剂量依赖性,以高剂量组保护作用最佳。
3.4 肉豆蔻-8散提取物对H2O2诱导心肌细胞损伤的形态学影响
于倒置光学显微镜下观察,分组处理前,各组心肌细胞生长状态良好。不同实验组经药物干预之后,正常组呈单层簇状生长,且伪足多而饱满,搏动明显,节律一致;H2O2模型组出现细胞间隙增大、细胞数减少、细胞胞浆空泡、伪足少、细胞脱落、悬浮、溶解坏死等明显损伤现象;肉豆蔻-8散各剂量组与H2O2模型组比较,心肌细胞形态不同程度好转,且以高剂量(100μg/mL)组改善效果最明显。结果见图4。

Figure 3 Effects of Roudoukou-8 San on H2 O2-induced cardiomyocyte injury(¯x±s,n=6)**P<0.01 vs Control;##P<0.01 vs Modol;△P<0.05,△△P<0.01 vs Roudoukou-8 San(100μg/mL)
3.5 心肌细胞培养液中LDH、CK和AST的含量
与正常对照组比较,模型组上清液中LDH、CK和AST释放量显著增加(P<0.01);与模型组相比,肉豆蔻-8散低剂量组(25μg/mL)、中剂量组(50μg/mL)、高剂量组(100μg/mL)上清液中LDH、CK和AST含量明显下降(P<0.01),且随着给药组浓度增加呈剂量依赖性。结果见表1。
3.6 心肌细胞中MDA、SOD、NO的含量
与正常对照组相比,模型组心肌细胞内SOD活力明显降低(P<0.01),MDA和NO含量明显增加(P<0.01);与模型组相比,肉豆蔻-8散低剂量组(25μg/mL)心肌细胞内 SOD活力上升(P<0.05),中剂量组(50μg/mL)和高剂量组(100μg/mL)心肌细胞内 SOD活力明显上升(P<0.01);各剂量肉豆蔻-8散给药组均可明显降低心肌细胞内MOD和NO水平(P<0.01),且随着给药组浓度增加呈剂量依赖性。结果见表2。
3.7 Hoechst染色观察心肌细胞凋亡形态
Hoechst荧光细胞核染色结果显示,正常对照组心肌细胞成均一的核染,且未见异常核,见图5-A;模型组细胞呈典型凋亡状态,镜下可见染色质浓集、核固缩、核碎裂、细胞数量少等多种凋亡形态学特征,见图5-B;肉豆蔻-8散低、中、高剂量组可见核固缩、破裂等现象明显减小、细胞数量较模型组增多,其细胞形态分别见图5-C、5-D、5-E。
3.8 流式细胞仪检测心肌细胞凋亡率
结果显示,正常对照组只有少部分细胞发生凋亡,见图6-A;模型组早期凋亡和晚期凋亡细胞数明显增加,见图6-B;而肉豆蔻-8散各剂量组与模型组相比,细胞的凋亡情况明显减少,但并不可以恢复至正常水平,见图6-C、6-D、6-E。
对流式细胞图导出的数据进行统计分析,计算心肌细胞凋亡率,结果见表3。
Table 1 Content of LDH,CK and AST in the culture solution of cardiomyocytes

Table 1 Content of LDH,CK and AST in the culture solution of cardiomyocytes
**P<0.01 vs control grop;##P<0.01 vs model groupLDH:Lactate dehydrogenase;CK:Creatine kinase;AST:Aspartate aminotransferase
Group LDH(U/L) CK(U/L) AST(U/L)Control 20.18±4.93 5.38±1.14 2.10±0.42 Model 73.97±8.80** 12.13±1.26** 11.18±0.74**Roudoukou-8 San(25μg/mL) 53.55±5.22## 9.8±0.73## 7.90±0.69##Roudoukou-8 San(50μg/mL) 46.13±4.88## 8.58±0.66## 6.13±0.54##Roudoukou-8 San(100μg/mL) 27.15±5.13## 7.30±0.64## 4.03±0.46##
Table 2 Contents of MDA,SOD,and NO in myocardial cells

Table 2 Contents of MDA,SOD,and NO in myocardial cells
*P<0.05,**P<0.01 vs control grop;##P<0.01 vs model group MDA:Malonydialdehyde;SOD:Superoxide dismutase;NO:Nitric oxide
Group MDA/(nmol/mg prot) SOD/(U/mg Hb) NO/(μmol/L)Control 0.65±0.12 67.92±8.51 6.24±1.49 Model 2.82±0.30** 35.38±5.79** 36.25±3.30**Roudoukou-8 San(25μg/mL) 1.99±0.16## 43.03±4.79* 27.13±4.28##Roudoukou-8 San(50μg/mL) 1.56±0.25## 50.30±5.14## 16.02±3.36##Roudoukou-8 San(100μg/mL) 0.95±0.12## 59.84±6.41## 10.10±2.13##

Figure 5 Hoechst staining to observe the apoptoticmorphology of cardiomyocytesA:Control;B:Model;C:Roudoukou-8 San(25μg/mL);D:Roudoukou-8 San(50μg/mL);E:Roudoukou-8 San(100μg/mL)

Figure 6 Flow cytometry detection ofmyocardial cell apoptosis rateA:Control;B:Model;C:Roudoukou-8 San(25μg/mL);D:Roudoukou-8 San(50μg/mL);E:Roudoukou-8 San(100μg/mL)
Table 3 Apoptosis rate of cardiomyocytes detected by flow cytometry

Table 3 Apoptosis rate of cardiomyocytes detected by flow cytometry
**P<0.01 vs control group;##P<0.01 vs model grop
Group Apoptosis rate/%Control 3.68±0.69 Model 51.19±2.02**Roudoukou-8 San(25μg/mL) 35.90±2.14##Roudoukou-8 San(50μg/mL) 29.20±1.88##Roudoukou-8 San(100μg/mL) 15.82±1.81##
结果显示,与正常对照组比较,模型组有极显著性差异(P<0.01),H2O2模型组细胞凋亡率显著增加;与模型组比较,肉豆蔻-8散各剂量组均有极显著性差异(P<0.01),肉豆蔻-8散各剂量组心肌细胞凋亡率显著下降,表明肉豆蔻-8散提取物可以显著降低H2O2诱导的心肌细胞凋亡,且凋亡率随肉豆蔻-8散剂量的增加逐渐降低。
4 讨 论
本研究对原代乳鼠心肌细胞进行分离和培养,利用100μmol/L H2O2建立体外心肌氧化损伤模型。MTT检测结果显示,H2O2能够使细胞活力显著减低,肉豆蔻-8散提取物可以增加H2O2损伤心肌细胞的活力。通过倒置光学显微镜和Hoechst染色后荧光显微镜下观察发现肉豆蔻-8散提取物能够显著改善H2O2诱导状态下心肌细胞形态、增高其存活率并降低其凋亡率。
心肌酶活性变化是判断心肌损伤的重要标志。目前临床上多以血清中LDH、CK、AST活性升高作为心肌缺血的早期诊断指标,LDH还可以作为衡量细胞坏死的指标[11-12]。正常生理状态下,心肌细胞中心肌酶LDH、CK和AST活性非常低,而当心肌细胞膜受损后,心肌酶将迅速大量释放,导致细胞培养基中LDH、CK和AST含量明显增高[13]。实验结果显示,用H2O2干预的肉豆蔻-8散不同剂量组均能够显著降低细胞培养液中LDH、CK和AST活性且呈剂量依赖性,表明肉豆蔻-8散提取物能够抑制损伤心肌细胞LDH、CK和AST的漏出,维护细胞膜的完整性,起到保护心肌细胞的作用。
不饱和脂肪酸是细胞膜主要成分之一,在氧自由基的攻击下极易发生脂质过氧化而生成MDA。MDA的含量常常可反映机体内脂质过氧化的程度,能够间接反映出心肌细胞损伤的程度[14];SOD是生物体内清除自由基的重要酶类之一,是评估机体抗氧化防御体系功能的重要指标。SOD可对抗或阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,具有特殊的生理活性[15];NO是一种新型的生物信息递质,NO的含量过高会对心肌细胞产生强烈的毒性损伤[16-17]。实验结果表明,肉豆蔻-8散各剂量组细胞内MDA含量较模型组明显降低,SOD活力明显比模型组增高;经H2O2损伤后,心肌细胞内NO含量明显升高,造成线粒体酶活性被抑制。肉豆蔻-8散提取物可明显降低损伤后心肌细胞内NO含量。
本实验通过流式细胞仪AnnexinV/PI染色,测定细胞凋亡率。实验结果显示,肉豆蔻-8散提取物可明显抑制心肌细胞凋亡,对H2O2损伤的心肌细胞凋亡有明显保护作用。
本研究认为肉豆蔻-8散提取物对心肌细胞具有显著抗过氧化损伤保护作用,可以抑制细胞凋亡,提示肉豆蔻-8散可能成为良好的防治心血管疾病的物质基础,有望为心血管疾病的治疗发挥重要作用。
[1] Akewang LD.Pu Ji Preparation(普济方集)[M].Inner Mongolia:Inner Mongolia Science and Technology Press,1986.
[2] Inner Mongolia Autonomous Region Food and Drug Administration.Inner Mongolia Mongolian Medicine Preparation Specification(内蒙古蒙药制剂规范)[S].Inner Mongolia:Inner Mongolia People′s Publishing,2014:152.
[3] Wang W,Han JW,Sun LJ,et al.Determination of quercetin in Baweichenxiang capsule by HPLC[J].Chin New Drugs(中国新药杂志),2010,19(18):1719-1721.
[4] Hao ML,Ji XW,Wang YH.Determination of eugenol inBaweichen-xiangcapsule by GC[J].Chin Tradi Pat Med(中成药),2010,32(1):166-168.
[5] Gao WJ,Mei LP,Wang YH.Determination of total flavone content in Roudoukou Bawei capsules by colorimetry[J].Chin Pharm(中国药业),2014,23(24):63-65.
[6] Xiao YF,Gao WJ,Ji XW,et al.Comparion research the pharmacokinetic of eugenol in mongolian medicine Baweichenxiangsan with different animal heart[J].Chin J Biochem Pharm(中国生化药物杂志),2016,36(2):176-181.
[7] Xiao YF,Li WY,Wang YH.Protective effect of Roudoukou Bawei capsule on experimental animals′heart[J].Chin Tradi Pat Med(中成药),2016,38(4):898-902.
[8] Liu B,Liu XL,Pan GL,et al.Improvement ofmethod of primary culturing myocardial cells of neonata rat[J].Central South Pharm(中南药学),2017,15(1):18-21.
[9] Lakshmi SV,Padmaja G,Kuppusamy P,et al,Oxidative stress in cardiovascular disease[J].Indian J Biochem Bioophys,2009,46(6):421-440.
[10]He L,Sun GB,Chen RC,et al.Research progress on myocardial cell injurymodel[J].Pharmacol Clin Chin Mater Clin Med(中药药理与临床),2010,26(6):81-84.
[11]Liu YB.Clinical significance of four myocardial markers in the diagnosisof acutemyocardial infarction[J].Chin JMod Drug Appl(中国现代药物应用),2014,8(15):80-81.
[12]Sun H,Yang JP,Mao Y.Involvement of Fas-dependent pathway in rhein-induced apoptosis of HK-2 cells[J].J China Pharm Univ(中国药科大学学报),2015,46(4):469-475.
[13]Meng JF.The Protective effect of rehmannia polysaccharide on H2O2induced neonatal rat cardiomyocyte injury and itsmechanism[J].Pharmacol Clin Chin Mater Clin Med(中药药理与临床),2016,7(1):90-95.
[14]Feng Y,Wang JH,Shen CX,et al.Elevation of plasma lipid peroxides in patients with acute coronary syndrome[J].J Southeast Univ(Med Sci Edi)(东南大学学报 医学版),2007,26(2):98-101.
[15]Wei SJ,Ren ZT,Yang XY,et al.Protective effects of laminaria polysaccharide sulfate on ardiomyocytes of neonatal rat injuried by hydrogen peroxide(H2O2)[J].Chin JMar Drugs(中国海洋药物),2015,34(2):39-44.
[16]Ni W,Chen F.Antioxidation of yindanxinnaotong capsule on myocardial injury induced by hypoxia and reoxygenation[J].Chin J Interg Med Cardio-/Cerebrov Ascular Disease(中西医结合心脑血管病杂志),2008,11(6):1308-1309.
[17]Tatsumi T,Matoba S,Kawahara A,et al.Cytokine induced nitric oxide production inhibits mitochondrial energy production and impairs contractile function in rat cardiac myocytes[J].Am Coll Cardiol,2000,35(5):1338-1346.
