AMPK在二甲双胍诱导结肠癌细胞SW480自噬中的作用
2018-05-03董德嘉李胜龙王夫景
董德嘉 李胜龙 王夫景
结肠癌是消化道常见肿瘤,在我国及世界范围内其发病率与病死率呈逐年升高趋势[1]。手术及化疗是结肠癌治疗的主要手段,但术后复发与化疗耐药大大降低了治疗效果,因此迫切需要寻找新的治疗药物。近年来研究发现,二甲双胍对多种肿瘤具有预防与治疗作用[2-3],并能通过激活AMPK从而诱导自噬(autophagy)发生[4-5]。自噬是当细胞自稳态发生改变或机体受外界的各种刺激的情况下,细胞借此回收或清除胞内多余或损伤的细胞器及胞内成分的一个过程[6]。自噬对肿瘤的作用可谓是一把“双刃剑”,低水平的自噬能促进肿瘤细胞生存,但过量的自噬极有可能导致细胞死亡[7]。本实验以体外培养的人结肠癌细胞株SW480为模型,探讨AMPK在二甲双胍诱导SW480细胞自噬中的作用,以了解二甲双胍潜在的抗肿瘤机制。
材料与方法
一、材料与试剂
人结肠癌细胞株SW480购于中国科学院细胞库,于-80 ℃冻存;二甲双胍、雷帕霉素(RAPA)、3-甲基腺嘌呤(3-Methyladenine,3-MA)购买于Sigma公司;p-AMPK、AMPK、LC3、p62抗体购于Cell Signal Technology公司,β-actin抗体购自Santa Cruz公司;细胞培养基和胎牛血清购于Gibco公司;PVDF膜、ECL显影液和HRP标记山羊抗兔IgG购于Millpore公司;cDNA逆转录试剂盒、SYBR Green I染料、Lipofectamine 200转染试剂购自Invitrogen公司;其余化学试剂均为分析纯。
二、方法
1.细胞培养 SW480细胞株培养于含37 ℃、5%CO2、10%胎牛血清、1%青链霉素的RPMI1640完全培养基中,隔天传代1次。
2.Western blot检测蛋白表达 收集细胞于Eppendorf管中,弃掉上清液并将细胞悬浮于裂解液中,超声破碎细胞,冰上裂解30 min后,4 ℃, 15 000 r/min离心10 min,取上清,采用BCA法测定上清液中蛋白质含量,并取等量蛋白上样,经SDS-PAGE凝胶电泳后,低温转移至PVDF膜,封闭,分别加入相应一抗和二抗,经增强化学发光法(ECL)系统显色,用数字成像仪对图像进行拍照和分析。
3.实时荧光定量PCR检测mRNA表达 用Trizol法提取细胞总RNA,反向转录成cDNA,以cDNA为模板,采用SYBR Green进行实时荧光PCR反应。反应参数:95 ℃ 10 min,1个循环;95 ℃ 15 s,60 ℃ 60 s,40个循环,样本中目的基因表达的计算方法为2-ΔΔCt[8]。各基因引物序列见表1。
4.RNA瞬时干扰AMPK的siRNA序列 (5'-CGU UAC CUA GCA UCA AUU Gtt-3')和阴性干扰RNA 链购于ambion公司。当细胞密度达40%~50%时,将siAMPK和阴性干扰RNA 链各100 pmol置于250 μl Opti-MEM(r) I Reduced Serum Medium培养液中。同时将两份各5μl的lipofectamine 2000置于250 μl Opti-MEM(r) I Reduced Serum Medium培养液中。把上述含siRNA 的培养液与含lipofectamine 2000的培养液二者混合,加入细胞中。孵育6 h后改换10% RPMI-1640的常规培养液培养。
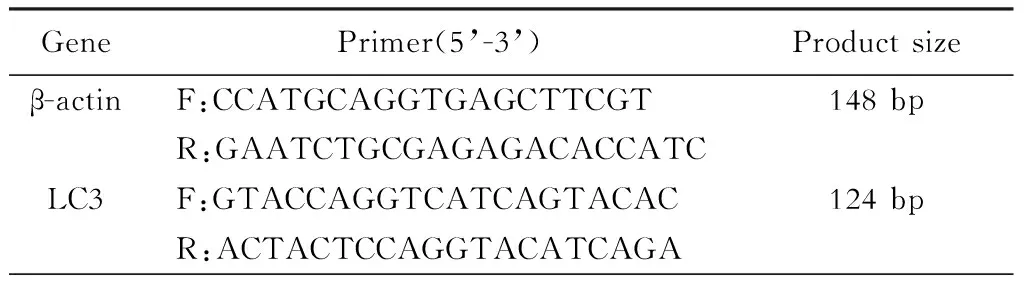
表1 实时荧光定量PCR引物序列和产物大小
三、统计学方法

结 果
一、二甲双胍对SW480细胞AMPK活性影响
不同浓度(1、5、10 mmol/L)二甲双胍处理SW480细胞24 h,并设置阴性对照组。采用Western blot法检测AMPK及其磷酸化蛋白表达情况,见图1。与阴性对照组相比,随着二甲双胍剂量的增加,AMPK总蛋白水平未见明显变化,但磷酸化水平逐渐增加。结果表明二甲双胍可以诱导人结肠癌SW480细胞AMPK的活化。
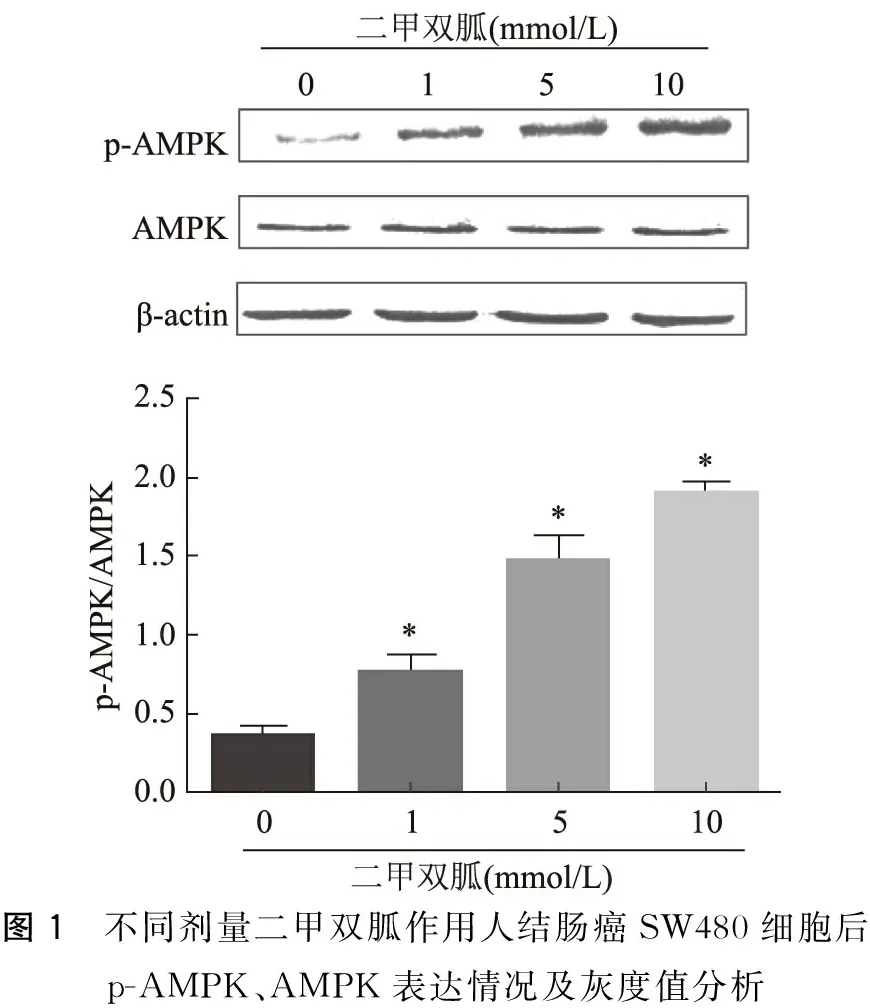
图1 不同剂量二甲双胍作用人结肠癌SW480细胞后p-AMPK、AMPK表达情况及灰度值分析
二、二甲双胍对SW480细胞自噬相关蛋白及自噬相关基因表达的影响
不同浓度(1、5、10 mmol/L)二甲双胍处理SW480细胞24 h,并设置阴性对照组、雷帕霉素阳性对照组,采用Western blot法检测自噬标志蛋白LC3和p62的表达情况,见图2A;荧光定量PCR技术检测LC3 mRNA表达,见图2B。二甲双胍处理前2 h用5 mmol/L的3-MA抑制自噬,再用10 mmol/L二甲双胍处理24 h,实验分为阴性对照、3-MA、二甲双胍、二甲双胍+3-MA共4组,Western blot检测自噬标志蛋白LC3和p62的表达情况,见图2C。结果表明,随着二甲双胍剂量的增加,自噬标志蛋白LC3表达逐渐增加,p62表达逐渐降低。而3-MA可明显抑制二甲双胍的作用。以上结果表明二甲双胍能诱导人结肠癌SW480细胞发生自噬。
三、沉默AMPK对二甲双胍诱导SW480细胞自噬的影响
二甲双胍处理前用siRNA沉默AMPK后,用10 mmol/L的二甲双胍处理细胞24 h,实验分为阴性对照、siRNA、Met、Met+siRNA 4组。结果如图3所示,与对照组相比二甲双胍明显活化AMPK,自噬相关蛋白LC3表达也显著增加,p62表达则明显降低,LC3mRNA表达增高。Met+siRNA组AMPK活性明显降低,LC3表达下降,而p62表达升高,LC3 mRNA表达降低。以上结果表明,沉默AMPK后,二甲双胍诱导的SW480细胞自噬水平明显下降。
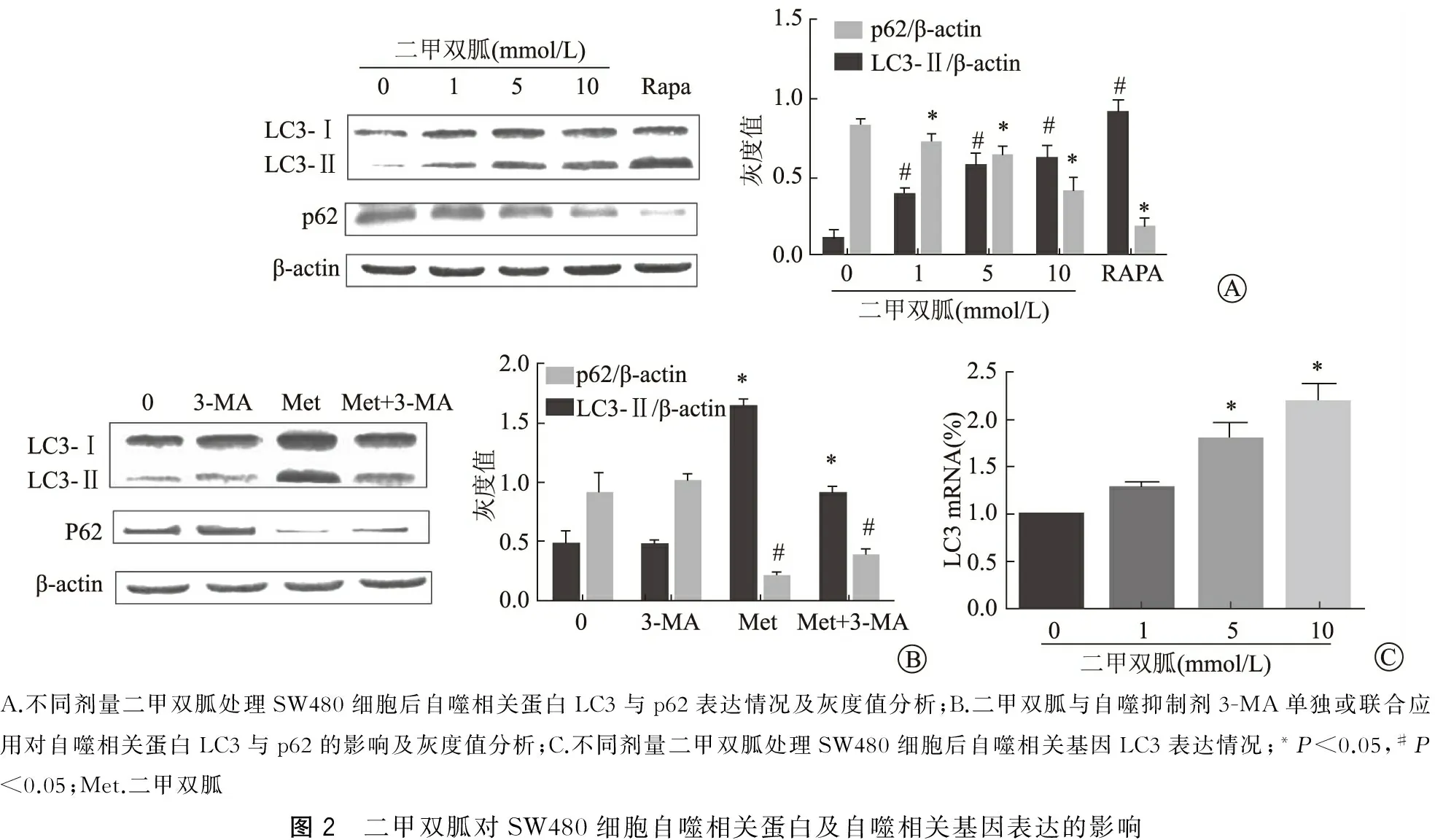
A.不同剂量二甲双胍处理SW480细胞后自噬相关蛋白LC3与p62表达情况及灰度值分析;B.二甲双胍与自噬抑制剂3-MA单独或联合应用对自噬相关蛋白LC3与p62的影响及灰度值分析;C.不同剂量二甲双胍处理SW480细胞后自噬相关基因LC3表达情况;*P<0.05,#P<0.05;Met.二甲双胍图2 二甲双胍对SW480细胞自噬相关蛋白及自噬相关基因表达的影响
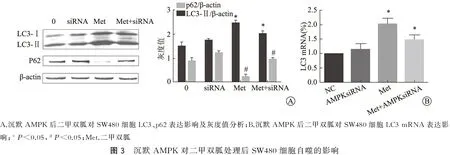
A.沉默AMPK后二甲双胍对SW480细胞LC3、p62表达影响及灰度值分析;B.沉默AMPK后二甲双胍对SW480细胞LC3mRNA表达影响;*P<0.05,#P<0.05;Met.二甲双胍图3 沉默AMPK对二甲双胍处理后SW480细胞自噬的影响
讨 论
二甲双胍是临床上广泛应用的一种口服降糖药,具有改善胰岛素抵抗,减轻体重,改善脂代谢,抗氧化等特点,近年来研究发现其还具有预防和治疗肿瘤的作用。AMPK即腺苷酸活化蛋白激酶,是机体内的能量感受器,在能量代谢、细胞凋亡与自噬调控中发挥关键作用[9]。缺氧、能量缺乏等应激条件下,细胞内AMP与ATP比值升高可激活AMPK。Zakikhani等[10]的研究发现,二甲双胍可能通过AMPK信号通路起到抑制肿瘤的作用。体外细胞试验及动物学试验研究同样表明二甲双胍能通过激活AMPK抑制mTOR信号通路从而抑制肿瘤的生长[11]。本研究采用不同浓度二甲双胍作用于SW480细胞24 h后检测AMPK及其磷酸化蛋白表达情况,结果表明随着二甲双胍浓度增加,AMPK活性逐渐增加。结果表明,二甲双胍可以诱导SW480细胞中AMPK的活化。
自噬是细胞降解自身细胞器、无用生物大分子的特定生物学过程,从而满足细胞自身的代谢需要和应对特定的应激状态[12]。自噬虽能一定程度帮助细胞应对各种应激条件,但过度激活自噬也会导致细胞死亡,这一过程被称作是Ⅱ型程序性细胞死亡[13]。自噬发生时,胞质型LC3即LC3-Ⅰ会酶解掉一小段多肽,转变为自噬体膜型即LC3-Ⅱ,因此,LC3-Ⅱ的水平可估计自噬水平的高低。此外,p62作为被自噬特异性降解的一种蛋白质,其表达水平一定程度上也反映了自噬的水平[14]。本研究结果显示,SW480细胞内LC3-Ⅱ蛋白表达水平以及其mRNA水平均随着二甲双胍作用浓度的增加而增高,而p62蛋白水平随着二甲双胍浓度的增加表达减少,以上结果表明二甲双胍能够诱导SW480细胞发生自噬。
越来越多的研究发现,AMPK在自噬中起到关键作用。AMPK不仅能通过mTOR、p53调控自噬,还可通过直接磷酸化ULK1诱导自噬的发生。Hung等[15]的研究发现AMPK在肝癌细胞发生自噬中起到关键作用,AMPK活化后引起TSC1/2的活性升高,从而抑制GTP 联合蛋白Ras,进一步抑制mTOR的生物学功能,诱导自噬发生[16]。本研究采用RNAi技术沉默SW480细胞中AMPK表达,探讨AMPK在自噬中的作用。结果显示,AMPK沉默后,二甲双胍诱导的LC3表达明显下调,LC3的mRNA表达也明显下降,p62的表达则显著增加。该结果表明,AMPK在二甲双胍诱导SW480细胞自噬中发挥重要作用。
以上结果表明,二甲双胍诱导了SW480细胞中AMPK的活化,并且AMPK在二甲双胍诱导的细胞自噬中起到关键作用。本研究进一步阐明了二甲双胍抑制肿瘤细胞的分子机制,在对于结肠癌的术后化疗及辅助化疗有指导意义,可在临床工作中的术后化疗及辅助化疗中加用二甲双胍。协同抗肿瘤药物使用。后续工作需建立动物模型,研究二甲双胍是否影响动物肿瘤细胞中AMPK活性。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics.CA Cancer J Clin,2011,61:69-90.DOI:10.3322/caac.20107.
2 Evans JM,Donnelly LA,Emslie-Smith AM,et al.Metformin and reduced risk of cancer in diabetic patients.BMJ,2002,330:1304-1305.
3 Bowker SL,Majumdar SR,Veugelers P,et al.Increased cancerrelatedmortality for patients of type 2 diabetes who use sulfonylureas or insulin.Diabetes Care,2006,29:254-258.
4 Jung HS,Chung KW,Won Kim J,et al.Lossof autophagy diminishes pancreatic beta cell mass and function with resultant Hyperglycemia.Cell Metab,2008,8:318-324.
5 Choi SE,Lee SM,Lee YJ,et al. Protective role of autophagy in palmitate-induced INS-1 beta-cell death.Endocrinology,2009,150:126-134.DOI:10.1210/en.2008-0483.
6 Marsh BJ,RegulatedSoden C,Alarcon C,et al.Autophagy controls hormone content in secretory-deficient pan endocrine beta cells.Mol Endocrinal, 2007,21:2255-2269.
7 White E.Deconvolution the context-dependent role for autophagy in cancer.Nat Rev Cancer,2012,12:401-410.DOI:10.1038/nrc3262.
8 Livak KJ,SchmittgenTD.Analysis of relative gene expressiondata using real-time quantitative PCR and the 2-ΔΔCtmethod.Methods,2001,25:402-408.
9 Hardie DG,Ross FA,Hawley SA.AMPK:a nutrient and energy sensor that maintains energy homeostasis.Nat Rev Mol Cell Biol,2012,13:251-262.DOI:10.1038/nrm3311.
10 Zakikhani M,Dowling R,Sonenberg N,et al.The effects of adiponectin and metformin on prostate and colon neoplasia involveactivation of AMP-activated protein kinase.Cancer Prev Res,2008,1:369-375.
11 Zhou G,Myers R,Li Y,et al.Role of AMP-activated protein kinase in mechanism of metformin action.J Clin Invest,2001,108:1167-1174.
12 Eskelinen EL,Saftig P.Autophagy:a lysosomal degradation pathway with a central role in health and disease.Biochim Biophys Acta,2009,1793:664-673.
13 Levine B,Kroemer G.Autophagy in the pathogenesis of disease.Cell,2008,132:27-42.
14 Takamura A,Komatsu M,Hara T,et al.Autophagy-deficient mice develop multipleliver tumors.Genes Dev,2011,25:795-800.DOI:10.1101/gad.2016211.
15 Hung CM,Su YH,Lin HY,et al.Desmethoxycurcumin modulates prostate cancer cell proliferation ia AMPK-induced down-regulation of HSP70 and EGFR.J Agric Food Chem,2012,60: 8427-8434.DOI:10.1021/jf302754w.
16 Scarlatti F, Bauvy C, Ventruti A,et al.Ceramide-mediated macro autophagy involves inhibition of protein kinase B and up-regulation of beclin-1. J Biol Chem,2004,279:18384-18391.DOI:10.1074/jbc.M313561200.
17 Pennanen P,Syvälä H,Bläuer M,et al.The effects of metformim and simvastation on the trowth of LNC a P and RWPE-1 prostate epithelial cell lines .Eur J Pharmacol,2016,788:160-167.DOI:10.1016/j.ejphar.2016.06.036.
18 Feng Y,Ke C,Tang Q,et al.Metform in promotes autophagy and apoptosis in esophageal squamous cell carcinoma by downregulating Stat3 signaling.Cell Death Dis,2014,5:e1088.DOI:10.1038/cddis.2014.59.
19 Shi WY,Xiao D,Wang L,et al.Therapeutic metform in/AMPK activation blocked lymphoma cell growth via inhibition of mTOR pathway and induction of autophagy.Cell Death Dis,2012,3:e275.DOI:10.1038/cddis.2012.13.
20 Nazim UM,Moon JH,Lee JH,et al.Activation of autophagy flux by metform in downregulates cellular FLICE-like inhibitory protein and enhances TRAIL-induced apoptosis.Oncotarget,2016,7:23468-23481.DOI:10.18632/oncotarget.8048.
21 Chae YK,Arya A,Malecek MK,et al.Repurposing metform for cancer treatment:Current clinical studies.Oncotarget,2016,7:40767-40780.DOI: 10.18632/oncotarget.8194.
