半自动连续发酵残次鲜红枣醋及其有机酸分析
2018-05-03向进乐
向进乐
关随霞1,3
马丽苹1,2,3
任广跃1,2
袁云霞1,2
康怀彬1,2
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省食品原料工程技术研究中心,河南 洛阳 471023;3.洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
枣(ZizyphusjujubeMill.)为鼠李科(Rhamnaceae)枣属(ZizyphusMill.)植物,原产于中国,已有4 000多年的栽培历史。枣树为多花植物,落花落果现象严重[1-2]。另外,枣果易开裂,在红枣生长期即使不易开裂品种,裂果率也有15%左右;成熟期多雨的年份,其裂果率可达50%~80%;红枣的优质率较低,残、次、落果率较高[2]。在临近收获期如遇到连阴雨天气,会在很短时间内产生大批的裂枣和落果[2]。鲜枣的加工利用基本都是优质枣,大多通过干燥制成商品进入市场,优质干枣价格较高。残次鲜枣往往由于商品价值低,未能及时有效处理而变成了农业废弃物。
而残次枣和优质枣同样具有含糖量高的优点,开发天然发酵食品极具优势[3-4]。李艺伟等[5]以残次干红枣为原料,经加水浸提制得枣汁,利用枣汁培养可食性酵母菌生产风味型酵母味素作为食品调味剂,为提高残次红枣加工利用率提供了思路。张宝善等[6]以陕北残次干枣为原料,研究不同发酵方式对红枣醋品质、生产周期以及生产自动化程度等方面的影响,为残次红枣加工枣醋的可行性提供理论依据。可以看出,目前利用残次枣加工发酵食品基本上是先将残次枣干制后再加水制汁发酵或带皮渣发酵。但是干制需要消耗大量热量,同时也会加重鲜枣中营养、保健成分的破坏[7]。残次枣如果能以鲜枣形式大批量、快速加工生产枣产品,将会节约大量能源,并能减少红枣资源浪费。
杨建红等[8]以鲜红枣为原料,用植物乳杆菌与酵母协同完成酒精发酵,接种醋酸菌后摇床培养发酵制得枣醋样品,对鲜枣直接发酵果醋进行了有益尝试。但是,这些研究的鲜枣处理量非常小,仅限于实验室研究。本研究以河南新郑枣区的残次鲜枣为原料,采用半自动连续发酵生产枣醋,探讨利用残次鲜枣快速发酵生产优质枣醋的可行性,以期为残次鲜枣的快速处置和资源化利用提供依据。
1 材料与方法
1.1 材料与试剂
残次鲜枣:采自新郑市孟庄镇;
酵母菌:湖北安琪酵母股份有限公司;
醋酸菌:上海中科伍佰豪生物有限公司;
有机酸标品(苹果酸、酒石酸、柠檬酸等):天津科密欧化学试剂有限公司;
3,5-二硝基水杨酸、2,4-二硝基苯肼、葡萄糖、氢氧化钠、盐酸、浓硫酸等:分析纯。
1.2 仪器与设备
分光光度计:UV-2350型,优尼科(上海)仪器有限公司;
离心机:TGL-20M型,湖南湘仪离心机仪器有限公司;
榨汁机:ZJ145型,广东恒联食品机械有限公司;
液体发酵罐:HND-GQ-4.5型,镇江汇能达生物工程设备有限公司;
高效液相色谱仪:LC-15C型,CTO-15C 柱温箱,LC-15C泵,SIL-10AF 自动进样器,SPD-15C紫外检测器,岛津中国有限公司;
色谱柱:Wondasil C18,4.6 mm × 250 mm,5 μm,岛津中国有限公司。
1.3 检测方法
1.3.1 总可溶性固形物(TSS)、pH值、酒精、总酸以及水分含量测定 样品TSS用手持糖度计测定;pH值用pH计法;发酵液酒精度用酒精计法;总酸采用酸碱滴定法测定;水分含量按GB 5009.3—2010执行。
1.3.2 总VC以及还原糖含量测定 总VC用2,4-二硝基苯肼法,按GB/T 5009.86—2003执行;标准曲线回归方程为:y=0.025 1x+0.001 4,R2=0.995 5,样品测定与计算参照GB/T 5009.86—2003。还原糖以3,5-二硝基水杨酸比色法测定[9],以葡萄糖为标准物,标准曲线回归方程为:y=0.442 7x-0.016 3(R2=0.991 2);样品按标准曲线方法测试与计算还原糖含量。
1.3.3 有机酸含量测定 采用RP-HPLC法[10]。流动相:0.01 mol/L KH2PO4-H3PO4缓冲溶液(pH 2.8);流速:0.7 mL/min;柱温:25 ℃;检测波长:210 nm;样品处理:样品迅速离心(4 ℃,10 000 r/min,20 min)后上机分析,外标法定量。
1.4 酒精发酵工艺
1.4.1 工艺流程
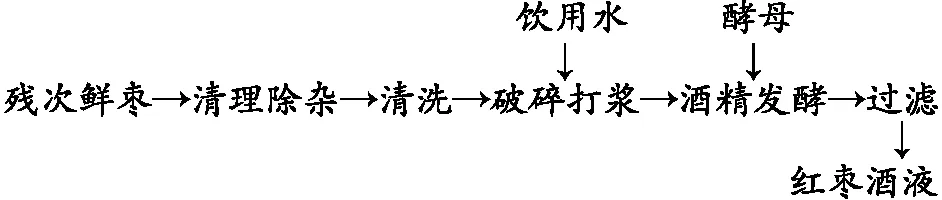
1.4.2 工艺要点 将运回实验室的残次红枣参考拐枣预处理和酒精发酵的方法进行[10]。原料用水清洗,沥干、称重,按枣重加入1.5倍的饮用水,破碎打浆,浆液连同果渣一起转入不锈钢罐中,添加0.1%的活性干酵母混匀,常温(约17 ℃)发酵,每12 h取样,分析检测发酵体系温度、发酵液TSS、酒精度、还原糖含量以及pH值。
1.5 半自动连续醋酸发酵工艺
1.5.1 工艺流程

1.5.2 工艺要点 醋酸菌按10%的比例接种,维持发酵温度34 ℃,以150 L/h通气进行醋酸发酵。每12 h取样分析发酵液酒精度和总酸度,当酸度不再升高说明第一批醋酸发酵完成。后续枣酒液的醋化采用半自动连续醋酸发酵法:取出一半枣醋后补充等体积枣酒液继续第二批次醋酸发酵(分割留种发酵),每6 h取样分析;第二批枣醋发酵完成后,再以相同方法完成下一批次,直到发酵生产完成[11]。发酵生产过程中,通过分析发酵周期、发酵液酸度变化,监测判断醋酸菌菌种的活力及传代稳定性。
1.6 统计分析

2 结果与分析
2.1 残次鲜枣的营养与利用价值
在新郑市孟庄镇红枣产区收集生长成熟开裂的鲜枣、落地枣和次等鲜枣,以优质鲜枣为对照,检测其水分、VC、还原糖以及总可溶性固形物含量,结果见表1。

表1 残次鲜枣与优质鲜枣主要营养成分对比†Table 1 Comparision of the main nutritional components between inferior jujube and high quality jujube
† 不同字母表示差异显著(P<0.05)。
红枣中的糖分含量丰富,是重要的营养和风味成分[12]。鲜枣的含水量高,容易腐烂变质,需要及时有效处理;落地枣的还原糖和VC含量显著低于优质枣和开裂枣(P<0.05),低等级鲜枣还原糖和VC含量低于优质枣,但差异不显著(P>0.05)。由表1可知,次等鲜枣、开裂鲜枣与优质鲜枣相比在主要营养成分含量上并无明显差异。残次鲜枣原料营养丰富,尤其是含糖量较高,因此发酵生产枣醋不用外加碳源及其它营养物质,开发纯天然枣醋产品极具优势。
2.2 残次鲜枣酒精发酵
残次鲜枣经前处理后接种果酒酵母进行常温发酵,酒精发酵过程中发酵液品温、TSS、酒精度、还原糖含量以及pH值变化见图1。

同一条线上不同字母表示差异显著 (P<0.05)图1 酒精发酵过程动力学变化Figure 1 Time course of alcoholic fermentation for jujube vinegar (n=3)
在初始阶段(0~12 h),由于酵母菌的不断活动,发酵体系温度开始略有升高。可以看出,即使在相对较低的常温条件下(红枣成熟季节),枣浆的酒精发酵启动很快;可能是红枣原料营养全面、酸甜适宜,非常利于果酒酵母生长繁殖。在此条件下,酵母菌快速进行有氧增殖,发酵体系可以在较短的时间内处于厌氧状态,这样有利于抑制有害杂菌的活动。酵母将红枣原料中含有的蔗糖转化为葡萄糖和果糖[13],同时还可能因为果渣中部分可溶性糖逐渐溶出,发酵初期的还原糖含量未见减少反而显著升高,同时发酵液TSS略有上升。另外,发酵体系中可以观察到开始产生大量细腻的气泡和酒帽。主发酵阶段(12~60 h),发酵液体系温度显著升高(最高为20.5 ℃);总可溶性固形物显著下降;酒精度显著升高,酒度达到7.91%Vol。最后,发酵活动逐渐减弱,发酵液体系温度恢复至室温,最终酒精含量为8.07%Vol,酒精发酵结束。
2.3 枣醋醋酸发酵
传统醋酸发酵周期往往在1个月以上,主要是醋酸发酵的启动较困难,通常比循环醋化周期更长,分割留种发酵法可以显著提高醋化效率[14-15]。本研究采用半自动连续醋酸发酵法,图2是第一轮醋酸发酵过程中酒精度、总酸含量以及pH变化。

同一条线上不同字母表示差异显著 (P<0.05)图2 第一批醋酸发酵动力学变化Figure 2 Time course of the first cycle of acetic fermentation for jujube vinegar (n=3)
醋酸发酵初期(0~12 h):经过活化、扩大培养的醋酸菌不断增殖,这一阶段发酵液酒精度小幅下降、总酸度开始升高,说明菌种生长繁殖良好。醋化阶段(12~60 h):发酵液酒精度从7.29%Vol快速下降至0.6%Vol,总酸含量从0.79 g/100 mL 显著升高至4.63 g/100 mL,pH也显著下降至最低(3.37);这是醋化产酸的主要阶段。最后,枣醋总酸度达到4.88 g/100 mL。为了保证分割留种发酵中菌种活力,第一批发酵应在60 h左右结束,补充红枣酒液进行分割留种发酵。
采用分割留种发酵方式,进行了10个批次的醋酸发酵,发酵过程中酒精度和总酸含量变化见图3,醋化过程明显缩短。0~6 h为醋酸菌的增殖阶段,为后期快速产酸做好准备。分割留种发酵初期由于菌体浓度较高,增殖过程缩短。6~30 h为快速产酸阶段,发酵液酒精被转化,伴随着总酸显著升高(P<0.05)。醋酸发酵最后,为防止过度发酵应及时补充红枣酒液。
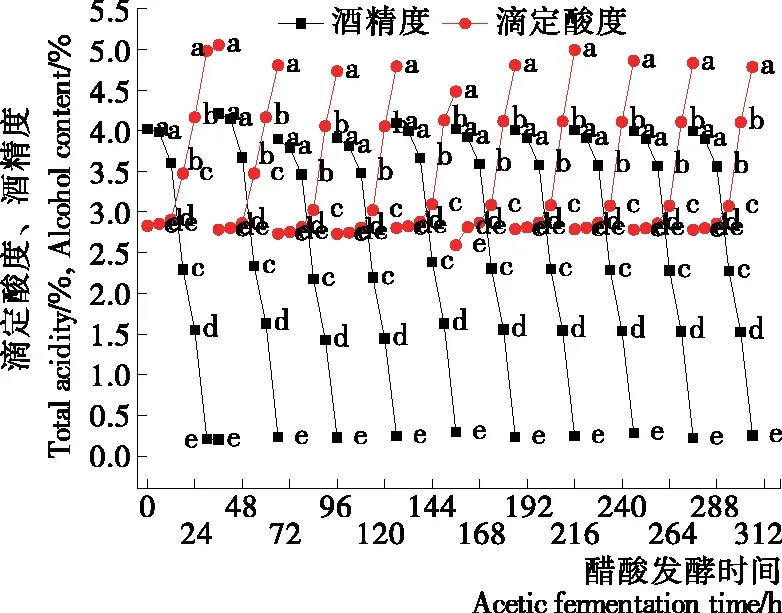
同一条线上不同字母表示差异显著(P<0.05)图3 分割留种醋酸发酵动力学变化Figure 3 Time course of the cycle of acetic fermentation for jujube vinegar (n=3)
为保证菌种良好的醋酸发酵活力,避免过度发酵,在后期的分割留种醋酸发酵中以30 h为发酵周期。可以看出,10个批次的分割留种醋酸发酵规律基本一致,各批次所得的枣醋总酸度为4.48~5.05 g/100 mL,总酸度基本相当,平均值4.81 g/100 mL,变异系数0.15%。说明采用半自动连续醋酸发酵法可以稳定、快速进行红枣醋生产。
2.4 枣醋有机酸分析
采用RP-HPLC法分析鲜枣枣醋中的主要有机酸,标准品色谱图见图4。
红枣原料含有较为丰富的有机酸,有机酸是其重要的营养和风味成分。马倩倩等[16]采用HPLC法分析枣果中的有机酸,检出了草酸、酒石酸、奎宁酸、苹果酸、柠檬酸、富马酸和抗坏血酸共7种有机酸,其中含量较高的为苹果酸、柠檬酸和酒石酸。红枣醋中共检出10种有机酸见图5,残次鲜枣果醋和优质鲜枣果醋中各种有机酸含量见表2。红枣醋醋酸含量最高,残次枣果醋为4 399.52 mg/100 mL,优质枣果醋为4 467.06 mg/100 mL。其次是乳酸,残次枣果醋为121.81 mg/100 mL,优质枣果醋为117.93 mg/100 mL。2个果醋样品中含量较高的有机酸还有苹果酸,残次枣果醋苹果酸含量为101.26 mg/100 mL,优质枣果醋为112.12 mg/100 mL;其它有机酸含量较低。

峰1.草酸 峰2.酒石酸 峰3.甲酸 峰4.苹果酸 峰5.α-酮戊二酸 峰6.抗坏血酸 峰7.乳酸 峰8.醋酸 峰9.柠檬酸 峰10.富马酸 峰11.琥珀酸
图4 11种有机酸标样色谱图
Figure 4 Chromatogram of eleven organic acids from a standard mixture

峰1.草酸 峰3.酒石酸 峰4.甲酸 峰6.苹果酸 峰7.α-酮戊二酸 峰8.乳酸 峰10.醋酸 峰11.柠檬酸 峰12.富马酸 峰13.琥珀酸
图5 红枣醋有机酸色谱图
Figure 5 Chromatogram of ten organic acids from jujube vinegar
酒精发酵过程中常常伴有苹果-乳酸发酵(MLF)或者苹果酸-酒精发酵(MEF)[17-18]。在MLF中,乳酸菌能将苹果酸转化成乳酸和CO2[19]。鲜枣枣醋中含有较高的乳酸,说明残次鲜枣在酒精发酵过程中存在有效的苹果-乳酸发酵,增加了枣醋中非挥发酸含量,对枣醋柔和而丰富厚重的酸感有积极作用。抗坏血酸是果品原料中抗氧化物质之一,在保藏以及打浆破碎、加热等过程中通常不稳定[20-21]。红枣中含量较高的抗坏血酸在2个红枣醋样中均未检出。尽管红枣中VC含量丰富,原料经过破碎、发酵等不同过程处理后还原型VC已逐渐氧化甚至降解消失。赵松等[22]以枣渣和大米为原料酿制枣醋,研究了不同发酵方法对枣醋有机酸的影响,共检出醋酸、乳酸、苹果酸、柠檬酸、琥珀酸等8种有机酸,主要有机酸组成和含量与本研究结果基本一致。
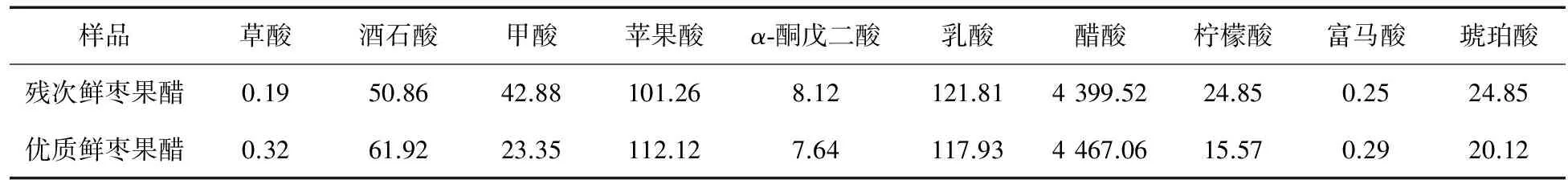
表2 红枣醋有机酸含量Table 2 Contents of organic acids in the jujube vinegar mg/100 mL
3 结论
相比优质红枣,残次鲜枣的商品价值和利用程度低。但其营养成分可媲美优质鲜枣,是一种可发酵利用的农业废弃资源。残次鲜枣加1.5倍水破碎打浆,直接接种0.1%的果酒干酵母于采收季节常温发酵72 h可得酒度为8.07%Vol的红枣酒液。枣酒液接种10%的活化醋酸菌菌种,经过60 h可完成第一批醋酸发酵,枣醋酸度可达4.88 g/100 mL;进行10批次半自动连续醋酸发酵,发酵周期为30 h,制得红枣醋平均酸度为4.81 g/100 mL;残次鲜枣各批次醋酸发酵过程稳定,最终产品酸度稳定。
利用残次鲜枣发酵生产的果醋中共检出10种有机酸,主要为醋酸、乳酸和苹果酸;其有机酸组成、含量与优质鲜枣果醋无明显差异。以残次鲜枣为原料通过半自动连续醋酸发酵法能高效生产红枣醋,品质与优质鲜枣果醋相当,表明该方法可用于枣产区转化残次鲜枣资源生产鲜枣果醋。
[1] 闫忠心, 鲁周明, 刘坤, 等.我国红枣资源加工利用研究现状与展望[J].西北农林科技大学学报: 自然科学版, 2010, 38(6): 102-108.
[2] 李鸿德, 任宪中.红枣裂果病的发生及预防[J].西北园艺, 2007(6): 23.
[3] GAO Han, LIU Ben-guo, FU Shu-fang.Research on domestication process of lactic acid bacteria for jujube beverage by response surface[J].Methodology Advanced Materials Rese-arch, 2011, 271-273: 569-572.
[4] CHUN M S, KIM S J, NOH B S.Analysis of free amino acids and flavors in fermented jujube wine by HPLC and GC/MS[J].Korean Journal of Food Science and Technology, 2012, 44(6): 779-784.
[5] 李艺伟, 张宝善, 董婷婷, 等.利用残次红枣生产风味型酵母味素的工艺研究[J].西北农林科技大学学报: 自然科学版, 2015, 43(4): 163-169.
[6] 张宝善, 陈锦屏, 李冬梅, 等.利用次等红枣生产果醋的工艺研究[J].农业工程学报, 2004, 20(2): 213-215.
[7] GUO Sheng, DUAN Jin-ao, ZHANG Ying, et al.Contents changes of triterpenic acids, nucleosides, nucleobases, and saccharides in jujube (Ziziphus jujuba) fruit during the drying and steaming process[J].Molecules, 2015, 20(12): 22 329-22 340.
[8] 杨建红, 张惠玲, 张卫峰.多菌混合发酵鲜枣果醋的工艺研究[J].中国酿造, 2015, 34(8): 155-158.
[9] MILLER G L.Use of dinitrosalicylic acid reagent for the determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3): 426-428.
[10] XIANG Jin-le, ZHU Wen-xue, HAN Jun-qi, et al.Analysis of organic acids in Chinese raisin tree (Hovenia dulcis) peduncle and their changes in liquid fermentation process[J].Food Science and Biotechnology, 2012, 21(4): 1 119-1 127.
[11] 向进乐, 杜琳, 李欣, 等.拐枣醋半固态-液态发酵工艺研究[J].现代食品科技, 2014, 30(7): 160-164.
[12] 孙涛, 赵子刚, 刘圣红, 等.高效液相色谱法测定鲜枣中糖的组成[J].分析仪器, 2015(1): 38-41.
[13] JAYABALAN R, MARIMUTHU S, SWAMINATHAN K.Changes in content of organic acids and tea polyphenols during kombucha tea fermentation[J].Food Chemistry, 2007, 102(1): 392-398.
[14] TESFAYE W, MORALES M, GARCIA-PARRILLA M, et al.Optimising wine vinegar production: fermentation and ageing[J].Applied Biotechnology, Food Science and Policy, 2003, 1(2): 1-6.
[15] KAUR P, KOCHER G, PHUTELA R.Production of tea vinegar by batch and semicontinuous fermentation[J].Journal of Food Science and Technology, 2011, 48(6): 755-758.
[16] 马倩倩, 吴翠云, 蒲小秋, 等.高效液相色谱法同时测定枣果实中的有机酸和VC含量[J].食品科学, 2016, 37(14): 149-153.
[17] VERSAARI A, PARPINELLO G, CATTANEO M.Leuconostocoenosand malolactic fermentation in wine: a review[J].Journal of Industrial Microbiology & Biotechnology, 1999, 23(6): 447-455.
[18] VOLSCHENK H, VUUREN H, VILJOEN-BLOOM M.Malic acid in wine: Origin, function and metabolism during vinification[J].South African Journal for Enology & Viticulture, 2006, 27(2): 123-135.
[19] REDZEPOVIC S, ORLIC S, MAJDAK A, et al.Differential malic acid degradation by selected strains of Saccharomyces during alcoholic fermentation[J].International Journal of Food Microbiology, 2003, 83(1): 49-61.
[20] BHATTACHERJEE A, TANDON D, DIKSHIT A, et al.Effect of pasteurization temperature on quality of aonla juice during storage[J].Journal of Food Science and Technology, 2011, 48(3): 269-273.
[21] PAREEK S, PALIWAL R, MUKHERJEE S.Effect of juice extraction methods and processing temperature-time on juice quality of Nagpur mandarin (Citrus reticulata Blanco) during storage[J].Journal of Food Science and Technology, 2010, 48(2): 197-203.
[22] 赵松, 王颉, 刘亚琼.不同发酵方法对枣醋主要有机酸含量的影响[J].中国食品学报, 2014, 14(3): 135-139.
