氧载体对绿色产色链霉菌发酵生产阿维拉霉素的影响
2018-05-03梅ZHANGMei
章 梅ZHANG Mei
宋元达1,2
刘 青1,2
王友玲1,2
吴 翰1,2
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255000;2.山东省高校农产品功能化技术重点实验室,山东 淄博 255000)
阿维拉霉素又名肥拉霉素,是一种正糖霉素族的寡糖类抗生素,具有调节动物肠内细菌代谢[1-2]和促进动物生长的作用[3]。阿维拉霉素对革兰氏阳性菌具有较好的抑制效果,对大肠杆菌有着间接的影响,能有效地减小动物的感染率[4],还可以促进动物生长、提高饲料回报率同时具有低残留和低毒性、无交叉耐药性等优点,已经作为一种饲料添加剂用于猪和肉鸡的养殖[5-6]。
阿维拉霉素的生产是好氧发酵过程,发酵液中溶氧水平的高低与细胞内酶的活性有着直接的关系,决定了何种代谢途径生成 ATP、还原力及各种代谢物[7];对细胞的生长和细胞内阿维拉霉素的合成有重大影响。为了满足发酵过程中氧的要求,常用搅拌转速和增大通气量等方法来提高发酵液中溶氧水平,但过大的剪切力会引起菌丝损伤,造成菌丝断裂、泡沫增多和变大以及发酵不易控制等[8]。也有学者利用转基因技术将透明颤菌血红蛋白的基因克隆到目的菌株,降低菌株对氧的敏感度,使菌株适应发酵液中较低的溶氧水平,提高对氧的利用[9];向发酵液中加入过氧化氢等[10]分子氧底物。以上2种方法存在基因的表达不稳定或丢失[11]和本身有着较大毒性等[12]问题。通过添加氧载体来改善发酵液的溶氧水平,也能提高发酵产量[13]。
氧载体是一种对细胞没有毒性,具有比水更高的溶氧能力的有机化合物[14]。在发酵液中添加正己烷、煤油和表面活性剂等氧载体,引入新的液相,减小气液之间的传氧阻力,提高Kla(传氧系数)值,在同一发酵系统中能提高30%~300%,或达到同样混合效果时降低搅拌功率 30% 以上[15]。目前国内外尚未发现有氧载体用于发酵生产阿维拉霉素的研究。本试验拟研究各种氧载体对绿色产色链霉菌产阿维拉霉素的影响,进一步观察其发酵参数,对氧载体的效果进行评价和筛选,并考察添加时间和浓度对生物量及阿维拉霉素合成的影响,以期为氧载体在阿维拉霉素工业化生产的应用提供理论依据。
1 材料与方法
1.1 材料
绿色产色链霉菌(S.viridochromogene LY013):浙江凌云药业有限公司。
1.2 主要仪器和试剂
1.2.1 主要试剂
Avilamycin标准品:80%,美国历来公司;
吐温20、吐温80:分析纯,上海沪试剂厂;
正己烷:分析纯,上海沃凯生物技术有限公司。
1.2.2 主要仪器
超净工作台:ZHJH-C1115C型,上海智城分析仪器制造有限公司;
隔水式恒温培养箱:GRP-9160型,上海森信仪器有限公司;
液相色谱仪:waters600e型,沃特世科技(上海)有限公司。
1.3 培养基与培养方法
1.3.1 培养基
斜面培养基:可溶性淀粉20.0 g/L、MgSO4·7H2O 0.5 g/L、KNO31.0 g/L、FeSO4·7H2O 0.5 g/L、NaCl 0.5 g/L、琼脂 20.0 g/L,pH 7.2~7.4;
种子培养基:豆饼粉 32 g/L、甘露醇 22 g/L、蛋白胨 5 g/L、葡萄糖 10 g/L、NaCl 5 g/L、(NH4)2SO4、6.4 g/L、MgSO40.05 g/L,pH 7.2~7.4;
发酵培养基:甘露醇 25 g/L、豆饼粉 34 g/L、可溶性淀粉 6.4 g/L、(NH4)2SO42.5 g/L、葡萄糖 2 g/L、MgSO40.05 g/L、CaCO35 g/L,pH 7.2~7.4。
1.3.2 培养方法
液体种子培养:挑选斜面培养基中长势较好的绿色产色链霉菌的孢子,接种于装有50 mL种子培养基的250 mL 三角瓶内。在28 ℃的摇床里以 200 r/min 振荡培养 24 h;
液体发酵培养:以 6%的接种量,将已培养种子培养液接入到装有50 mL 发酵培养基的250 mL三角瓶中,在28 ℃ 条件下200 r/min 振荡培养72 h。
1.4 分析方法
1.4.1 样品处理 取5.0 mL发酵液于离心管中,4 000 r/min离心10 min,弃上清液,加入9.0 mL无水甲醇,用振荡器充分振荡后,浸提30 min,用滤膜过滤,经无水甲醇稀释的上清液即为待测液。
1.4.2 菌体生物量的测定 在发酵48 h后,吸取发酵液10 mL,4 000 r/min离心10 min,倒出上清液,沉淀物烘干至恒重的质量即为菌体生物量。
1.4.3 还原糖的测定 采用DNS法[16]。
1.4.4 阿维拉霉素的测定 取1 mL的发酵液移至装有3 mL 甲醇的5 mL的离心管中,旋涡震荡3 min,超声10 min 后经0.22 μm过滤膜过滤,摇匀,备用。
采用高效液相色谱分析(HPLC)法。色谱条件:流动相为乙腈∶0.2%磷酸二氢铵=51∶49(体积比);流速1 mL/min;色谱柱Agilent C18,4.6 mm×250 mm;检测波长214 nm,柱温35 ℃,进样量20.0 μL。
1.4.5 得率系数的计算 按式(1)计算得率系数。
(1)
式中:
R——得率系数,mg/g;
M——阿维拉霉素,mg/L;
DCW——生物量,g/L。
2 结果与分析
2.1 氧载体对阿维拉霉素的影响
选择7种常用氧载体以2 g/L的添加量进行绿色产色链霉菌发酵试验,结果见图1。由图1可知,添加氧载体均可以提高阿维拉霉素的产量。其中吐温20、吐温80、正己烷的效果明显;其余的氧载体也有一定的促进作用,但与前3组比较,效果不显著。与对照组相比,正己烷提高了21 mg/L,吐温 20提高了26 mg/L,吐温80的促进效果最好,增加了40 mg/L。显然吐温对阿维拉霉素的合成具有较好的促进效果,从促进效果和经济性角度综合考虑,选择正己烷、吐温20和吐温80作为研究对象,进一步研究其对阿维拉霉素产量的促进作用。

图1 氧载体对阿维拉霉素产量的影响Figure 1 Effect of different oxygen-vectors on the yield of avilamycin
2.2 氧载体添加量对发酵的影响
2.2.1 吐温20、吐温80和正己烷添加量对阿维拉霉素产量的影响 由图2可知,添加量低于3 g/L时,随着氧载体添加量的增加,阿维拉霉素产量也随着增加。添加量为3 g/L时,阿维拉霉素产量均达到最高。吐温80的提升效果要优于吐温20与正己烷的。当添加量超过3 g/L时,阿维拉霉素产量均有所减小,说明过高浓度的氧载体对菌生产阿维拉霉素不利,可能是氧的浓度对抗生素的产量影响降低。其中添加量为3~4 g/L时正己烷组产量下降较快,可能是高浓度的正己烷影响了阿维拉霉素相关酶系导致产量下降[17]。高浓度的氧载体能提高Kla系数[18],提高发酵液的溶氧水平,促进阿维拉霉素产量的提高,但是过高浓度氧载体却不利于绿色产色链霉菌的发酵,使得发酵液中阿维拉霉素含量降低。
2.2.2 吐温20、吐温80和正己烷添加量对生物量的影响
图3显示,在添加量为3 g/L时菌体量达到最大值,添加正己烷、吐温80和吐温20的发酵液生物量与对照组生物量(9.80 g/L)相比,分别提高了15.58%,20.63%,16.58%。与正己烷组相比,吐温80对生物量促进的效果更为明显。
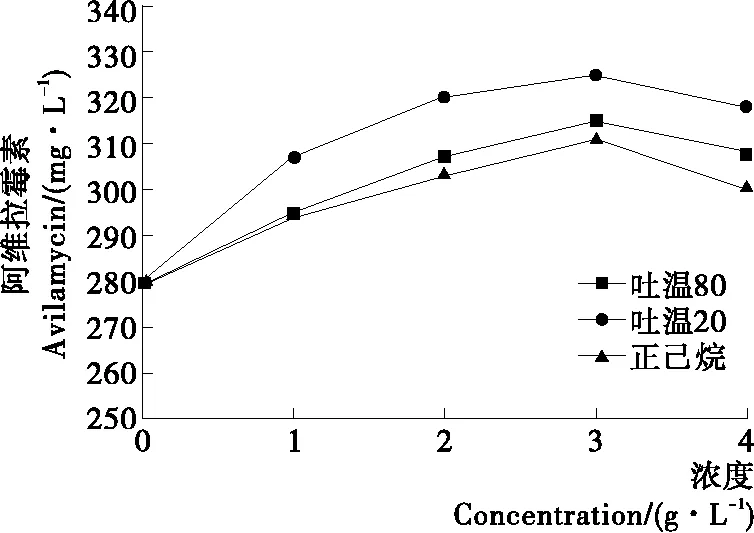
图2 正己烷、吐温20和吐温80添加量对阿维拉霉素产量的影响Figure 2 Effect of different n-hexane, Tween-20 and Tween-80 concentration on the yield of avilamycin

图3 正己烷、吐温20和吐温80添加量对生物量的影响Figure 3 Effect of different n-hexane, Tween-20 and Tween-80 concentration on dry weight of cells
这可能是吐温80本身就可以作为营养源,供给微生物生长,而且吐温可以增大细胞的通透性,使细胞的新陈代谢较为容易[19],从而促进了细胞的生长,提高了生物量。同时发现添加量超过3 g/L时,正己烷、吐温20和吐温80组的生物量都有所降低。其中正己烷组的生物量下降速度较快,可能是由于高浓度烷烃类氧载体对菌体的伤害较强,使得菌丝体在发酵后期快速降解[20],与冯杰等[21]研究结果相符。说明氧载体的浓度过高不利于菌体量的增长,同时会干扰微生物的发酵,抑制菌体合成次生代谢产物的能力,造成单位菌体产阿维拉霉素能力下降。
2.2.3 吐温20、吐温80和正己烷添加量对得率系数的影响
由图4可知,添加不同氧载体的发酵液中得率系数的趋势大致相同,添加0~2 g/L时随着氧载体浓度的提高,正己烷、吐温20和吐温80组的菌体得率系数逐渐增大,说明低浓度氧载体均有利于单位细胞产阿维拉霉素的能力提高。比较图2~4的数据可知,添加量为2~3 g/L时,添加氧载体能促进阿维拉霉素的产量和生物量的提高,与颜日明等[22]的研究结果相同,但阿维拉霉素的得率系数基本维持不变甚至有所降低,说明产量的增加与生物量的提高有很大关系,不仅仅是单位细胞产率增大的结果。添加量超过3 g/L 时,3种氧载体的得率系数、生物量和产量都没有提高,甚至有所降低。这可能是菌体在生长阶段和代谢阶段受到的限制主要因素不仅仅是氧浓度,还受到发酵本身的碳源和氮源限制。

图4 正己烷、吐温20和吐温80添加量对得率系数的影响Figure 4 Effect of n-hexane, Tween-20 and Tween-80 concentration on dry weight of cells and the yield of avilamycin
2.3 吐温20、吐温80和正己烷添加时间对阿维拉霉素产量的影响
在上述试验的基础上,以3 g/L的添加量进一步研究氧载体在发酵过程中的添加时间对阿维拉霉素产量的影响,结果见图5。由图5可知,发酵后24 h内添加氧载体比发酵开始时添加能显著提高阿维拉霉素产量;前8 h,随着添加时间的推迟,阿维拉霉素的产量整体呈上升趋势,提示氧载体最适的添加时间为链霉菌的对数生长期,可能是菌体在对数生长期对氧的要求较高,添加氧载体解除溶氧极限,有利于菌体的生长;而在发酵后期(24 h后)添加氧载体,随着添加时间推迟,阿维拉霉素的产量低于发酵初始添加,这是因为进入生长稳定期,氧载体的添加对菌体量的促进效果减低。另外吐温组的产量超过了正己烷组,可能是氧载体吐温80对生物量有明显提升效果,与王爽等[19]的研究结果一致。但是抗生素是次级代谢产物,其产量的高低受多种因素影响,菌体量只是其中的一个方面;液态烷烃在发酵液中可以起到分散剂的作用,使细胞间的絮凝性降低,较大的菌丝团在剪切力的作用下会分散成数个小菌丝团。与大菌丝团相比,分散的较小菌丝团界面面积会有所增加,从而加快了氧传递到菌丝体内的总速度。但是烷烃较高的毒性会抑制菌体产抗生素的能力,降低阿维霉素的产量。
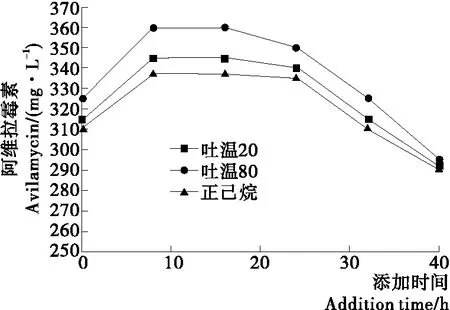
图5 正己烷、吐温20和吐温80添加时间对阿维拉霉素产量的影响Figure 5 Effect of n-hexane, Tween-20 and Tween-80 concentration addition time on and avilamycin production
2.4 吐温80对阿维拉霉素发酵过程的影响
以吐温80为氧载体,添加时间为8 h、添加量为3 g/L进行发酵试验,其发酵过程中绿色产色链霉菌的生物量、产量、培养基pH值、残糖含量的变化趋势见图6。由图6可知,添加氧载体能加快菌体的生长,提高生物量,并提高了单位菌体产阿维拉霉素的能力,两者共同作用促使阿维拉霉素产量显著提高。在0~16 h菌体的对数生长期,发酵液中阿维拉霉素的含量较低,pH值和还原糖的含量都急剧下降;在16 h后,生物量逐渐保持稳定,菌体进入稳定期,并保持不变,而阿维拉霉素的含量呈指数上升,并在40 h达到最大值,这种发酵类型属于非生长偶联型发酵;同时发酵液中pH值由发酵早期的逐渐减小转变为逐渐增大,还原糖的消耗速率也有着明显的降低,可能与菌体在发酵过程中产生的有机酸有关[20]。葡萄糖经EMP途径等生成的有机酸被部分排出细胞外,使得发酵液的有机酸含量增高,pH值下降,但在阿维拉霉素生产期,由于发酵液中碳源量的降低,有机酸被菌体重新利用[23-25],pH值逐渐上升;同时菌体进入次生代谢期,生物量不再增加,还原糖的消耗速率也逐渐减小,阿维拉霉素含量也急剧上升[26]。因此在8 h发酵的对数生长期添加吐温80解除溶氧限制,能提高生物量和阿维拉霉素的产量[27-28]。

图6 发酵过程中pH、还原糖、生物量、阿维拉霉素的曲线图Figure 6 The curve of pH, deoxidize sugar, Biomass, avilamycin during fermentation
3 结论
本研究将7种氧载体添加到绿色产色链霉菌的发酵过程中,结果显示添加的氧载体均可以提高其阿维拉霉素的产量,其中吐温20、正己烷和吐温80效果最好。在此基础上考察这3种氧载体对绿色产色链霉菌合成阿维拉霉素的影响,发现3种氧载体均可以提高生物量,同时能提高绿色产色链霉菌的得率系数,从而提高绿色产色链霉菌产阿维拉霉素的能力,其中吐温80作为氧载体的效果最好。另外,还研究了氧载体添加时间对阿维拉霉素产量的影响,在发酵开始的第 8天添加 3 g/L 的吐温80与对照组相比,生物量提高了20.63%,得率系数增加到3.12%。
本试验证明了氧载体能强化氧传递速率,提高菌体的生物量和得率系数,促进代谢产物的合成。下一步将研究各种氧载体的协同作用对阿维拉霉素产量提高的影响以及对菌体糖代谢的关键酶活性的影响,进一步发掘氧载体的促进机制。
[1] SCHABERG D R, CULVER D H, GAYNES R P.Major trends in the microbial etiology of nosocomial infection[J].American Journal of Medicine, 1991, 91(3B): 72S.
[2] SWARTZ M N.Hospital-acquired infections: diseases with increasingly limited therapies[J].Proc Natl Acad Sci USA, 1994, 91(7): 2 420-2 427.
[3] HERNANDEZ F, MADRID J, GARCIA V, et al.Influence of two plant extracts on broilers performance, digestibility, and digestive organ size[J].Poult Sci, 2004, 83(2): 169-174.
[4] PARADIS M A, MCMILLAN E, BAGG R, et al.Efficacy of avilamycin for the prevention of necrotic enteritis caused by a pathogenic strain of Clostridium perfringens in broiler chickens[J].Avian Pathology, 2016, 45(3): 365-369.
[5] AARESTRUP F M, BAGER F, ANDERSEN J S.Association between the use of avilamycin for growth promotion and the occurrence of resistance among Enterococcus faecium from broilers: epidemiological study and changes over time[J].Microbial Drug Resistance, 2000, 6(1): 71-75.
[6] 王东卫, 王瑛.饲用抗生素在雏鸡生产中应用效果的比较[J].饲料工业, 2011, 32(24): 62-64.
[7] 张克旭, 陈宁, 张蓓.代谢控制发酵[M].北京: 中国轻工业出版社, 1998: 25-50.
[8] YE Rui-fang, WANG Qian, ZHOU Xiao-fang.Lincomycin, rational selection of high producing strain and improved fermentation by amino acids supplementation[J].Bioprocess and Biosystems Engineering, 2009, 32(4): 521-529.
[9] 吴益民, 王洪军, 孙艳, 等.透明颤菌血红蛋白基因在红色糖多孢菌株中表达及对红霉素产量的影响[J].中国抗生素杂志, 2007, 32(10): 599-601.
[10] 翁雪清, 施巧琴, 吴松刚.氧载体、表面活性剂及H2O2对L-phe发酵影响的研究[J].氨基酸和生物资源, 2012, 34(2): 39-42.
[11] 文莹, 宋渊, 李季伦.透明颤菌血红蛋白在肉桂地链霉菌中的表达对其细胞生长及抗生素合成的影响[J].生物工程学报, 2001, 17(1): 24-28.
[12] 李书良, 焦鹏, 曹竹安.流加H2O2对提高供氧及微生物代谢的影响[J].微生物学报, 2002, 42(1): 129-132.
[13] 崔培梧, 胡亚强, 钟瑜萍, 等.氧载体对茯苓菌液态深层发酵的影响[J].中药材, 2015, 38(6): 1 157-1 160.
[14] NARTA U, ROY S, KANWAR S S, et al.Improved production ofL-asparaginase by Bacillus brevis cultivated in the presence of oxygen-vectors[J].Bioresource Technology, 2011, 102(2): 2 083-2 085.
[15] WANG Jiang-long.Enhancement of citric acid production by As pergillusni gerusing n-dodecane as an oxygen-vector[J].Process Biochemistry, 2000, 35(10): 1 079-1 083.
[16] 赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008, 29(8): 534-536.
[17] XU Fang, YUAN Qi-peng, ZHU Yan.Improved production of lycopene and b-carotene by Blakeslea trispora with oxygen-vectors[J].Process Biochemistry, 2006, 42(2): 289-293.
[18] 王英燕, 张芙蓉, 田智斌.氧载体对番茄红素发酵影响[J].药学研究, 2014, 33(4): 196-199.
[19] 王爽, 周魏, 刘红冉, 等.几种氧载体对纳他霉素发酵的影响[J].食品科学, 2015, 40(6): 102-107.
[20] 彭超, 黄和, 刘欣, 等.添加正十六烷对高山被孢霉发酵生产花生四烯酸的影响[J].食品科技, 2010(5): 2-5.
[21] 冯杰, 冯娜, 唐庆九, 等.氧载体正十二烷对灵芝三萜液态深层发酵的影响[J].食用菌学报, 2016, 23(2): 52-58.
[22] 颜日明, 艾佐佐, 汪涯, 等.双液相体系强化氧传递促进微生物油脂生产[J].生物工程学报, 2013, 29(4): 536-539.
[23] 王衡伟, 陈长华, 付水林, 等.腺苷发酵液中有机酸的代谢规律[J].华东理工大学学报: 自然科学版, 2004, 30(2): 223-226.
[24] 谌颉, 储炬, 庄英萍, 等.阿维菌素发酵过程有机酸积累规律与生物合成的关[J].华东理工大学学报: 自然科学版, 2005, 31(6): 731-734.
[25] LOPES D S T, REIS A.The use of multi-parameter flow cytometry to study the impact of n-dodecane additions to marine dinoflagellate microalga Crypthecodinium cohnii batch fermentations and DHA production[J].Journal of Industrial Microbiology & Biotechnology, 2008, 35(8): 875-887.
[26] 李娜娜, 吴晓英, 吴振强.液态烷烃氧载体对粘红酵母发酵产番茄红素的影响[J].生物技术通报, 2015, 31(2): 196-201.
[27] 刘芳, 李晓荣, 邹祥.阿维拉霉素生物合成与代谢调控研究进展[J].生物技术通报, 2010(12): 25-30.
[28] SEIFU D G, ISIMJAN T T, MEQUANINT K.Tissue engineering scaffolds containing embedded fluorinated-zeolite oxygen vectors[J].Acta Biomaterialia, 2011, 7(10): 3 670-3 678.
