龙须菜挥发油的提取及抗菌抗虫活性研究
2018-05-03王国蕊
王国蕊
逄锦龙2
张德蒙2
李 昉1,2
(1.青岛科技大学海洋科学与生物工程学院,山东 青岛 266000;2.青岛明月海藻集团有限公司海藻活性物质国家重点实验室,山东 青岛 266400)
龙须菜(Gracilarialemaneiformis)隶属于红藻门杉藻目江蓠属,多生长于潮间带至潮下带的半埋于覆盖有沙的岩石上[1]。目前已从龙须菜中分离出多种化合物[2-3],具有调节免疫、抗肿瘤[4-5]、抗病毒、抗突变[6]、抗凝血、抗氧化[5]、抗菌等多种生理活性及药用功能[7]。但对龙须菜挥发油的成分以及抗菌活性研究还相对较少,对龙须菜挥发油的抗卤虫活性也未见报道。
值得关注的是潮间带海藻的挥发和半挥发性成分具有很好的抗菌和抗氧化等活性,可用于开发药品或者保健品[8]。同时,同种植物的挥发油用不同的方法提取在成分以及活性方面有较大差异[9]。因此本研究以龙须菜为对象,利用气相色谱-质谱分析方法对比不同提取方法得到的挥发油成分,分析挥发油主体成分,并研究比较2种挥发油对几种常见致病菌抗菌作用以及对卤虫杀虫活性的差异,旨在探索龙须菜挥发油的最佳提取方法,并为扩展大型红藻龙须菜的应用范围提供一定理论依据。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
龙须菜:于2016年5月采于山东威海养殖场;
大肠杆菌O157(EscherichiacoliO157)、金黄色葡萄球菌(Staphylococcusaureus)、沙门氏菌(Salmonellaenterica)、单增李斯特菌(Listeriamonocytogenes)、副溶血性弧菌(Vibrioparahemolyticus):中国水产科学研究院黄海水产研究所;
LB培养基:蛋白胨10 g,酵母浸膏5 g,氯化钠10 g,琼脂20 g,去离子水1 000 mL,pH 7.2~7.4;
其他试剂均为分析纯。
1.1.2 主要仪器设备
气相质谱联用仪:GCMS-QP2010型,日本岛津公司;
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂;
循环水式多用真空泵:SHZ-95B型,巩义市予华仪器有限责任公司;
冷冻干燥机:FD-1A-80型,上海比朗仪器制造有限公司;
立式压力蒸汽灭菌器:BXM-30R型,上海博迅实业有限公司医疗设备厂。
1.2 试验方法
1.2.1 直接水蒸气蒸馏法 将1 kg新鲜龙须菜冷冻干燥,粉碎,对龙须菜粉末直接进行水蒸气蒸馏得龙须菜挥发油(D-GLS),用重蒸二氯甲烷萃取,密封待测。
1.2.2 溶剂提取-水蒸气蒸馏法 将1 kg新鲜龙须菜晾干至恒重,粉碎,浸泡于等体积重蒸甲醇中,提取3次,超声辅助、浸提均为24 h,将浸提液于减压旋转蒸发器中蒸干,得龙须菜粗提物浸膏。最后对粗提物浸膏进行水蒸气蒸馏得到龙须菜挥发油(S-GLS),用重蒸二氯甲烷萃取,密封待测。
1.2.3 GC-MS分析条件
(1) 气相色谱条件:柱箱温度50 ℃,进样口温度250 ℃,进样量1 μL,不分流,进样时间1 min;载气He,压力100 kPa,总流量50 mL/min,柱流量1.69 mL/min;柱温从50 ℃开始,维持0 min,以5 ℃/min升温到220 ℃,维持5 min,再以5 ℃/min升温到300 ℃,维持0 min。
(2) 质谱条件:EI离子源,电离源(70 eV),离子源温度200 ℃,接口温度300 ℃,溶剂延迟时间3 min,质量数扫描范围为35~500m/z。
1.2.4 化合物结构与含量分析 利用仪器自带谱库进行检索,确定化合物结构,只报道相似度>80%的物质,采用色谱峰面积归一化法确定各组分相对含量,用百分比表示。
1.2.5 抗菌试验 将D-GLS挥发油和S-GLS挥发油分别用色谱甲醇溶解,浓度均为10 mg/mL,阳性对照为4 mg/mL阿莫西林的二甲基亚砜(DMSO)溶液。各取样品5 μL到滤纸片(直径6 mm),晾干,贴到涂菌的LB固体平板上,置于37 ℃培养24 h,观察抑菌圈大小。按式(1)计算抑菌率。
(1)
式中:
c——抑菌率,%;
d0——滤纸片直径,mm;
d1——供试样品抑菌圈直径,mm;
d2——阳性对照,mm。
1.2.6 抗卤虫活性试验 参照李昉等[10]的方法,取190 μL卤虫幼虫悬浮液,加入到96孔板中,每孔卤虫控制在16条左右。用DMSO将两种挥发油配制成梯度溶液,每孔加入样品10 μL,使其最终浓度分别为0.06,0.08,0.10,0.12,0.14,0.16,0.18,0.20 mg/mL,并设置海水和DMSO对照,每个样品做6个平行。在25 ℃下培养24 h,记录卤虫死亡个数,计算死亡率和半致死浓度LD50。
2 结果与分析
2.1 不同提取方法的龙须菜挥发性成分
根据水蒸气蒸馏法得到的D-GLS挥发油,经GC-MS分析后得龙须菜挥发油总离子流色谱图(图1),该方法得到的挥发油组分在3.085 min开始出峰并且在25~35 min集中出峰,由表1可知,共得到68种成分,包括烷烃20种、烯烃6种、醛类9种、醇类12种、酮类3种、羧酸及酯15种和其它化合物3种。其中相对含量>5%的化合物依次有:2-辛烯醛(22.29%)、二十烷(18.84%)、4-亚乙烯基环己烯(7.81%)和1-辛烯-3-醇(6.91%)。而采用溶剂提取-水蒸气蒸馏法得到的S-GLS挥发油,经GC-MS分析后得龙须菜挥发油总离子流色谱图(图2),该方法得到的挥发油组分出峰时间集中在20~35 min,由表2可知,共得到56种成分,包括烷烃20种、醛类1种、醇类6种、酮类2种、羧酸及酯17种和其它化合物10种。其中相对含量>5%的化合物有:二十烷(37.41%)和棕榈酸甲酯(6.89%)。由图3可知,S-GLS挥发油相对于D-GLS挥发油,其醛类成分由24.69%下降至0.2%,羧酸及酯类成分由9.02%提高至21.54%,在一定程度上说明,直接水蒸气蒸馏挥发油成分可能会导致羧酸氧化,醛类成分增加。总体来看,烃类和羰基类化合物是龙须菜挥发油的主体成分。

图1 直接水蒸气蒸馏法所得龙须菜挥发油成分GC-MS谱图Figure 1 TIC chromatograms of volatile oil compounds in G.Lemaneiformis with direct steam distillation
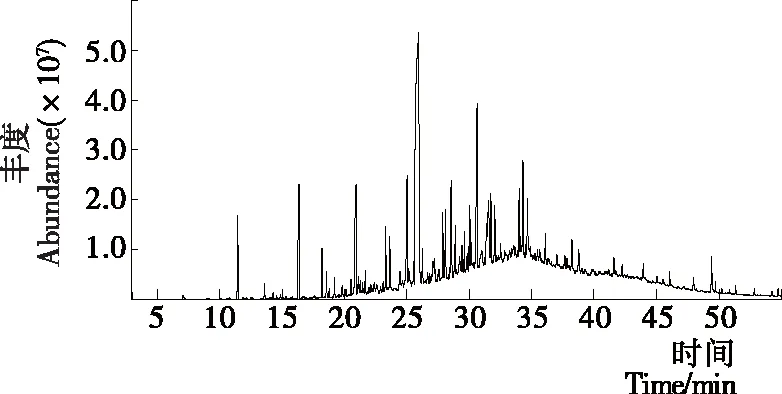
图2 溶剂提取-水蒸气蒸馏法所得龙须菜挥发油成分GC-MS谱图Figure 2 TIC chromatograms of volatile oil compounds in G.Lemaneiformis with solvent extraction-steam distillation
2.2 对龙须菜挥发油主体成分解析
2.2.1 烃类化合物 由图3可知,烃类化合物是龙须菜挥发油的最主要成分,嗅觉阈值多数较高,对挥发油的气味贡献不大。直接水蒸气蒸馏法和溶剂提取-水蒸气蒸馏法提取的挥发油中烷烃含量分别为38.98%和60.01%,另外直接水蒸气蒸馏法提取的挥发油中还有10.41%的烯烃,其中角鲨烯是一种直链三萜化合物,具有类似红细胞摄氧功能,可生成活化的氧化角鲨烯,促进新陈代谢,提高机体免疫力,因而常作为功效成分添加于保健食品中[11]。2种方法提取的挥发油中饱和烷烃均是其主要物质,而徐年军等[12]所得龙须菜挥发油的结果是以烯烃(61.67%)为主要成分,可能与龙须菜的生长季节、龙须菜挥发性物质的提取方法和检测条件有关。
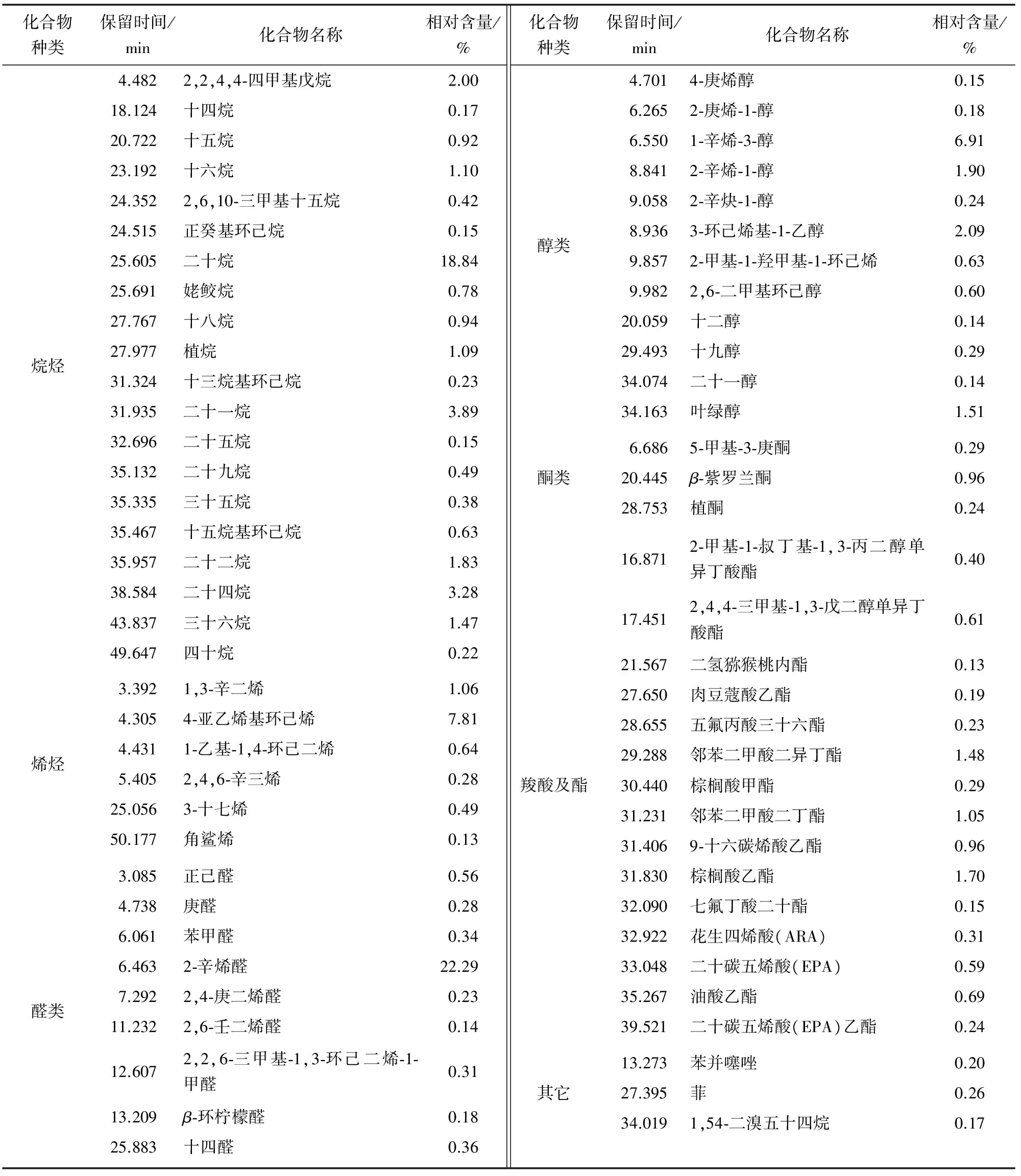
表1 直接水蒸气蒸馏法所得龙须菜挥发油成分Table 1 Volatile oil compounds in G.Lemaneiformis with direct steam distillation

表2 溶剂提取-水蒸气蒸馏法所得龙须菜挥发油成分Table 2 Volatile oil compounds in G.Lemaneiformis with solvent extraction-steam distillation

图3 2种提取方法所得龙须菜挥发油组成与含量Figure 3 The volatile oil composition and content from two extraction methods in G.Lemaneiformis
2.2.2 醛类化合物 醛类化合物主要是脂肪氧化的产物[13],具有较低的嗅觉阈值,是挥发油气味的主要来源。由表1和图3可知,直接水蒸气蒸馏法醛类含量为24.69%。其中2-辛烯醛含量最高(为22.29%),其嗅觉阈值非常低(3 μg/kg),具有脂肪和黄瓜味[14],是气味的主要贡献者。还检测出2,6-壬二烯醛、2,4-庚二烯醛、正己醛、庚醛和十四醛,通常会呈现出辛辣和令人不愉快的腥味、脂肪味、草味等刺激性味道[15]。而溶剂提取-水蒸气蒸馏法只检测到0.2%的2-甲基-5-异丙烯基环戊-1-烯甲醛,大大降低了挥发油的不良气味。
2.2.3 醇类化合物 醇类化合物相比于醛类一般嗅觉阈值较高。由表1和图3可知,直接水蒸气蒸馏法挥发油中醇类含量为14.78%,其中1-辛烯-3-醇为6.91%,且嗅觉阈值较低(10 μg/kg)[16],具有类似蘑菇香气和泥土味[17]。叶绿醇是双萜类化合物,具有花香和脂香气,是合成维生素K及维生素E的原料,具有一定的抗氧化作用[18]。由表2和图3可知,溶剂提取-水蒸气蒸馏法挥发油中只有8.37%,多为嗅觉阈值更高的饱和醇,而具有抗氧化作用的叶绿醇含量从1.15% 提高到3.17%。
2.2.4 酮类化合物 酮类化合物是由于不饱和脂肪热氧化和氨基酸降解,嗅觉阈值比醛类高[19-20]。由表1、2可知,2种方法均检测出少量β-紫罗兰酮和植酮。β-紫罗兰酮为萜类物质,在一些海洋真菌和藻类中都有存在[21-22],具有紫罗兰香和木香,有抗真菌作用,此外还具有较强的抑癌作用[23-24]。
2.2.5 羧酸及酯类化合物 由图3可知,羧酸及酯类化合物相比于直接水蒸气蒸馏法,溶剂提取-水蒸气蒸馏法使羧酸及酯类含量从9.02%提高到21.54%。由表1、2可知,2种挥发油中都检测出包括花生四烯酸(ARA)和二十碳五烯酸(EPA)等多种多不饱和脂肪酸(PUFAs),PUFAs对人体有非常重要的生理功能,可以调节人体脂质代谢、增加血管弹性、降血压、降血脂、预防心脑血管疾病,促进生长发育,此外对抗癌、抗糖尿病、抗氧化、抗炎、调节免疫、延缓衰老、减肥、美容等方面均具有重要的生理作用[25-26]。
2.3 龙须菜挥发油抗菌作用
由表3可知,溶剂提取-水蒸气蒸馏法龙须菜挥发油在浓度为10 mg/mL条件下对金黄色葡萄球菌、单增李斯特菌、大肠杆菌O157、沙门氏菌和副溶血性弧菌均有一定抗菌作用,且抑菌作用均优于直接水蒸气蒸馏法的,抑菌效果为副溶血性弧菌>单增李斯特菌>沙门氏菌>大肠杆菌O157>金黄色葡萄球菌,其中对副溶血性弧菌抑菌率最高,可达17.69%。

表3 龙须菜挥发油的抑菌作用Table 3 The bacteriostatic action of volatile oil in G.Lemaneiformis
2.4 龙须菜挥发油抗卤虫活性
由图4可知,随着浓度的升高,挥发油对卤虫的杀虫活性明显增强。在相同浓度条件下,溶剂提取-水蒸气蒸馏法龙须菜挥发油的杀虫活性均高于直接水蒸气蒸馏法的。2种挥发油在0.16 mg/mL的浓度条件下,对卤虫的致死率均超过50%。
由图4数据可模拟计算,溶剂提取-水蒸气蒸馏法龙须菜挥发油和直接水蒸气蒸馏法龙须菜挥发油对卤虫LD50分别为0.126,0.162 mg/mL,且2种挥发油杀虫活性要明显高于敌敌畏、氯氰菊酯和氧乐果3种常见化学农药的[12]。
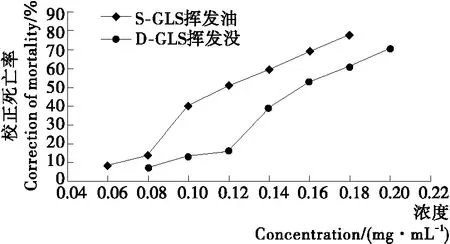
图4 龙须菜挥发油的杀虫活性结果Figure 4 The insecticidal activities of volatile oil in G.Lemaneiformis
3 结论
(1) 相比于直接水蒸气蒸馏法,溶剂提取-水蒸气蒸馏法得龙须菜挥发油营养价值较高,含有较高的羧酸及酯类。提取方法对挥发油成分产生明显影响。
(2) 龙须菜挥发油具有一定的广谱抗菌能力和较好的杀虫活性。溶剂提取-水蒸气蒸馏法是获得高活性龙须菜挥发油的有效方法。
(3) 本研究所得龙须菜挥发油对卤虫有较强的杀虫活性,证明该挥发油具有作为生物农药的可能,为扩展大型红藻龙须菜的应用范围提供了一定理论依据。由于尚未明确挥发油中抗虫抗菌的活性物质是哪些单体化合物及可能的机理,今后需要在这些方面继续深入开展研究工作。
[1] 曾呈奎.中国黄渤海海藻[M].北京: 科学出版社, 2009: 180.
[2] LU Hui-ming, XIE Hai-hui, GONG Ying-xue, et al.Secondary metabolites from the seaweedGracilarialemaneiformisand their allelopathic effects onSkeletonemacostatum[J].Biocheml Syst Ecol, 2011, 39(4/5/6): 397-400.
[3] 陆崇玉, 邓赟, 梅玲, 等.龙须菜化学成分研究[J].中草药, 2011, 42(6): 1 069-1 071.
[4] 梅文莉, 戴好富, 徐军田.龙须菜的有机酸组成及其细胞毒活性[J].中国海洋药物, 2006, 25(2): 45-47.
[5] 陈美珍, 余杰, 廖灶辉, 等.龙须菜多糖抑瘤活性及对荷瘤小鼠抗氧化作用的研究[J].中国海洋药物, 2008, 27(2): 46-49.
[6] 陈美珍, 余杰, 龙梓洁, 等.龙须菜多糖抗突变和清除自由基作用的研究[J].食品科学, 2005, 26(7): 219-222.
[7] 陆崇玉, 邓赟, 宋欣, 等.龙须菜活性成分的研究开发进展[J].时珍国医国药, 2011, 23(3): 711-712.
[8] KARABAY-YAVASOGLU N U, SUKATAR A, OZDEMIR G, et al.Antimicrobial activity of volatile components and various extracts of the red algaJaniarubens[J].Phytother Res, 2007, 21(2): 153-156.
[9] 卫强, 鲁轮, 龙先顺, 等.提取方法对木槿叶挥发油成分及其对肺癌A549细胞抑制作用的影响[J].食品与机械, 2016, 32(4): 160-166.
[10] 李昉, 杜方鹏.一株牛蒡共生真菌杀虫活性的研究[J].天然产物研究与开发, 2014, 26(9): 1 357-1 360.
[11] 邱春媚, 殷光玲.角鲨烯软胶囊提高缺氧耐受力的研究[J].中国粮油学报, 2013, 28(2): 52-54.
[12] 徐年军, 何艳丽, 唐军, 等.龙须菜(Gracilarialemaneiformis) 高温逆境代谢产物的GC-MS分析[J].海洋与湖沼, 2009, 40(2): 221-227.
[13] TIES P, BARRINGER S.Influence of lipid content and lipoxygenase on flavor volatiles in the tomato peel and flesh[J].J Food Sci, 2012, 77(7): C830-C837.
[14] 张红燕, 李晔, 袁贝, 等.金枪鱼油冬化前后脂肪酸含量和主体风味的解析[J].核农学报, 2017, 31(2): 314-324.
[15] 施文正, 王锡昌, 陶宁萍, 等.致死方式对养殖草鱼肉挥发性成分的影响[J].水产学报, 2011, 35(3): 456-465.
[16] 王雪锋, 涂行浩, 吴佳佳, 等.草鱼的营养评价及关键风味成分分析[J].中国食品学报, 2014(12): 182-189.
[17] CHEN De-wei, ZHANG Min.Analysis of volatile compounds in Chinese mitten crab (Eriocheirsinensis)[J].J Food Drug Anal, 2006, 14(3): 297-303.
[18] 周书娟.褐藻羊栖菜等化学成分及其抗氧化活性的研究[D].温州: 温州大学, 2015: 21-24.
[19] SUN S M, CHUNG G H, SHIN T S.Volatile compounds of the green alga,Capsosiphonfulvescens[J].J Appl Phycol, 2012, 24(5): 1 003-1 013.
[20] FRATINII G, LOIS S, PAZOS M, et al.Volatile profile of Atlantic shellfish species by HS-SPME GC/MS[J].Food Res Int, 2012, 48(2): 856-865.
[21] KAMENARSKA Z, IVANOVA A, STANCHEVA R, et al.Volatile compounds from some Black Sea red algae and their chemotaxonomic application[J].Bot Mar, 2006, 49(1): 47-56.
[22] ABDELBAKY H H, SHALLAN M A, BAROTY G E, et al.Volatile compounds of the microalgaChlorellavulgarisand their phytotoxic effect[J].Pak J Biol Sci, 2002, 5(1): 61-65.
[23] 刘家仁, 陈炳卿, 杨艳梅, 等.β-紫罗兰酮抑制SGC-7901细胞潜在的转移作用[J].卫生研究, 2005, 34(4): 435-438.
[24] DONG Hong-wei, ZHANG Shuang, SUN Wen-guang, et al.β-Ionone arrests cell cycle of gastric carcinoma cancer cells by a MAPK pathway[J].Arch Toxicol, 2013, 87(10): 1 797-1 808.
[25] 王萍, 张银波, 江木兰.多不饱和脂肪酸的研究进展[J].中国油脂, 2008, 33(12): 42-46.
[26] 孙翔宇, 高贵田, 段爱莉, 等.多不饱和脂肪酸的研究进展[J].食品工业科技, 2012, 33(7): 418-423.
