蒲公英总黄酮复合酶酶法提取工艺及抗氧化活性研究
2018-05-03张智
张 智
刘 洋1
尹文哲2
化洪苓1
遇恒林3
张志军3
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.哈尔滨医科大学附属第二医院,黑龙江 哈尔滨 150086;3.哈尔滨天合力制药有限公司,黑龙江 哈尔滨 150001)
蒲公英(TaraxacummongolicumHand.-Mazz.)为菊科蒲公英属植物,别名婆婆丁、丁奶奶、灯笼草及奶汁草等,分布广泛,几乎遍及中国多数地区[1-2],是一种常见的药食两用植物。蒲公英化学成分丰富,包括黄酮类、酚酸类物质、萜类、色素类、植物甾醇类、香豆素类等[3]。黄酮类化合物泛指一类存在于自然界的、具有2-苯基色原酮(flavone)结构的化合物[4],其具有抗自由基、抗氧化、抗炎、抗菌、抗病毒、抗肿瘤等多种药理作用[5-7],针对富含黄酮类活性物质天然产物的开发利用已成为功能性食品的研究热点。
目前对蒲公英中黄酮类活性物质的提取工艺研究很多,大多采用乙醇-水溶剂提取法[8]、超声波辅助提取法[9]21、微波提取法[9]22-23[10]。乙醇价格便宜,易于回收,但乙醇提取总黄酮效果并不是很好,在加热状态下易产生杂质增加后期分离难度;与有机溶剂提取方法相比,超声波提取法具有用时短、提取率高等优点,但超声温度不容易控制;微波提取法的瞬时加热方式可大大缩短提取时间、减小溶剂用量,从而加大提取率,但瞬时加热可能使有些活性成分变性。此外,酶解法由于酶具有高效性和专一性,近几年也广泛用于总黄酮的提取[11-14],而用复合酶酶法提取蒲公英总黄酮的研究还未见报道。
本试验拟选取乙醇溶液为提取溶剂,在单因素试验基础上,利用响应面优化蒲公英总黄酮超声波辅助提取工艺,并通过分析蒲公英总黄酮的DPPH自由基清除能力和总还原能力2个指标评价其抗氧化活性,为蒲公英黄酮类化合物的研究及开发利用提供参考。
1 材料与方法
1.1 试验材料、试剂与仪器
蒲公英:哈尔滨天合力制药有限公司;
纤维素酶:1.40×106U/g,北京博奥拓达科技有限公司;
果胶酶:1.0×105U/g,北京博奥拓达科技有限公司;
亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇:分析纯,天津市巴斯夫化工有限公司;
干燥箱:DZF-6092型,上海一恒科学仪器有限公司;
电子天平:FA2004B型,上海佑科仪器仪表有限公司;
pH计:SJ-3F型,上海圣科仪器设备有限公司;
水浴震荡器:SHA-B型,常州市亿能实验仪器厂;
超声波清洗器:KQ-300DE型,昆山市超声仪器有限公司;
离心机:TDL-4ZA型,湖南星科科学仪器有限公司;
紫外-可见光分光光度计:722型,上海精科仪器有限公司。
1.2 试验方法
1.2.1 原料预处理 新鲜蒲公英洗净,80 ℃条件下烘12 h,粉碎,过80目筛,置干燥箱备用。
1.2.2 总黄酮的提取工艺流程
蒲公英干粉→加入不同体积分数的乙醇溶液→加入酶在不同酶解条件下(加酶量、pH值、料液比、酶解时间、酶解温度)进行酶解处理→水浴震荡浸提→超声波提取(40 ℃、100 W、0.5 h)[12]→沸水浴灭酶5 min→离心取上清液
1.2.3 单因素试验
(1) 加酶量:参考张胜帮等[13-14]的方法,并稍作修改。准确称取蒲公英干粉1.000 g放入三角瓶中,以50%乙醇溶液为溶剂,料液比为1∶25 (g/mL),在pH 5.0的情况下,添加不同含量的纤维素酶和果胶酶(添加量见表1),并在50 ℃水浴振荡下酶解1.5 h,再经超声温度40 ℃、功率100 W处理0.5 h后,沸水浴灭酶5 min,离心取上清液,测定加酶量对总黄酮得率的影响。
(2) 料液比:准确称取蒲公英干粉1.000 g放入三角瓶中,以50%乙醇溶液为溶剂,分别在料液比为1∶15,1∶20,1∶25,1∶30,1∶35,1∶40 (g/mL),pH 5.0的情况下,添加纤维素酶2 mg、果胶酶4 mg,并在50 ℃水浴振荡下酶解1.5 h,再经超声温度40 ℃、功率100 W处理0.5 h后,沸水浴灭酶5 min,离心取上清液,测定料液比对总黄酮得率的影响。
(3) 乙醇浓度:准确称取蒲公英干粉1.000 g放入三角瓶中,分别以40%,50%,60%,70%,80%乙醇溶液为溶剂,料液比为1∶20 (g/mL),在pH 5.0的情况下,添加纤维素酶2 mg和果胶酶4 mg,并在50 ℃水浴振荡下酶解1.5 h,再经超声温度40 ℃、功率100 W处理0.5 h后,沸水浴灭酶5 min,离心取上清液,测定乙醇浓度对总黄酮得率的影响。
(5) 酶解温度:准确称取蒲公英干粉1.000 g放入三角瓶中,以50%乙醇溶液为溶剂,料液比为1∶20 (g/mL),在pH 5.0的情况下,添加纤维素酶2 mg、果胶酶4 mg,分别在30,35,40,45,50,55 ℃水浴振荡下酶解1.5 h,再经超声温度40 ℃、功率100 W处理0.5 h后,沸水浴灭酶5 min,离心取上清液,测定酶解温度对总黄酮得率的影响。
(6) 酶解时间:准确称取蒲公英干粉1.000 g放入三角瓶中,以50%乙醇溶液为溶剂,料液比为1∶20 (g/mL),在pH 5.0的情况下,添加纤维素酶2 mg、果胶酶4 mg,分别在50 ℃水浴振荡下酶解1.0,1.5,2.0,2.5,3.0 h,再经超声温度40 ℃、功率100 W处理0.5 h后,沸水浴灭酶5 min,离心取上清液,测定酶解时间对总黄酮得率的影响。
1.2.4 Design-Expert 响应面试验 在单因素试验基础上,运用 Design-Expert 软件,根据 Box-Behnken 中心组合试验设计原理[15],选择4个因素作为自变量,以提取液中黄酮得率为响应值设计响应面试验。
1.2.5 芦丁标准曲线的绘制 取芦丁标准品分别制得质量浓度为0.30,0.60,0.90,1.2,1.5,1.8 mg/mL的芦丁标准溶液,分别取1 mL于10 mL容量瓶中,加入50%乙醇溶液4 mL,再加入5%的NaNO2溶液0.4 mL,摇匀,静置6 min,加入10%的Al(NO3)3溶液0.4 mL,摇匀,再静置6 min后加入4%的NaOH溶液4 mL,用50%的乙醇溶液定容,摇匀,15 min后在510 nm处测吸光度。以50%乙醇溶液为空白,对不同芦丁质量浓度X(mg/mL)和对应吸光度Y作图,线性回归得到芦丁标准曲线,其回归方程为Y=1.132 7X+0.005 4,R2=0.999 6。
1.2.6 蒲公英总黄酮的测定 根据文献[16],修改如下:取试验提取的总黄酮1 mL于10 mL容量瓶中,按照1.2.5方法测定,并按式(1)计算蒲公英总黄酮得率。
(1)
式中:
A——蒲公英总黄酮得率,mg/g;
C——总黄酮质量浓度,mg/mL;
V——溶液体积,mL;
N——稀释倍数;
M——原料质量,g。
2016—2017年在襄阳市襄州区古驿镇张罗岗原种场、随州市随县农业科学研究所进行生产试验,表现分蘖力强、穗多、穗大、穗层整齐,抗倒性好,综合抗病性较好,每公顷产量分别为7680、7005kg/hm2。
1.2.7 蒲公英总黄酮抗氧化活性的研究
(1) DPPH·清除能力测定:分别配制质量浓度为0.2,0.4,0.6,0.8,1.0 mg/mL的蒲公英总黄酮和Vc溶液。同时用无水乙醇配制质量浓度为0.1 mmol/L的DPPH溶液,置于棕色瓶备用。准确吸取不同质量浓度的总黄酮溶液1 mL于试管中,并加入3 mL的DPPH溶液,充分混合,置于暗处反应30 min,在波长510 nm处测定吸光度。同时以等浓度的Vc溶液作为阳性对照。平行测定3次[17]。按式(2)计算DPPH·清除率。
(2)
式中:
K——清除率,%;
Ai——样品溶液的吸光度;
Aj——未添加DPPH溶液的吸光度;
A0——未添加样品溶液的吸光度。
(2) 总还原力的测定:在试管中分别加入2.5 mL pH为6.6的PBS溶液,再加入0.01 g/mL的铁氰化钾溶液1 mL,混匀后,加入蒲公英总黄酮1 mL,充分摇匀,50 ℃水浴静置20 min,待冷却后迅速加入10%三氯乙酸溶液2.5 mL混匀,吸取2 mL于另一试管中,加入0.1 g/mL三氯化铁溶液1 mL 混匀,静置10 min后于波长700 nm处测定吸光度。同时以VC为对照,平行测定3次[17]。
1.3 数据处理
数据通过Excel 2010进行相关计算处理,作图利用OriginPro 8.6进行处理。
2 结果与分析
2.1 复合酶酶法提取蒲公英总黄酮的单因素试验
2.1.1 加酶量对总黄酮得率的影响 由表1可知,加酶种类与加酶量不同会导致蒲公英总黄酮得率的不同,当纤维素酶添加量为2 mg/g、果胶酶添加量为4 mg/g时,蒲公英总黄酮得率达到最大值(9.50 mg/g);但当纤维素酶添加量为4 mg/g、果胶酶添加量为4 mg/g时,蒲公英总黄酮得率变小。从表1还可以看出,复合酶比单独酶作用提取的总黄酮得率高,因此选第5组加酶量较合适。

表1 加酶量对蒲公英总黄酮得率的影响Table 1 Effect of Enzyme Amount on the Yield of Total Flavonoids in Dandelion mg/g
2.1.2 料液比对总黄酮得率的影响 由图1可知,在料液比为1∶20 (g/mL)时蒲公英总黄酮得率达到最大值(12.65 mg/g),之后呈下降趋势。综合考虑,选择料液比1∶15,1∶20,1∶25 (g/mL)作响应面分析。
2.1.3 乙醇浓度对总黄酮得率的影响 由图2可知,当乙醇浓度<50%时,随着乙醇浓度的增大,蒲公英总黄酮得率呈现上升趋势;在乙醇浓度为50%时,蒲公英总黄酮得率达到最大;此后,随着乙醇浓度的增大,总黄酮得率逐渐减小。综合考虑,选择乙醇浓度为40%,50%,60%作响应面分析。
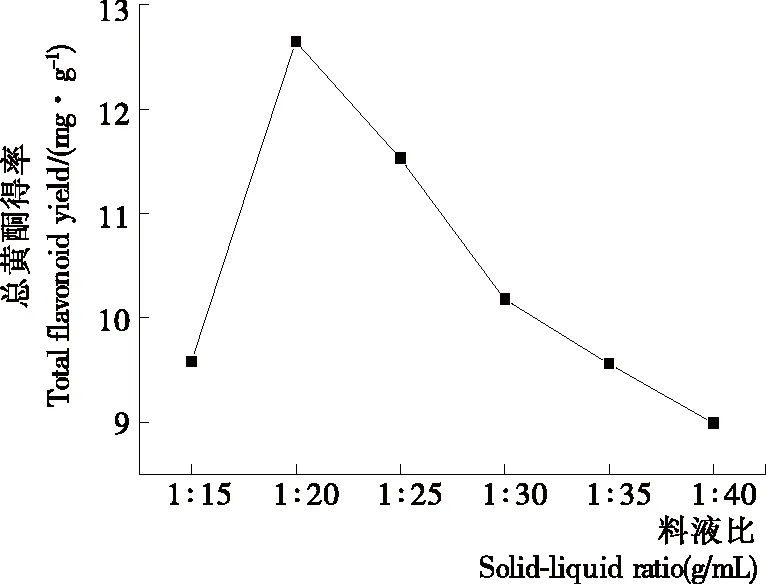
图1 料液比对蒲公英总黄酮得率的影响Figure 1 Effect of solid-liquid ratio on the yield of total flavonoids

图2 乙醇浓度对蒲公英总黄酮得率的影响Figure 2 Effect of ethanol concentration on the yield of total flavonoids
2.1.4 pH值对蒲公英总黄酮得率的影响 由图3可知,pH在3.0~4.5时,随着pH值的增大,蒲公英总黄酮得率呈现上升趋势;在pH值为4.5时,蒲公英总黄酮得率达到最大值(12.34 mg/g);当pH值>4.5时,蒲公英总黄酮得率呈现下降趋势。而纤维素酶的最适pH值为4.0~5.5,果胶酶的最适pH为2.5~6.0[13]。综合考虑,选择pH值4.0,4.5,5.0作响应面分析。
2.1.5 酶解温度对总黄酮得率的影响 由图4可知,当酶解温度在40~50 ℃时,蒲公英总黄酮得率随着温度的升高呈上升趋势,并在50 ℃达到最大值(11.88 mg/g)。此后,蒲公英总黄酮得率逐渐下降。综合考虑,选择酶解温度45,50,55 ℃ 作响应面分析。

图3 pH值对蒲公英总黄酮得率的影响Figure 3 Effect of pH on the yield of total flavonoids

图4 酶解温度对蒲公英总黄酮得率的影响Figure 4 Effect of enzyme hydrolysis temperature on the yield of total flavonoids
2.1.6 酶解时间对总黄酮得率的影响 由图5可知,在酶解时间1.0~2.0 h时,蒲公英总黄酮得率随着时间的延长呈上升趋势,当酶解时间超过1.5 h之后总黄酮得率几乎保持不变。综合考虑,选择酶解时间1.5 h较合适。

图5 酶解时间对蒲公英总黄酮得率的影响Figure 5 Effect of enzyme hydrolysis time on the yield of total flavonoids
2.2 响应面试验设计及结果
在单因素试验基础上,运用 Design-Expert 软件,选择料液比、乙醇浓度、pH值和酶解温度4个因素作为自变量(表2),以提取液中黄酮得率为响应值设计响应面试验,见表3。
通过Design-Expert 8.0.6软件对表3数据进行分析,结果见表4。由表4可知:料液比(P<0.01)、乙醇浓度(P<0.05)、酶解温度(P<0.05)对蒲公英总黄酮得率影响显著。经回归拟合后,得到回归方程:

表2 因素水平表Table 2 Factors level table
Y=14.66+1.19A+0.59B-0.18C+0.49D-0.41AB-0.093AC+0.22AD+0.83BC-0.047BD+0.023CD-1.35A2-1.11B2-1.65C2-2.94D2。
(3)
表4还表明,该模型的P<0.000 1,说明该拟合模型为极显著。模型中A、A2、B2、C2、D2均为差异极显著影响因素(P<0.01);B、D为差异显著影响因素(P<0.05)。失拟项(P=0.107 2)较小,表明该方程对试验拟合程度好,误差小,因此该模型成立[18],可用该回归方程确定蒲公英中总黄酮的最佳提取工艺。由F值可知,各因素对蒲公英总黄酮得率影响的大小顺序依次为:料液比>乙醇浓度>酶解温度>pH值。
通过 Design-Expert 8.0.6软件分析,确定了蒲公英总黄酮的最佳提取工艺为料液比1∶22.12 (mg/mL)、pH 4.5、乙醇浓度51.78%、酶解温度50.59 ℃,在此条件下的理论得率为14.99 mg/g。再基于设备的限制条件将响应面模型预测的最优条件修改为料液比1∶22 (mg/mL)、pH 4.5、乙醇浓度52%、酶解温度51 ℃。
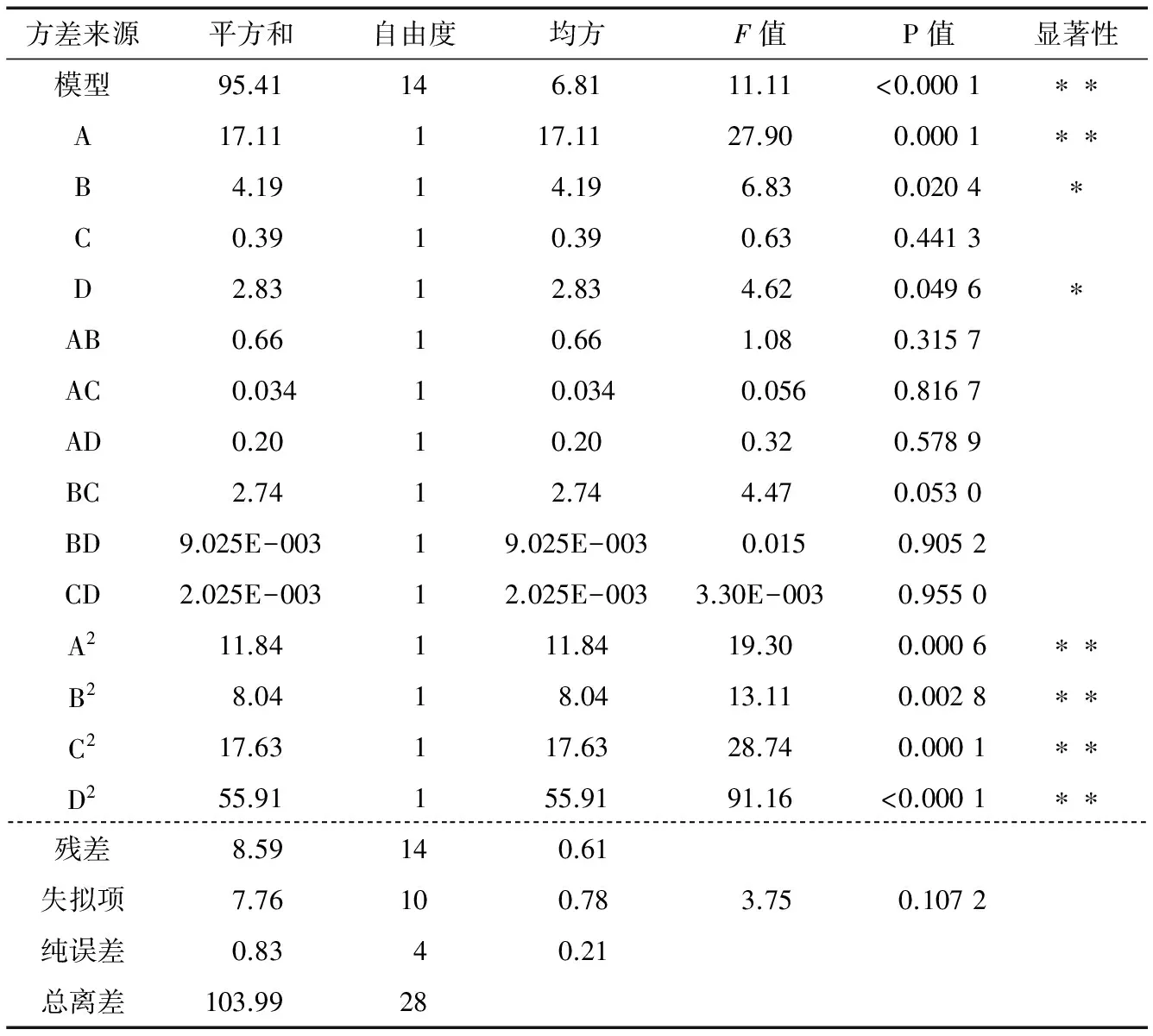
表4 响应面回归模型方差分析†Table 4 Response surface regression model variance analysis
† * 表示差异显著,P<0.05;** 表示差异极显著,P<0.01。
经3次平行实验得出,最佳提取工艺条件下蒲公英总黄酮平均得率为15.09 mg/g(n=3,RSD=0.021 6)。与理论预测值相比,其相对误差约为0.66%,重复性较好,说明优化结果可靠。因此,蒲公英总黄酮的最佳提取工艺为6 mg/g复合酶(2 mg/g纤维素酶+4 mg/g果胶酶)、料液比1∶22(g/mL)、pH 4.5、酶解时间1.5 h、乙醇浓度52%、酶解温度51 ℃。
2.3 蒲公英总黄酮抗氧化能力分析
2.3.1 对DPPH自由基的清除效果 由图6可知,随着样品质量浓度的增加,蒲公英总黄酮对DPPH自由基的清除作用逐渐增大,从0.2 mg/mL到1.0 mg/mL,蒲公英总黄酮对DPPH自由基的清除率从55.4%增加到68.3%,而在相同质量浓度时,VC对DPPH自由基的清除率从90.8%增加到93.2%,但与沙葱相比,同质量浓度0.4 mg/mL下,沙葱总黄酮对DPPH自由基清除率为38%[16],而蒲公英总黄酮对DPPH自由基清除率为60.2%,是沙葱的1.5倍,因此,相对于VC,蒲公英总黄酮对DPPH自由基的清除能力要低于VC,但蒲公英总黄酮对DPPH自由基的清除能力大于沙葱总黄酮,因此说明蒲公英总黄酮具有良好的DPPH自由基清除能力。
2.3.2 还原力试验 通过还原能力的测定,可以检测样品是否为良好的电子供体。还原能力强的样品可以提供更多的电子,其供应的电子不仅能使Fe3+还原为Fe2+,而且可以参与自由基的反应,使自由基形成稳定的状态。吸光度值越高表明还原力越强[19]。由图7可知,蒲公英总黄酮的还原能力较好,0.2~0.6 mg/mL浓度范围时,其吸光值几乎呈线性增长,浓度超过0.6 mg/mL后,吸光值增大速度减慢,说明蒲公英总黄酮的还原力与其质量浓度存在一定的线性关系。与VC相比,蒲公英总黄酮的还原能力稍弱,但与沙葱总黄酮相比,同质量浓度1.0 mg/mL下,沙葱总黄酮的吸光值为0.5[16],而蒲公英总黄酮的吸光值为0.57,略高于沙葱,说明蒲公英总黄酮具有良好的还原能力。

图7 样品与Vc还原能力比较Figure 7 Sample and Vc reduction capacity compared
3 结论
本试验采用四因素三水平响应面分析法对复合酶酶法提取蒲公英总黄酮进行优化,得到复合酶酶法的最优提取工艺条件为料液比1∶22 (g/mL)、乙醇浓度52%、pH 4.5、酶解温度51 ℃,在此条件下蒲公英总黄酮得率为15.09 mg/g,与樊友[10]采用微波提取蒲公英总黄酮相比得率要高,可能原因是在复合酶的共同作用下将细胞壁或细胞膜破坏,而且酶解法较温和,会加速蒲公英中黄酮类化合物的释放。说明复合酶酶法提取蒲公英总黄酮要比微波辅助法好。通过蒲公英总黄酮对DPPH自由基清除能力和总还原能力检测,发现其质量浓度和抗氧化性具有一致性,试验结果与袁河[9]54的趋势相同。
酶提取法简单高效,但与其他方法相比,初始投入过高、温度要求更严格成为限制其工业化应用的主要因素,如何在同等效率下有效降低成本成为酶解法提取活性成分的首要问题,还有待于进一步研究。
[1] 葛学军.中国植物志: 第80(2)卷[M].北京: 科学出版社, 1999: 32.
[2] 朱新华.畜产品质量安全现状及对策[J].中国畜牧兽医文摘, 2014, 30(1): 12.
[3] 黄昌杰, 林晓丹, 李娟, 等.蒲公英化学成分研究进展[J].中国现代中药, 2006, 8(5): 32-33.
[4] 李喜凤, 杜云锋, 郝哲.蒲公英中总黄酮的含量测定[J].中华中医药学刊, 2009(6): 1 219-1 220.
[5] WANG Hao, ZHANG Ze-sheng, GUO Ying.Hawthorn fruit increases the antioxidant capacity and reduces lipid peroxidation in senescence-accelerated mice[J].Eur Food Res Technol, 2011, 232: 743-751.
[6] THOMAS W, NGA T, TOSHIHIKO K, et al.Cancer chemopreventive properties of orally bioavailable flavonoids: methyla-ted versus unmethylated flavones[J].Biochemical Pharmaco-logy, 2007, 73(9): 1 288-1 296.
[7] DUARTE Juan, FRANCISCO Perez-vizcaino, JOSE Jimenez, et al.Flavonoids and cardiovascular diseases[J].Stud Nat Prod Chem, 2001, 25: 565-605.
[8] 侯学敏, 李林霞, 张直峰, 等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学, 2013, 34(6): 124-128.
[9] 袁河.蒲公英中黄酮类化合物的提取纯化及应用研究[D].长沙: 湖南农业大学, 2015.
[10] 樊友.微波提取蒲公英中黄酮类化合物的研究[J].杭州化工, 2012, 43(3): 16-18.
[11] 高文秀, 杨艳艳, 赵文卓, 等.复合酶解法协同超声波法提取山楂中总黄酮的工艺条件优化[J].食品工业科技, 2014, 35(2): 175-177.
[12] 邵圣娟, 李晓, 卫静莉.超声波辅助纤维素酶解法提取马尾松花粉中的总黄酮[J].中成药, 2016, 38(1): 204-206.
[13] 张胜帮, 叶静, 陈聪.复合酶酶法提取荷叶黄酮类化合物工艺优化[J].食品科学, 2012, 33(22): 150-153.
[14] 严静, 陈锦屏.复合酶酶解法提取青柿子落果中黄酮类化合物的研究[J].食品工业科技, 2011, 32(6): 315-317.
[15] 李志西, 杜双奎.试验优化设计与统计分析[M].北京: 科学出版社, 2010: 212-243.
[16] 萨如丽, 木其尔, 王翠芳, 等.沙葱总黄酮提取工艺优化及其体外抗氧化、抗菌作用[J].食品科学, 2014, 35(24): 2-6.
[17] 于震, 张智, 王振宇, 等.落叶松多酚提取工艺及其抗氧化活性研究[J].食品科技, 2014, 39(5): 207-212.
[18] SIN H N, YUSOF S, HAMID N S A, et al.Optimization of hot water extraction for sapodilla juice using response surface methodology[J].Food Eng, 2006, 75(3): 352-358.
[19] YEN Gow-hin, DUH Pin-er.Antioxidative properties of methanolic extacts from peanut hulls[J].Journal of American Oil Chemists Society, 1993, 70: 383-386.
