高水解率低乳糖奶的制备及糖类分析
2018-05-03伍桃英
伍桃英
程云辉1
赵良忠2
欧阳林3
许 宙1
(1.长沙理工大学化学与生物工程学院,湖南 长沙 410076;2.邵阳学院食品与化学工程学院,湖南 邵阳 422000;3.邵阳学院第二附属医院普外科,湖南 邵阳 422000)
牛乳富含蛋白质、脂肪、乳糖、矿物质以及多种维生素,是自然界赐予人类最理想的天然食品之一[1]。乳糖是乳类中特有的碳水化合物,牛乳中乳糖含量为4.6%~5.0%,占总糖量的99%以上[2]。正常生理条件下,乳糖经小肠内乳糖酶作用,水解为葡萄糖和半乳糖才能被人体吸收,但是当人体内乳糖酶缺乏或活力不够时,摄入含乳糖的乳制品易发生乳糖吸收不良甚至乳糖不耐症,这是制约乳及乳制品消费的主要原因之一[3]。β-半乳糖苷酶能将牛乳中的乳糖水解成葡萄糖、半乳糖[4]。目前酶法水解乳糖制备低乳糖奶的方法有2种:① 采用低温长时水解法,即在线添加乳糖酶后,采用4~6 ℃水解12~20 h;② 采用高温短时水解法,即采用中高温酶,在30~40 ℃水解2~4 h。马夫侠[5]、秦立虎[6]、常忠义[7]、王辉[8]等采用这2种方法对低乳糖奶的制备进行了研究,但其乳糖水解率大多在60%~70%,只能一定程度上缓解乳糖不耐受症状。因此,采用β-半乳糖苷酶制备高水解率低乳糖奶,对满足乳糖不耐症患者的消费需求及促进中国乳品工业的发展仍具有十分重要的意义。本研究拟以乳糖水解率为考察指标,利用游离的β-半乳糖苷酶对牛乳中的乳糖进行水解,通过响应面优化,确定高水解率低乳糖奶水解的最佳工艺,并采用HPLC对低乳糖乳奶中的糖类进行分析,以期为高水解率低乳糖奶工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
全脂奶粉:湖南亚华乳业有限公司;
Lactozyme:3 000 U/mL,诺维信(中国)生物技术有限公司;
Maxilact:3 000 U/mL,帝斯曼食品配料公司;
K3-T:5 000 U/g,山东天赐国际贸易有限公司;
Lactose F:300 U/g,日本天野酶制品株式会社;
葡萄糖试剂盒:上海科欣技术研究所;
葡萄糖、半乳糖、乳糖:色谱纯,西格玛奥德里奇(上海)贸易有限公司;
试验用水为实验室自制蒸馏水。
1.2 主要仪器设备
高效液相色谱仪:Waters600型,沃特世科技(上海)有限公司;
可见分光光度计:SpectrumLab 22PC型,上海棱光技术有限公司;
台式pH计:Delta320型,上海君达仪器仪表有限公司;
电子分析天平:FA2004N型,上海精密科学仪器有限公司;
可调式移液枪(20~200 μL):Finnpipette型,热电(上海)仪器有限公司;
电热恒温干燥箱:CS202型,重庆实验设备厂;
数显恒温水浴锅:HH型,江苏金坛市金城国胜实验仪器厂。
1.3 试验方法
1.3.1 低乳糖奶的制备工艺
1.3.2 操作要点
(1) 配制复原乳:由于牛奶中乳糖含量为4.6%~5.0%,此次研究采用全脂奶粉按照1∶7 (g/mL)的复水比配制成复原乳,乳糖及其水解率的测定采用碘量法[9],按式(1)计算乳糖水解率。
(1)
式中:
α——乳糖水解率,%;
c0——单质碘标准溶液的浓度,mol/L;
V0——测定时准确移取的单质碘的体积,mL;
cs——Na2S2O3溶液的浓度,mol/L;
V1、V2——酶解前、后牛奶滤液消耗Na2S2O3的体积,mL。
(2) 酶活测定:采用葡萄糖氧化酶试剂盒法[10]。
(3) 乳糖水解:复原乳经95 ℃/15 s杀菌后冷却到适宜温度,以一定比例添加乳糖酶,于恒温水浴振荡器中水解一定时间。
1.3.3 HPLC法检测牛奶中的糖类 采用高效液相色谱仪对牛奶中的乳糖、葡萄糖、半乳糖及低聚半乳糖进行定量检测,样品经12 000 r/min离心后直接检测,具体的HPLC条件[11]:
(1) 检测葡萄糖、半乳糖的HPLC条件:Sugar-Pak I(6.5 mm×300 mm)色谱柱;流动相:纯水;检测器灵敏度:4;柱温:85 ℃;流速:0.4 mL/min;进样体积:5 μL。
(2) 检测乳糖、低聚半乳糖的HPLC条件:Hpersil APS(4.6 mm×250 mm)色谱柱;流动相:乙腈/水(75/25);检测器灵敏度:4;柱温:30 ℃;流速:1.0 mL/min;进样体积:10 μL。
样品中葡萄糖、半乳糖、乳糖及低聚半乳糖分别按式(2)~(5)计算:
(2)
(3)
(4)
(5)
式中:
c1、c2、c3、c4——样品中葡萄糖、半乳糖、乳糖、低聚半乳糖的浓度,mg/mL;
c10、c20、c30、c40——标样中葡萄糖、半乳糖、乳糖、低聚半乳糖的浓度,mg/mL;
S1、S2、S3、S4——样品中葡萄糖、半乳糖、乳糖、低聚半乳糖的峰面积,mV·min;
S10、S20、S30、S40——葡萄糖、半乳糖、乳糖、低聚半乳糖标样的峰面积,mV·min。
2 结果与讨论
2.1 制备低乳糖奶的工艺研究
β-半乳糖苷酶的酶活采用葡萄糖氧化试剂盒测定,酶活见表1。
Lactase F乳糖酶为酸性乳糖酶,在中性的鲜乳或复原乳中酶活不高;Lactozyme、Maxilact、K3-T均为中性乳糖酶,其中Lactozyme、K3-T在40,45 ℃酶活较高且活性相当,适用于牛乳中乳糖的分解,但K3-T较 Lactozyme价格高昂,因此,综合选择酶活较高、价格较低的Lactozyme乳糖酶作为制备低乳糖奶的游离酶种。在单因素试验的基础上,以[E]/[S]、水解温度及时间为因素,以乳糖水解率为响应值,采用响应面法[12-14](RSA)寻求酶解最优工艺参数,RSA试验设计与结果分别见表2、3。
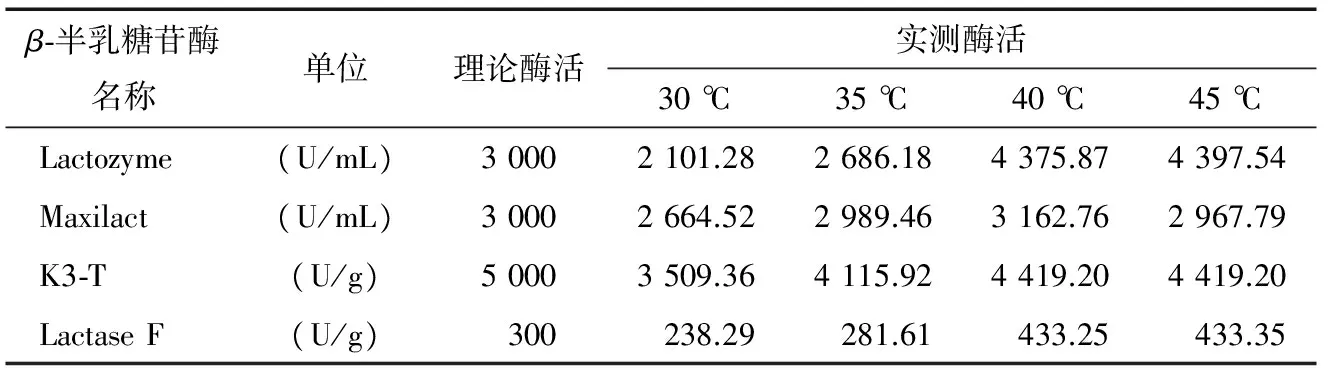
表1 4种β-半乳糖苷酶的酶活Table 1 The enzyme activities and prices of three kinds of β-galactosidase
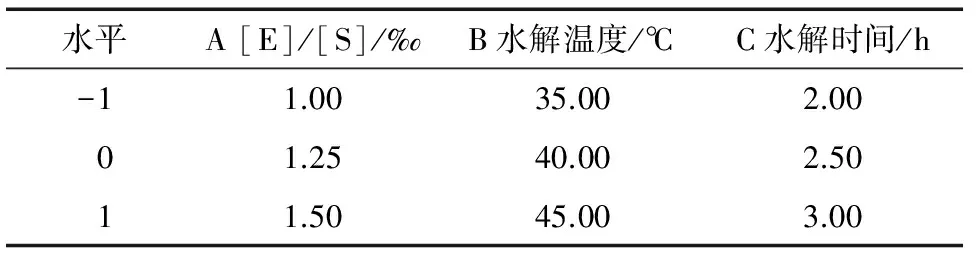
表2 RSA试验因素水平Table 2 Experimental factors and levels of RSA
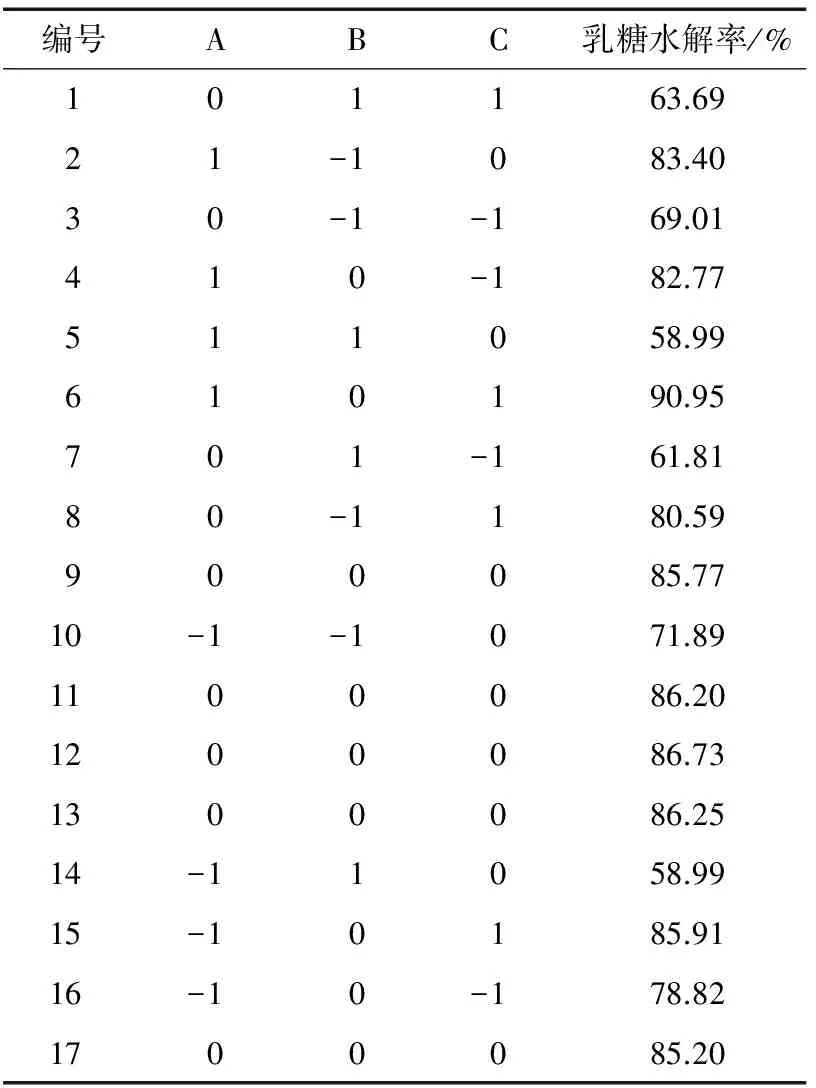
表3 RSA试验结果Table 3 Experimental results of RSA
采用Design Expert 8.0.5B软件对RSA试验结果进行二次回归分析,得到方程:
α=84.89+3.98A-0.80B+4.50C+0.12AB+1.95AC+0.82BC-2.78A2-11.79B2-1.08C2。
(6)
为了进一步研究相关变量之间的交互作用并确定最优点,通过Design-Expert绘制响应面曲线图进行可视化分析,以水解率(α)作为响应值,分别作水解温度与水解时间、[E]/[S]与水解温度、[E]/[S]与水解时间关系图,结果见图1~3。
图1反映了在[E]/[S]为1.25‰时,水解温度与时间对乳糖水解率影响的响应面曲线。由图1可知,同一温度下,乳糖水解率随着水解时间的增加而增大;相同[E]/[S]与水解时间下,乳糖水解率与水解温度呈抛物线变化。当[E]/[S] 为1.25‰、水解温度为37.5~40.0 ℃、水解时间为3.0 h时,乳糖水解率最高可达90.65%。
图2反映了在水解时间为2.5 h的条件下,[E]/[S]和水解温度对乳糖水解率的影响。由图2可知,随着[E]/[S]的提高,乳糖水解率随之增大;同一[E]/[S]条件下,乳糖水解率与温度呈抛物线变化趋势。当[E]/[S]为1.5‰、水解温度为37.5~40.0 ℃时,乳糖水解率可达89.13%。
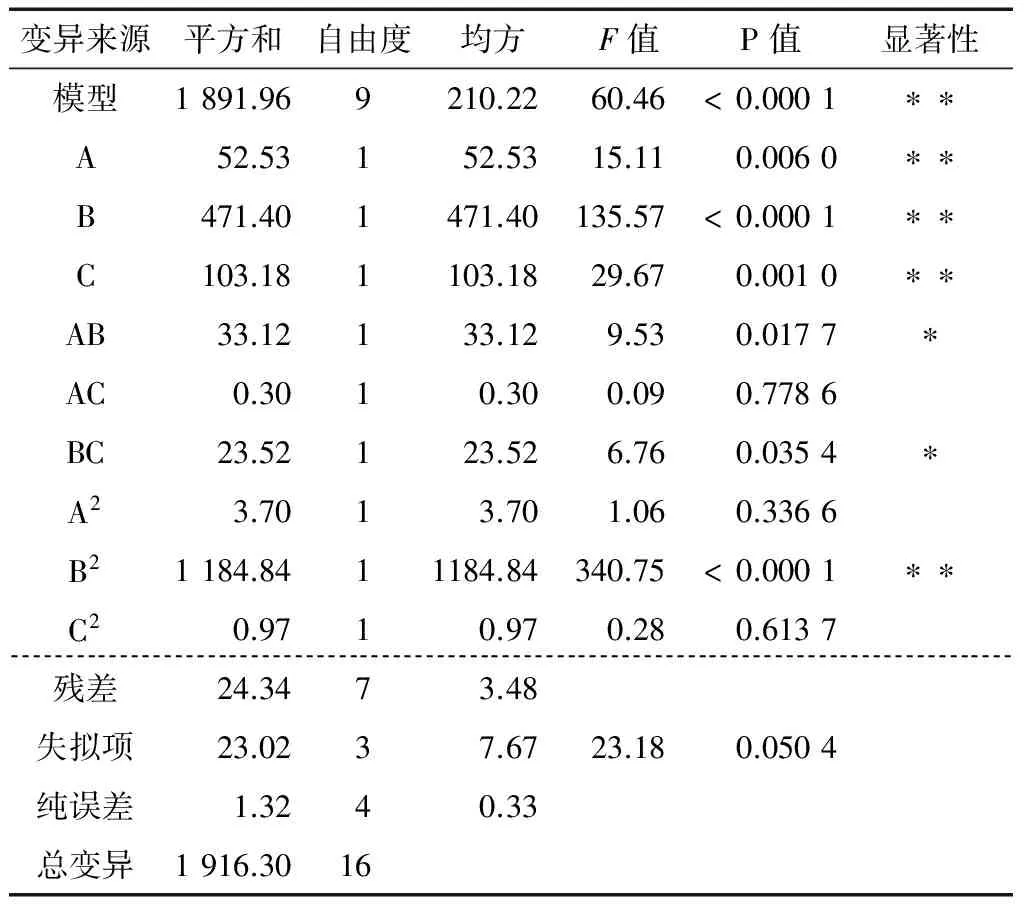
表4 RSA 方差分析†Table 4 ANOVA for response surface quadratic model

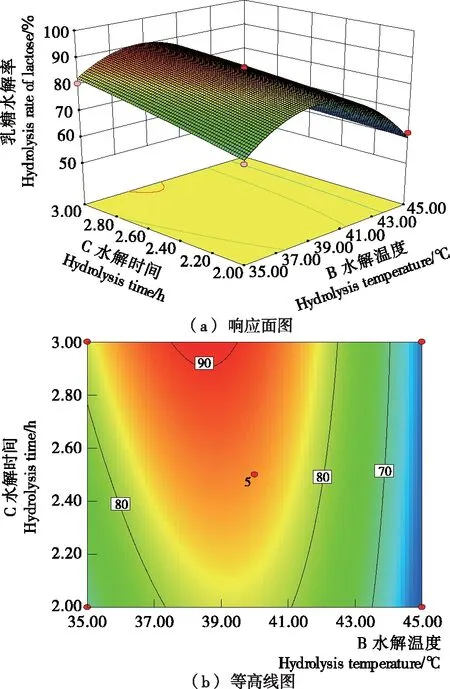
图1 水解温度与时间对乳糖水解率影响的响应面与等高线图([E]/[S]=1.25‰)
Figure 1 Response surface and contour plots surface of the effects of hydrolysis temperature and time on the hydrolysis rate of lactose
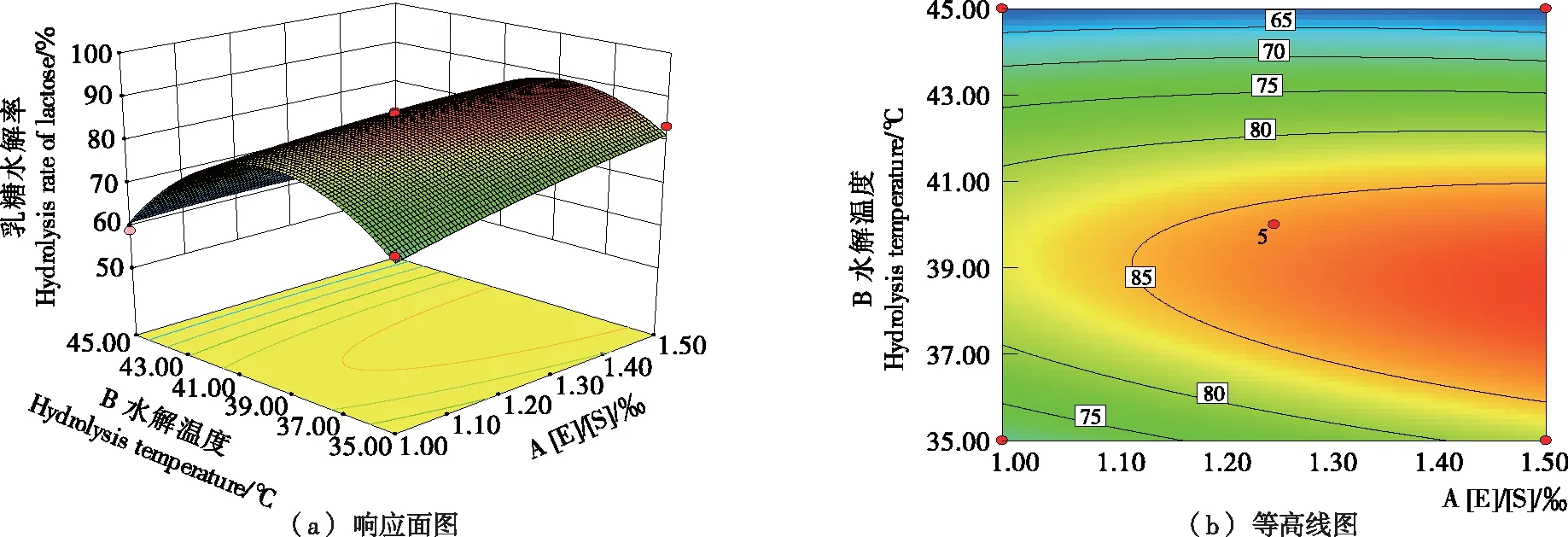
图2 [E]/[S]与水解温度对乳糖水解率影响的响应面与等高线图(水解时间2.5 h)Figure 2 Response surface and contour plots surface of the effects of [E]/[S] and Hydrolysis Temperature on the hydrolysis rate of lactose
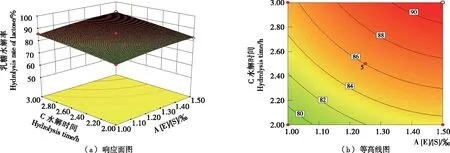
图3 [E]/[S]与水解时间对乳糖水解率影响的响应面与等高线图(水解温度40 ℃)Figure 3 Response surface and contour plots surface of the effects of [E]/[S] and hydrolysis time on the hydrolysis rate of lactose
图3反映了在水解温度为40 ℃条件下,[E]/[S]与水解时间对乳糖水解率的影响。由图3可知,同一温度下,水解相同时间,乳糖水解率随着[E]/[S]的增加而增大;同一[E]/[S]条件下,乳糖水解率与水解时间呈正相关。当[E]/[S] 为1.5‰、水解时间为3.0 h时,乳糖水解率最高可达91.04%。
通过Design Expert软件分析,得出水解牛乳中乳糖的最佳工艺条件为:[E]/[S]为1.50‰、水解温度38.06 ℃、水解时间3.0 h。在此条件下3组平行验证实验的平均得率为92.67%,与软件估测值93.55%相近,说明实际情况与优化结果能良好吻合。
2.2 HPLC法分析乳中的糖类
低乳糖奶采用RSA得到的最佳工艺制备,复原乳与低乳糖奶样品于95 ℃杀菌5 min,冷却后12 000 r/min离心,用HPLC直接检测。
2.2.1 样品中乳糖、葡萄糖、半乳糖 在检测葡萄糖、半乳糖的HPLC条件下,首先对乳糖(RT)、葡萄糖(PTT)、半乳糖(BRT)3个标样进行检测,得到的色谱图见图4,各个标样对应的保留时间、峰面积与浓度数值见表5。复原乳与低乳糖奶中乳糖、葡萄糖、半乳糖的HPLC图见图5、6。
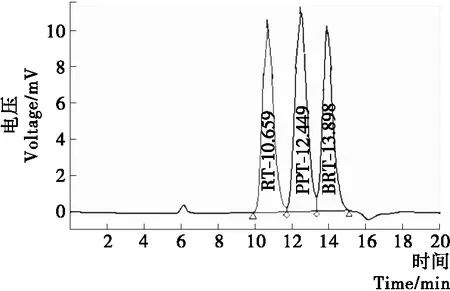
图4 标样的色谱图Figure 4 Chromatogram of standard samples
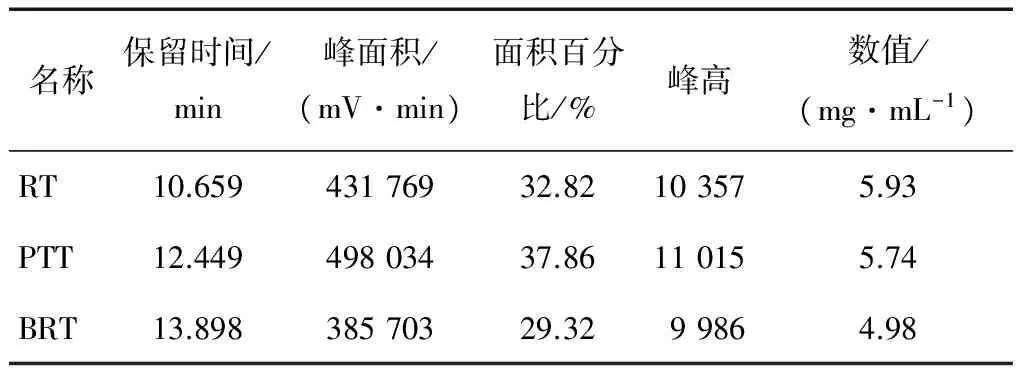
表5 标样的检测结果Table 5 The test results of standard samples

图5 复原乳中糖类的HPLC图Figure 5 The HPLC diagrams of various sugars in milk
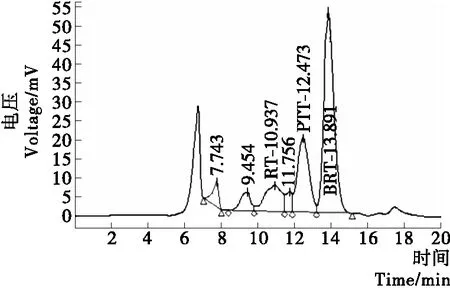
图6 低乳糖奶中糖类的HPLC图Figure 6 The HPLC diagrams of various sugars in low-lactose milk
由图5、6可知,复原乳中的糖类主要是乳糖,含量为52.343 mg/mL,不含葡萄糖,半乳糖的含量极微,浓度为0.626 mg/mL;而低乳糖奶中的乳糖、葡萄糖、半乳糖的含量分别为6.086,9.964,26.101 mg/mL,说明复原乳中近90%的乳糖被β-半乳糖苷酶水解,生成了葡萄糖、半乳糖;但乳糖、葡萄糖、半乳糖的总和小于100%,说明还有其他糖生成。
2.2.2 样品中乳糖、低聚半乳糖 由于乳糖在水解过程中除生成葡萄糖、半乳糖之外,还生成了其他糖,在此对低聚半乳糖进行研究。在检测乳糖、低聚半乳糖的HPLC条件下对低聚半乳糖对照品标样进行检测,结果见图7和表6。
由图8、9可知,复原乳中93.05%的糖是乳糖,通过HPLC还检测出了另外3种糖,其含量合计为整个糖类的6.95%;而低乳糖奶中的乳糖、低聚半乳糖的含量分别为整个糖类的3.04%和14.02%,其余为单糖。说明β-半乳糖苷酶有转糖苷的作用,可生成功能性低聚糖。
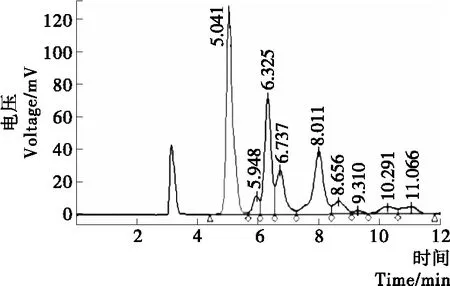
图7 低聚半乳糖对照品标样的色谱图Figure 7 Chromatogram of galacto-oligosaccharide reference standard samples
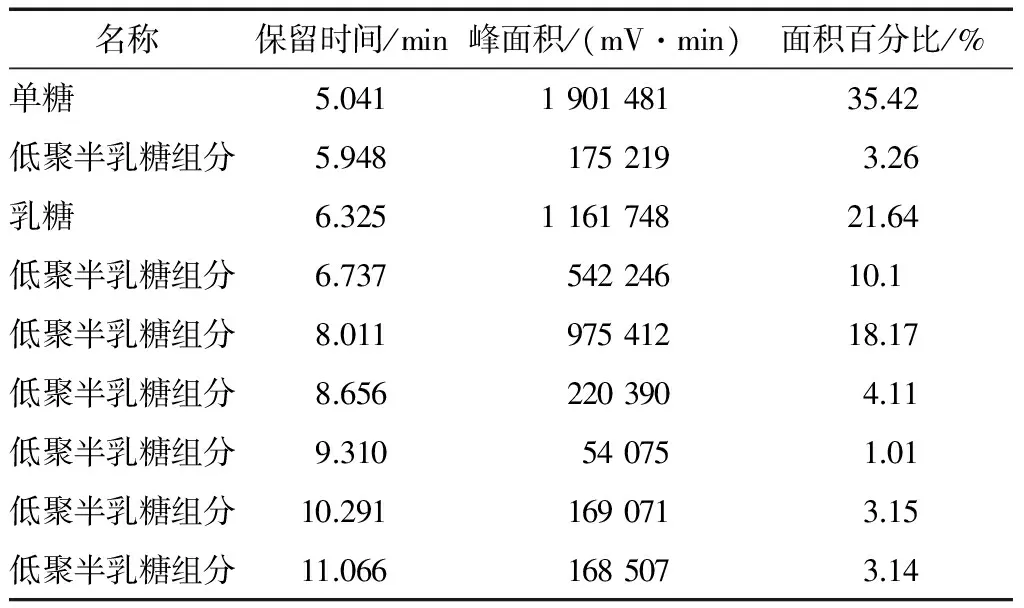
表6 低聚半乳糖对照品标样的检测结果†Table 6 Results of galacto-oligosaccharide reference standard samples
† 对照品中保留时间6.325 min的峰为乳糖,保留时间为5.948,6.737 min及以后出峰的为低聚半乳糖组分的峰。
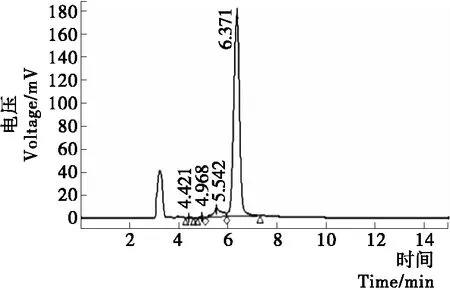
图8 复原乳中糖类的HPLC图Figure 8 The HPLC diagrams of various sugars inreconstituted milk
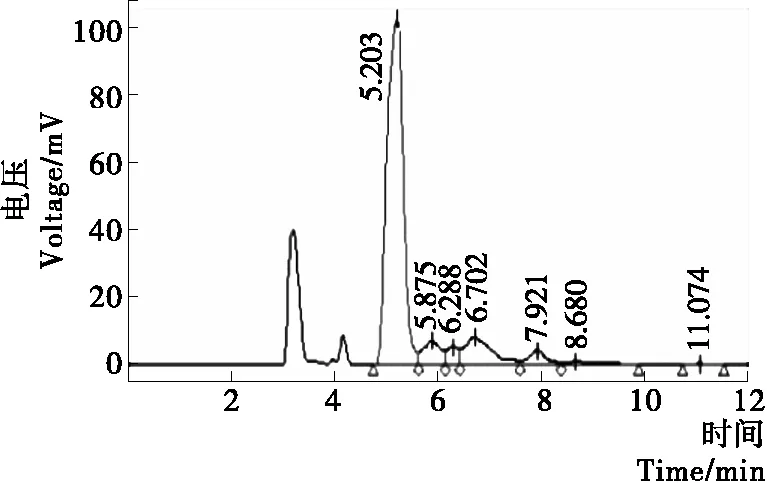
图9 低乳糖奶中糖类的HPLC图Figure 9 The HPLC diagrams of various sugars in low lactose milk
3 结论
本试验采用Lactozyme制备高水解率低乳糖奶,通过响应面确定最佳条件为:[E]/[S] 1.50‰、水解温度38.06 ℃、水解时间3.0 h,在此条件下制备的低乳糖奶的乳糖水解率高达92.67%,较前人[15]研究的乳糖水解率提高了20%~30%;通过HPLC分析,证明了复原乳中90%以上的乳糖被β-半乳糖苷酶水解,同时在自制的低乳糖奶中有14.02%的低聚半乳糖生成,说明了β-半乳糖苷酶既能水解乳糖,又有转糖苷的作用。
本试验在乳糖水解中生成了大量的还原性单糖,其羰基与蛋白质在灭菌过程中会发生美拉德反应,导致低乳糖奶产生非酶褐变,故需对低乳糖奶的褐变及其抑制进行后续研究。
[1] 顾瑞霞.乳与乳制品的生理功能特性[M].北京: 中国轻工出版社, 2000: 1-60.
[2] 李凤林, 崔福顺.乳及发酵乳制品工艺学[M].北京: 中国轻工业出版社, 2007: 18-21.
[3] 赵显峰, 荫士安.乳糖不耐受以及解决方法的研究动态[J].中国学校卫生, 2007, 28(12): 1 151-1 153.
[4] 龚广予, 李明.低乳糖牛乳的研制[J].乳业科学与技术, 1999(3): 43-46.
[5] 马夫侠, 张晓东, 秦翠霞.低乳糖牛奶的工艺参数研究[J].食品工业科技, 2002, 23(1): 51-52.
[6] 秦立虎, 宗青山, 孙艳波, 等.低乳糖牛奶的研制[J].食品与发酵科技, 2003(3): 72-74.
[7] 常忠义, 王莉, 王海萍, 等.低乳糖牛奶的研究开发[J].食品科技, 2003(3): 60-62.
[8] 王辉, 张秀玲.低乳糖牛奶生产工艺参数的研究[J].中国乳品工业, 2006, 34(1): 52-53.
[9] 伍桃英, 李梦怡, 李亦蔚, 等.3种测定乳制品中乳糖含量方法的比较[J].食品与机械, 2010, 26(5): 71-74.
[10] 王子龙, 梅林, 王志耕.低乳糖牛奶水解率的快速测定[C]// 中国奶业协会2009年会议论文集.北京: 中国乳业, 2009: 153-154.
[11] 甘宾宾, 蒋世琼.高效液相色谱法测定乳糖酶水解产物中的糖类[J].食品与发酵工业, 2001, 27(12): 39-40.
[12] 李亚娜, 林永成, 佘志刚.响应面分析法优化羊栖菜多糖的提取工艺[J].华南理工大学学报: 自然科学版, 2004, 32(11): 28-32.
[13] 程云辉, 王璋, 许时婴.酶解麦胚蛋白制备抗氧化肽的研究[J].食品科学, 2006, 27(6): 147-151.
[14] 项丽丽, 季妮娜, 粘靖祺, 等.响应面法对乳清中乳糖酶解工艺条件的研究[J].食品工业科技, 2011, 32(2): 233-235.
[15] 孙东跃, 陈历俊.低乳糖奶的研究进展及应用[J].中国食品添加剂, 2012(4): 245-249.
