雌激素及其受体ERβ在原发性痛风患者PBMCs中的表达差异研究*
2018-05-03李梦兰帅世全党万太何馨怡孙红兵李天红杨婧银小双周京国
李梦兰 帅世全 党万太, 何馨怡 孙红兵 李天红 杨婧 银小双 周京国
(1. 南充市中心医院·川北医学院第二临床医学院风湿免疫科, 四川 南充 637000;2.成都医学院第一附属医院, 四川 成都 610500)
痛风是一种单钠尿酸盐沉积于组织或器官,引起急、慢性炎症和组织损伤的临床综合征,与嘌呤代谢紊乱及(或)尿酸排泄减少所致的高尿酸血症直接相关[1-2]。流行病学调查发现,痛风患病率呈明显的性别差异,痛风患者中95%为男性,初次发作年龄一般为40岁以后,而女性痛风大多出现在绝经后[3]。De Souza等[4]对男女性痛风患者研究发现,女性痛风发病年龄平均比男性晚7年。Hak等[5]研究也发现自然绝经的妇女,45岁前绝经比50~55岁绝经患痛风的概率高,且绝经后使用女性激素能在一定程度上降低患痛风的危险性。有研究表明,女性体内的17β-雌二醇可使细胞器的磷脂膜抵抗尿酸盐结晶沉淀,故雌激素可能对肾脏排泄尿酸有促进作用[6],资料提示雌激素可能在痛风的发病中发挥了作用,但作用机制,目前尚未见到相关文献报道。本研究采用CMIA检测痛风患者、高尿酸血症患者、健康体检者血清中雌二醇(Estradiol, E2)水平。同时通过RT-qPCR检测其PBMCs中ERβ mRNA的表达水平,并分析两者之间的相关性,探讨雌激素及其受体ERβ在原发性痛风性关节炎中的变化及其可能的作用。
1 资料与方法
1.1 临床资料 36例男性原发性急性期痛风患者(AG组),年龄21~61岁,平均(42±10)岁;36例男性原发性间歇期痛风患者(IG组),年龄22~67岁,平均(44±13)岁;37例男性原发性慢性期痛风患者(CG组),年龄23~57岁,平均(43±8)岁均来自南充市中心医院风湿免疫科和川北医学院附属医院风湿免疫科2015年12月~2016年12月门诊或住院患者,所有患者均符合1977年ACR制定的痛风诊断标准[7],并排除肾脏疾病、血液疾病、药物等引起的继发性痛风。另选38名男性健康体检者(HC组),年龄28~67岁,平均(42±8)岁和44例无症状高尿酸血症(HUA组)患者,年龄25~66岁,平均(40±11)岁,均来自同期南充市中心医院体检中心和川北医学院附属医院体检中心。五组间年龄比较差异无统计学意义(P>0.05)。所有参与者均签署知情同意书并得到南充市中心医院和川北医学院附属医院伦理委员会批准。
1.2 实验方法
1.2.1 主要试剂与仪器 人淋巴细胞分离液LS1077(天津灏洋生物公司),Trizol(Invitrogen公司, 美国),Loading buffer(TaKaRa公司,日本),反转录试剂盒(TaKaRa公司,日本),RT-PCR试剂盒(TaKaRa公司,日本),ERβ、内参β肌动蛋白基因引物(上海生工生物工程有限公司),LH750血细胞分析仪(Beckman公司,美国),DxC800生化分析(Beckman公司,美国),低温高速离心机5417R(Eppendorf公司,美国),雅培化学发光免疫分析仪(ABBOTT公司,美国),紫外分光光度仪(Thermo Fisher公司,美国),7900Real-Time PCR仪(Applied Biosystem公司,美国)。
1.2.2 标本采集与处理 所有病例均空腹抽取外周静脉血3ml,肝素抗凝,2000r/min,离心5min,分离血浆,-80℃保存,为检测血清E2水平备用,另一部分血液采用人淋巴细胞分离液提取外周血单个核细胞(PBMCs),加Trizol以提取PBMCs中总RNA,紫外分光光度仪测定吸光度(A)260/280(1.8~2.0者采用)。按照TaKaRa公司逆转录试剂盒说明书操作,取总RNA 2ul,5gDNA Eraser Buffer 4ul,gDNA Eraser 2ul, RNase Free dH2O 12ul于离心管混合,室温反应30min,再加入配制好的Master Mix,包括PrimeScript RT Enzyme Mix2ul,RT Primer Mix2ul,5PrimeScript Buffer 2 8ul,RNase Free dH2O 8ul,置于PCR仪中, 37℃15 min 85℃5sec,4℃ 60min,终止反应,将反转录cDNA冻存于-80℃备用。
1.2.3 常规实验室指标的测定 常规实验室指标测定均在南充市中心医和川北医学院附属医院检验科完成。包括WBC、HGB、GR、MO、CRP、AST、ALT、ESR、UA、TCH、TG、GLU、HDL-C、LDL-C、apoA1等实验室指标。
1.2.4 血清E2水平检测 将收集血浆室温溶解,震荡混匀后,12000r/min,离心10min。送川北医学院附属医院检验科用化学发光微粒子免疫检测法检测血清中E2水平。
1.2.5 实时荧光定量PCR检测PBMCs中ERβ、β-actin mRNA的表达水平 所有基因对应引物由上海生工生物有限公司合成,基因名称和上、下游引物序列和产物长度(表1)。在QuantStudioTM12k Flex实时荧光定量PCR系统上进行Realtime-PCR,反应体系为: 10ul Power SYBR Green PCR Master Mix,ROX D也0.4ul,上下游引物各0.15ul,cDNA 2ul,ddH2O补充至20ul。反应条件为:95℃ 30sec,95℃ 5sec,60℃ 34sec,共40个循环,反应结束后作溶解曲线,每份标本均设复孔。以目的基因的Ct值减去内参基因的Ct值为Ct,2-Ct值表示目的基因mRNA表达的高低[8-9]。

表1 实时定量PCR引物Table 1 Real time quantitative PCR primers
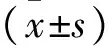
2 结果
2.1 临床资料比较 痛风组(AG组、IG组、CG组)和HUA组尿酸、TG均高于HC组(P<0.05),且痛风组ALT、AST均高于HUA和HC组(P<0.05)。AG组WBC显著高于其他四组(P<0.05)。CG组Urea、Crea、VLDL-C、apoB1、CysC高于其他四组(P<0.05)。AG组中ESR、GR、LY、MO、ALT、AST、VLDL-C和血糖均高于HC组(P<0.05),但其HGB、HDL-C、LDL-C却低于HC组(P<0.05)。AG组GR、MO均高于IG、CG组(P<0.05)。IG组GR、VLDL-C、apoB1、CysC均高于HC组(P<0.05)。IG组apoA1高于AG组(P<0.05),而其ESR、HDL-C低于AG组(P<0.05)。CG组ESR、GR、MO、GLU均高于HC组(P<0.05),其LY、apoA1低于HC组(P<0.05),见表2。
表2 HC、HUA、AG、IG、CG组临床资料分析Table 2 Analysis of the clinical data of group HC, HUA, AG, IG and CG
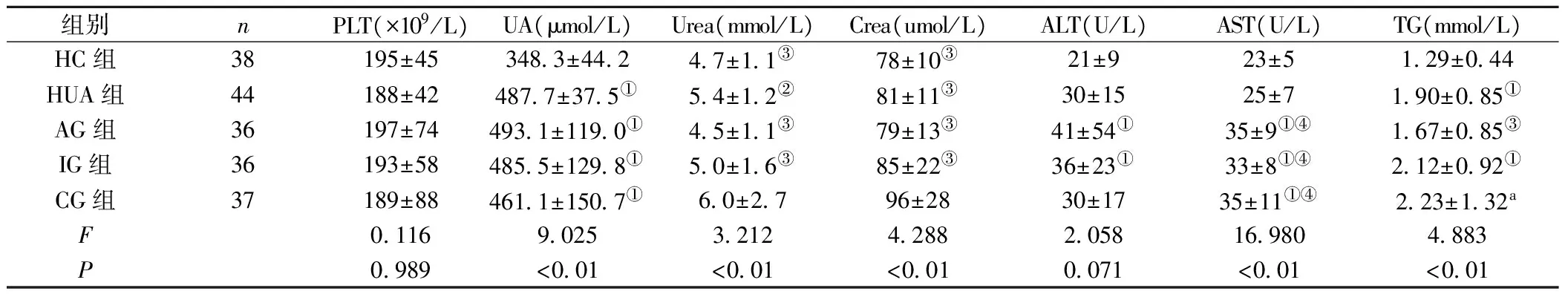
组别nPLT(×109/L)UA(μmol/L)Urea(mmol/L)Crea(umol/L)ALT(U/L)AST(U/L)TG(mmol/L)HC组38195±453483±44247±11③78±10③21±923±5129±044HUA组44188±424877±375①54±12②81±11③30±1525±7190±085①AG组36197±744931±1190①45±11③79±13③41±54①35±9①④167±085③IG组36193±584855±1298①50±16③85±22③36±23①33±8①④212±092①CG组37189±884611±1507①60±2796±2830±1735±11①④223±132aF01169025321242882058169804883P0989<001<001<0010071<001<001
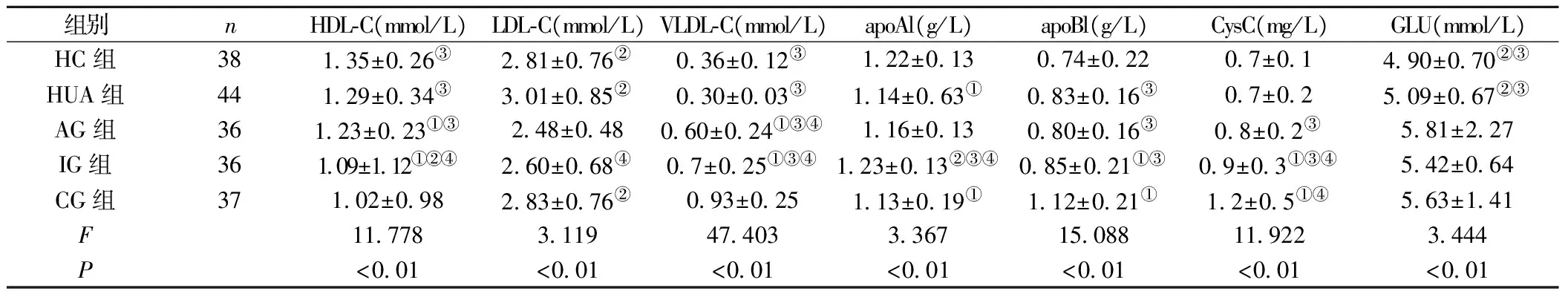
组别nHDL⁃C(mmol/L)LDL⁃C(mmol/L)VLDL⁃C(mmol/L)apoAl(g/L)apoBl(g/L)CysC(mg/L)GLU(mmol/L)HC组38135±026③281±076②036±012③122±013074±02207±01490±070②③HUA组44129±034③301±085②030±003③114±063①083±016③07±02509±067②③AG组36123±023①③248±048060±024①③④116±013080±016③08±02③581±227IG组36109±112①②④260±068④07±025①③④123±013②③④085±021①③09±03①③④542±064CG组37102±098283±076②093±025113±019①112±021①12±05①④563±141F11778311947403336715088119223444P<001<001<001<001<001<001<001
注:ESR:血沉,GR:中性粒细胞,LY:淋巴细胞,MO:单核细胞,HGB:血红蛋白,UA:血尿酸,ALT:谷丙转氨酶,AST:谷草转氨酶,HDL-C:高密度脂蛋白胆固醇,LDL-C:低密度脂蛋白胆固醇,VLDL-C:极低密度脂蛋白胆固醇,apoA1:载脂蛋白A1,apoB1:载脂蛋白B100,CysC:胱抑素,GLU:血糖。与HC组比较,①P<0.05;与AG组比较,②P<0.05;与CG组比较,③P<0.05;与HUA组比较,④P<0.05
2.2 血清E2变化与临床资料的相关性分析 HC组血清中E2水平显著高于HUA、AG、IG、CG组(P<0.05)。AG组E2水平低于HUA、IG、CG组(P<0.05)。IG组E2水平低于HUA组(P<0.05)。CG组与HUA组和IG组间比较差异均无统计学意义(均P>0.05)。Spearman相关分析发现HUA组E2水平与PLT、VLDL-C、apoB1呈正相关,与apoA1呈负相关,AG组E2水平与Crea呈正相关,CG组E2水平与UA呈正相关,见表3、表4。

表3 HC、HUA、AG、IG、CG组血清E2水平(M±Q)Table 3 Serum E2 levels in HC, HUA, AG, IG and CG groups
注:与HC组比较,①P<0.05;与AG组比较,②P<0.05;与IG组比较,③P<0.05
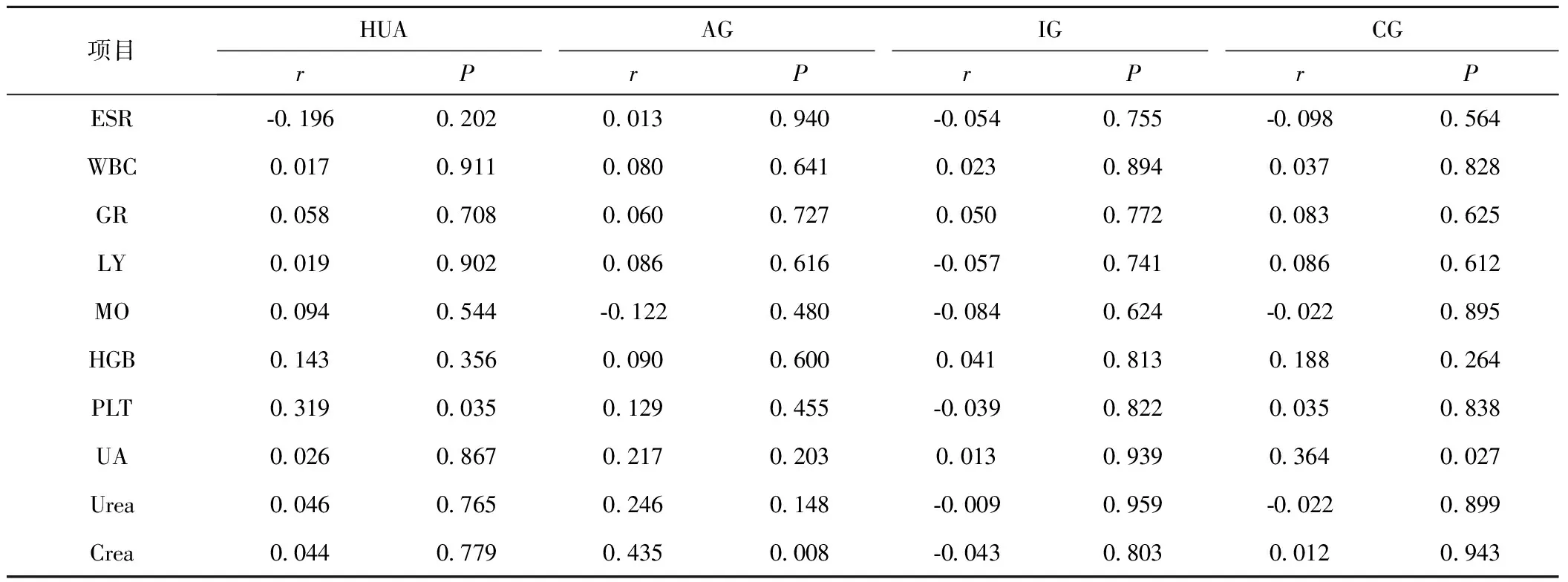
表4 HUA、AG、IG、CG组血清E2水平与临床资料相关性分析Table 4 Correlation analysis of serum E2 levels in HUA, AG, IG and CG groups with clinical data
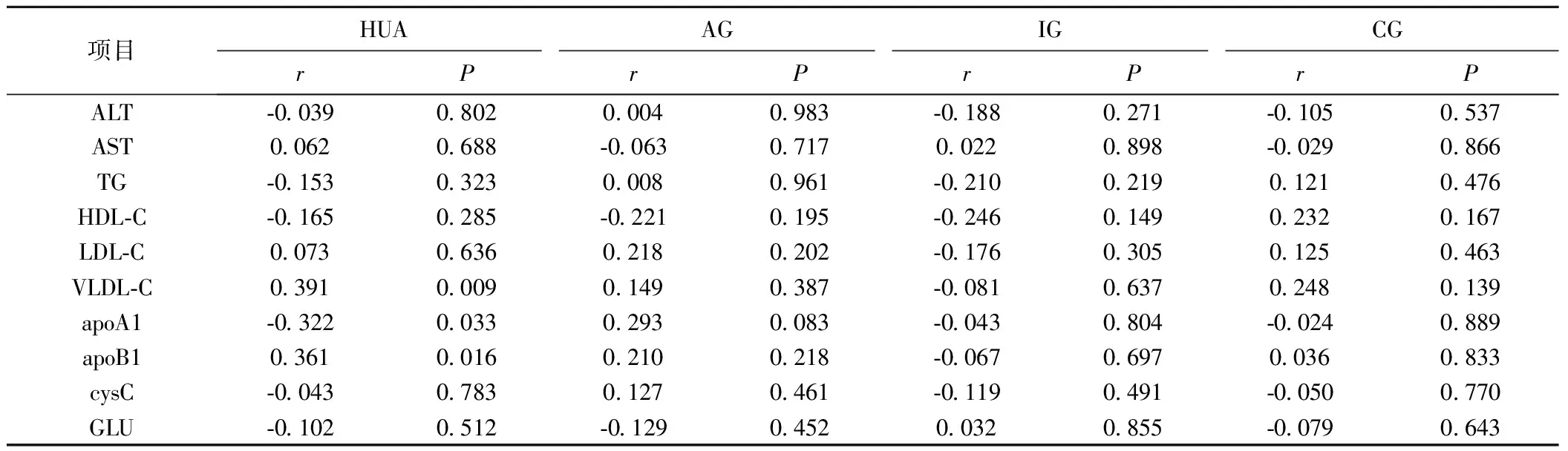
项目HUAAGIGCGrPrPrPrPALT⁃0039080200040983⁃01880271⁃01050537AST00620688⁃0063071700220898⁃00290866TG⁃0153032300080961⁃0210021901210476HDL⁃C⁃01650285⁃02210195⁃0246014902320167LDL⁃C0073063602180202⁃0176030501250463VLDL⁃C0391000901490387⁃0081063702480139apoA1⁃0322003302930083⁃00430804⁃00240889apoB10361001602100218⁃0067069700360833cysC⁃0043078301270461⁃01190491⁃00500770GLU⁃01020512⁃0129045200320855⁃00790643
2.3 PBMCs中ERβ mRNA的表达变化 在外周血中,HC组ERβ mRNA表达水平均高于AG、IG、CG组(均P<0.05)。HUA组ERβ mRNA表达水平均高于AG、IG、CG组(均P<0.05)。AG组ERβ mRNA表达水平低于IG组(均P<0.05)。CG组与AG组和IG组间比较差异无统计学意义(均P>0.05)。Spearman相关分析发现HC、HUA、AG、IG、CG组E2水平与ERβ mRNA水平间均无相关性(均P>0.05),见表5、表6。
表5HC、HUA、AG、IG、CG组PBMCs中ERβmRNA的表达水平(M±Q)
Table5ExpressionlevelofERβmRNAinPBMCsofgroupHC,HUA,AG,IGandCG
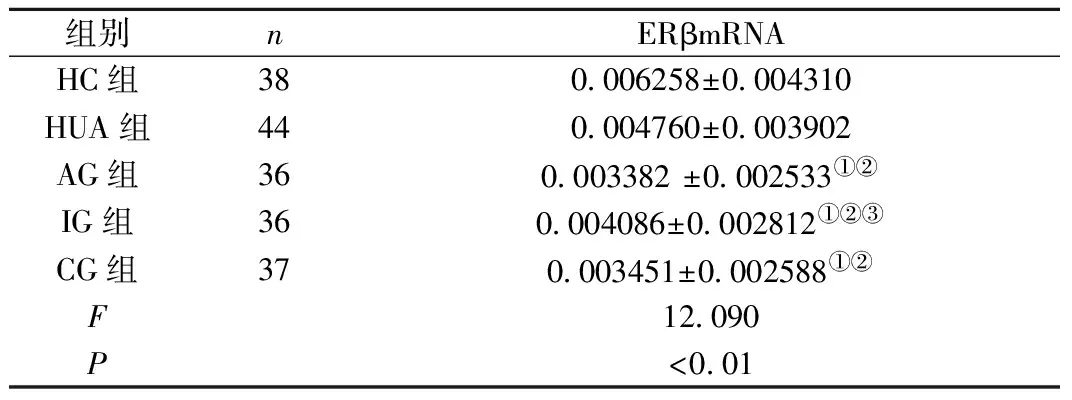
组别nERβmRNAHC组380006258±0004310HUA组440004760±0003902AG组360003382±0002533①②IG组360004086±0002812①②③CG组370003451±0002588①②F12090P<001
注:与HC组比较,①P<0.05;与HUA组比较,②P<0.05;与AG组比较,③P<0.05

表6 HC、HUA、AG、IG、CG组E2水平与ERβ mRNA水平相关性分析Table 6 Correlation analysis of E2 level with ERβ mRNA in HC, HUA, AG, IG and CG groups
3 讨论
近年来,在世界范围内痛风的发病率呈逐年升高的趋势,国内痛风的患病率为0.15%~0.67%[10-11]。我国痛风患者平均年龄为48.28岁(男性47.95岁,女性53.14岁),男:女为15:1,且随着生活习惯、饮食结构等的改变,女性患痛风比例呈上升趋势,且多发生于绝经后[12-14]。这与绝经后女性体内雌激素水平下降可能有关[15]。
雌激素是一类具有广泛生物活性的类固醇化合物,男性和绝经后的女性可以在一些非性腺的器官或组织以旁分泌或自分泌的形式合成雌激素并在局部发挥作用[16]。许多研究都提示雌激素能抑制细胞免疫和刺激体液免疫,在细胞核内,其主要调节基因转录和产生的蛋白质来确定性类固醇激素的细胞生物学行为[17]。雌激素受体(Estrogen receptor,ER)是属于甾体激素受体大家族中的核受体超家族成员,由17β-雌二醇激活,可介导雌激素发挥其生物学功能[18]。ERβ为其核受体之一,现已被证明了在多源卵巢颗粒细胞膜、肾、脑、骨、心、肺、肠粘膜、前列腺癌、内皮细胞表达[19-20]。动物实验研究发现,在兔的软骨细胞中E2可显著抑制IL-1β诱导的p65的DNA结合活性[21]。Hirano等[22]发现,在Jurkat细胞及外周血T淋巴细胞中,E2在生理性高浓度下可通过ERβ增强NF-κB及DNA的活性,抑制T细胞的凋亡。
研究发现,用雌激素替代疗法治疗绝经后合并高尿酸血症的女性,其尿酸水平下降,提示雌激素可能有促进尿酸排泄作用[22-23]。早在20世纪国外就有学者研究男女性痛风患者血浆性激素水平,发现痛风患者血浆E2水平显著低于健康体检者[24]。之后Mukhin等[25]研究发现男性痛风患者E2合成减少,可能是由于高尿酸血症调节下丘脑的激素分泌,导致促卵泡激素生成减少,进而限制了雌激素的生成。本研究结果显示HC组血清E2水平高于HUA组、痛风组(AG、IG、CG组),HUA组又高于AG、IG组,五组中AG组血清E2水平最低,CG组处于HUA组与IG组间,但差异无统计学意义。此研究结果与前面相关文献报道痛风患者E2水平低于正常人的结果是一致的。当细化痛风患者分组后我们发现,痛风患者在急性发作期时血清E2降低尤为明显,说明E2很可能参与了痛风的发生和发展过程。相关性分析发现,HUA组E2水平与PLT、VLDL-C、apoB1呈正相关,与apoA1呈负相关,AG组E2水平与Crea呈正相关,CG组E2水平与UA呈正相关。此结果表明,E2可能与体内脂蛋白、尿酸的水平和肾脏功能有关,但也可能是样本差异原因出现此结果,所以还需进一步扩大、分选样本来证实。本研究还显示,在外周血中,HC、HUA组ERβ mRNA表达水平均显著高于痛风组(AG、IG、CG组),AG组低于IG组,HC组与HUA组、CG组与AG组和IG组间比较差异无统计学意义(均P>0.05)。此结果与其血浆中各组E2表达水平基本吻合。但相关分析发现HC、HUA、AG、IG、CG组E2水平与ERβ mRNA表达水平间均无相关性(均P>0.05)。说明在痛风患者中E2及其受体ERβ的表达水平均是降低的,而在急性发作期降低尤为明显,提示雌激素及其受体ERβ可能参与了痛风的发生发展,但具体作用机制还有待进一步深入研究。
4 结论
本文研究结果显示,痛风患者雌激素及其受体ERβ表达水平降低,提示其可能参与了痛风性关节炎的发生发展;其有望为痛风性关节炎的临床诊断、治疗与预防提供新途径。
【参考文献】
[1]Krishnan E, Akhras KS, Sharma H,etal. Relative and attributable diabetes risk associated with hyperuricemia in US veterans with gout [J]. QJM, 2013, 106(8): 721-729.
[2]Hainer BL, Matheson E, Wilkes RT. Diagnosis, treatment and prevention of gout [J]. Am Fam Physician, 2014, 90(12) :831-836.
[3]Hak AE, Choi HK. Menopause, postmenopausal hormone use and serum uric acid levels in US Women-the Third National Health and Nutrition Examination Survey[J]. Arthritis Res Ther, 2008, 10(5): R116.
[4]De Souza AW, Fernandes V, Ferrari AJ. Female gout:clinical and laboratory features[J]. Rheumatol, 2005, 32(11): 2186-2188.
[5]Hak AE, Curha n GC, Grodstein F,etal. Menopause, postmenopausal hormone use and risk of in cident gout[J]. AnnRheumDis, 2010, 69( 7) : 1305-1309.
[6]Tsai EC, Boyko EJ, Leonetti DL, et a1, Low sernnl testosterone level as a predictor of increased visceral fat in Japanese-American men [J]. Int J Obes Relat Metab Disord, 2000, 24(4):485-491.
[7]Wallace SL, Robinson H, Masi AT,etal. Preliminary criteria for the classification of the acute arthritis of primary gout [J]. Arthritis Rheum, 1977, 20(3): 895-900.
[8]Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method [J]. Nat Protoc, 2008, 3(6): 1101-1108.
[9]Elgar G, Vavouri T. Tuning in to the signals: noncoding sequence conservation in vertebrate genomes [J]. Trends Genet, 2008, 24(7): 344-352.
[10] Weaver AL. Epidemiology of gout [J]. Cleve Clin J Med, 2008, 75(5): S9-12.
[11] Lee SJ, Hirsch JD, Terkeltaub R,etal. Perceptions of disease and health-related quality of life among patients with gout[J]. Rheumatology (Oxford), 2009, 48(5): 582-586.
[12] Wallace KL, Riedel AA, Joseph-ridge N,etal. Increasing prevalence of gout and hyperuricemi over 10 years among older adults in a managed care population[J]. Jrheu-matol, 2004, 31(8): 1582-1587.
[13] Chiou W K, Wang M H, Huangd H,etal. The relationship between serum uric acid level and metabolic syndrome: differences by sex and age in Taiwanese [J]. Journal of Epidemiology, 2010, 20(3): 219-224.
[14] Jansen Dirken-Heukensfeldt KJM, Teunissen TAM, Van de Lisdonk EH,etal. Clinical features of women with gout arthritis: a systematic review [J]. Clinical Rheumatology, 2010, 29(6): 575-582.
[15] Suminoh H, Ichikawa, S, Kanda T,etal. Reduction of serum uric acid by hormone replacement therapy in postmenopausal women with hyperuricaemia[J]. LANCET, 1999, 345(9179): 650-652.
[16] Simpson ER. Sources of estrogen and their importance[J]. Journal of Steroid Biochemistry and Molecular Biology, 2003, 86: 225-230.
[17] Levin ER. Integration of the extranuclear and nuclear actions of estrogen[J]. Molecular Endocrinology, 2005, 19(8): 1951-1959.
[18] Dahlman-Wright K, Cavailles V, Fuqua SA,etal. International Union of Pharmacology. LXIV. Estrogen receptors[J]. Pharmacol Rev, 2006, 58(4): 773-781.
[19] Babiker FA, De Windt LJ, van EickelsM,etal. Estrogenic hormone action in the heart: regulatory network and function[J]. Cardiovascular Research, 2002, 53(3): 709-719.
[20] Younes M, Honma N. Estrogen receptorβ[J]. Arch Pathol Lab Med, 2011, 135(1): 63-66.
[21] Richette P, Dumontier MF, Tahiri K,etal. Oestrogens inhibit interleukin 1beta-mediated nitric oxide synthase expression in articular chondrecytes through nuclear factor-kappa B impairment[J]. Ann Rheum Dis, 2007, 66(3): 345-350.
[22] Hirano S, Furutama D, Hanafusa T. Physiologically high concentrations of 17beta-estradiol enhance NF-kappaB activity in human T cells[J]. Am J Physiol Regnl Integr Comp Physiol, 2007, 292(4): R1465-1471.
[23] Mikuls T R, Farrar J T, Bilker W B,etal. gout epidemiology: results from the UK general Practice Research Database, 1990-1999[J]. Ann Rheum Dis, 2005, 64(2): 267-272.
[24] Enrico M, Giuseppe RS, Roberto M,etal. Plasma follicle-stimulating hormone, luteinizing hormone, and sex hormones in patients with gout[J]. Arthritis and Rheumatology, 1985, 28(2): 127-131.
[25] Mukhin IV, Ignatenko GA, Nikolenko VY. Dyshormonal disorders in gout: experimental and clinical studies[J]. Bull ExpBiolMed, 2002, 133(4): 493-591.
