再生障碍性贫血患者骨髓CD106+间充质干细胞对其骨髓血管衰竭的作用
2018-05-03卢士红葛美丽郑以州杨少光尤亚红韩忠朝
卢士红,葛美丽,郑以州,杨少光,陈 芳,尤亚红,韩忠朝
中国医学科学院 北京协和医学院 血液病医院 血液学研究所国家重点实验室,天津 300020
ActaAcadMedSin,2018,40(2):178-186
骨髓来源的间充质干细胞(mesenchymal stem cells,MSCs)是构成骨髓微环境的重要细胞,其主要发挥构成造血干细胞(hematopoietic stem cell,HSC)龛支持造血及免疫调节等作用[1- 2]。骨髓中HSC赖以生存的干细胞龛由多种间充质干细胞与内皮细胞和成骨细胞构成的血管龛和成骨龛组成[3- 5],血管龛调控HSC的增殖、分化和动员等行为。所以MSCs被认为在调控HSC命运中发挥重要作用[6- 8]。间充质干细胞已经应用在多方面的临床治疗,如在脊髓损伤、骨损伤、糖尿病肾病和卵巢早衰以及体内构建组织工程软骨[9- 10]。也有报道骨髓中MSCs是内皮细胞和骨细胞的前体细胞[11- 12]。已有研究显示人骨髓间充质干细胞向血管内皮细胞的诱导分化,这为间充质干细胞在组织工程血管化及细胞移植修复损伤中的应用提供了理论与技术上的支持,为复杂器官组织工程血管化及细胞移植修复损伤组织提供理想细胞来源[13]。然而,不同的MSCs亚群对造血干细胞发挥着不同的作用[14- 15]。而再生障碍性贫血(aplastic anemia,AA)作为一种异质性疾病,是由多种原因引起的骨髓造血功能衰竭,其骨髓血管衰竭[16]临床上呈全血细胞减少的一组综合病征。目前AA患者骨髓血管衰竭的原因仍不清楚,鉴于国内外均有文献报道AA患者骨髓MSCs存在异常,其成脂能力增强、成骨能力减弱、支持造血能力减弱[16- 17],但其中的骨髓间充质干细胞形成的血管龛是否存在缺陷,目前尚未见报道。黏附分子(adhesion molecule,AM)是介导细胞与细胞间或细胞与基质间相互接触和结合的一类分子的统称。CD106抗原,即血管细胞黏附分子- 1(vascular cell adhesion molecule- 1,VCAM- 1)属于黏附分子,为具有多种生物活性的跨膜蛋白,是内皮细胞标志性分子。因此,为了探讨AA患者MSCs(AA MSCs)形成血管的能力及受影响的因素,本研究比较AA MSCs血管形成能力,以及造成缺陷的至关因素(CD106表达及其表达高低与MSCs形成内皮及管状形成的能力)。
材料和方法
材料胎牛血清(fetal bovine serum,FBS)、胰岛素-转铁蛋白-硒、DF12培养基均购自美国Gibco公司;地塞米松购自美国Sigma 公司;碱性成纤维细胞生长因子、表皮细胞生长因子(epidermal growth factor,EGF)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)均购自美国Pepertch公司;CD105-FITC、CD106-PE、CD31-FITC抗体购自美国BD Pharmingen公司;中性CD106抗体购自英国Abcam公司;肌动蛋白-F抗体购自美国Invitrogen公司;基质胶购自美国BD公司。
MSCs的获取与鉴定选取中国医学科学院血液病医院无菌慢性AA患者28例和正常人对照18例骨髓(标本均获得中国医学科学院和血液病医院医疗与安全伦理委员会批准:伦理批准文件编号KT2014005-EC- 1,所有患者均同意本研究使用其相关标本),接种到T- 25培养瓶中,加入含有2%FBS的DF12/MCDB201培养基,含10 ng/ml碱性成纤维细胞生长因子,25 ng/ml EGF,1/100胰岛素-转铁蛋白-硒,10-6mol/L地塞米松。2 d后换液,待贴壁细胞长至90%融合后传代培养;将传至P4 代的MSCs通过0.05%的胰酶消化收集,将部分细胞接种至共聚焦皿中,部分细胞用PBS 悬浮细胞,并分别将与CD13-PE、CD29-PE、CD73-PE、CD166-PE、CD34-PE、CD45-PE的相应抗体4℃孵育,用PBS 洗涤细胞,用1%多聚甲醛固定细胞,流式细胞术检测。将共聚焦皿中长至70%~80%融合的正常人 MSCs、AA MSCs甲醇固定,用1%胎牛血清封闭,分别加入抗人CD13-PE、CD29-PE、CD73-PE、CD166-PE、CD34-PE、CD45-PE的单克隆抗体,避光孵育,用PBS 洗涤细胞,加入1∶100 肌动蛋白-F孵育,标记Oregon Green®488鬼笔环肽染料,加4’,6-二脒基- 2-苯基吲哚二盐酸盐(4’,6-diamidino- 2-phenylindole,DAPI)染核,用2%多聚甲醛固定细胞,扫描共聚焦检测照相。
MSCs基因测序将P4代的AA MSCs、正常人 MSCs通过胰酶消化、收集,加RNA提取试剂(TRIzol)处理,然后将合并足够量AA MSCs、正常人MSCs的处理后的总RNA样本提供给基因测序公司进行高通量测序。样品提取总RNA后,总RNA加热打开二级结构后用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入适量打断试剂高温条件下使其片断化,再以片断后的mRNA为模板,合成cDNA,经过磁珠纯化、末端修复、3’末端加碱基A、加测序接头后,进行PCR扩增,从而完成整个文库制备工作。构建好的文库用Agilent2100生物分析仪和ABI 实时定量PCR 系统进行质量和产量检测,文库质控合格后使用Illumina HiSeqTM 2000进行测序。测序结束后,扩大样本用ABI 实时定量 PCR 系统 7500型PCR仪验证血管细胞黏附分子- 1(vascular cell adhesion molecule- 1,VCAM1)基因结果。
AAMSCs与正常人MSCs中CD106+细胞含量的测定取AA患者与正常人骨髓P4代MSCs,通过胰酶消化收集,用PBS 悬浮调整细胞密度到(1.0~5.0)×105个/ml,将细胞标记抗人PE-CD106抗体,流式细胞仪检测MSCs中CD106+细胞含量。
CD106+MSCs在新鲜骨髓AAMSCs与正常人MSCs中含量的测定为了测定在新鲜骨髓MSCs中CD106+MSCs含量,以CD105+细胞作为新鲜骨髓中的MSCs。取无菌正常对照和AA患者检查后剩余骨髓100 μl,同时双标记CD105-FITC和CD106-PE,低渗破除红细胞、固定,然后流式细胞仪测定CD105+CD106+MSCs含量。
AAMSCs与正常人MSCs诱导成CD31+内皮细胞分别将正常人与AA患者骨髓MSCs以5×104个细胞接种到6孔板中,贴壁后换成内皮细胞诱导液,诱导液含有100 ng/ml VEGF、50 ng/ml EGF、5×10-5mol/L地塞米松、100 U肝素钠、1%双抗、5% FBS,7 d时消化细胞,以3×104个接种到33 mm共聚焦皿中,贴壁后,4%甲醛固定,然后原位标记鼠抗人FITC-CD31抗体,用DAPI染细胞核,共聚焦显微镜扫描照相。
CD106被封闭后,正常人MSCs被诱导成CD31+细胞的能力变化消化培养P4代的正常人 MSCs,实验分为对照组、正常阻断组。正常阻断组细胞与500 ng/ml CD106中和抗体(ab47159)在4℃冰箱中预孵育1 h。离心收集细胞,用内皮细胞诱导液悬浮细胞,以5×104个细胞接种到6孔板中。诱导液含有100 ng/ml VEGF、50 ng/ml EGF、5×10-5mol/L地塞米松、100 U肝素钠、1%双抗、5% FBS,14 d时消化细胞,以3×104个接种到33 mm共聚焦皿中,贴壁后,4%甲醛固定,然后原位标记兔抗人CD31抗体,加山羊抗兔IgG(Alexa Fluor®488)二抗,用DAPI染细胞核,2%多聚甲醛固定,共聚焦显微镜扫描照相。
CD106被封闭后,正常人MSCs细胞管状形成能力的变化将基质胶在冰浴中融化,用冷移液器枪头吸取50 μl基质胶(BD 354234)加入到冷96孔板底部,然后37℃静置处理30 min,待用。消化正常人 MSCs,实验分为正常对照组、正常阻断组。正常阻断组细胞为与500 ng/ml CD106中和抗体(ab47159)在4℃冰箱中预孵育1 h。再分别将正常对照组与正常阻断组的MSCs 3×104个细胞悬浮在含有20 ng/ml VEGF 的2%FBS IMDM培养基中,分别取100 μl细胞悬液接种在预先用基质胶包被的96孔培养板中,在37℃ 5% CO2孵箱培养,每2小时用显微镜观察1次并照相,通过Image J软件测量小管长度[18- 19]。
统计学处理通过方差分析确定显著的差异。显著性差异分析使用GraphPad Prism 6.0软件(GraphPad,La Jolla,CA,USA)[16,19- 20]进行。P<0.05为差异有统计学意义。
结 果
MSCs的鉴定流式细胞仪检测及细胞免疫组织化学方法鉴定均得出MSCs 表面高表达CD13、CD29、CD73、CD166,而不表达CD34、CD45(图1)。
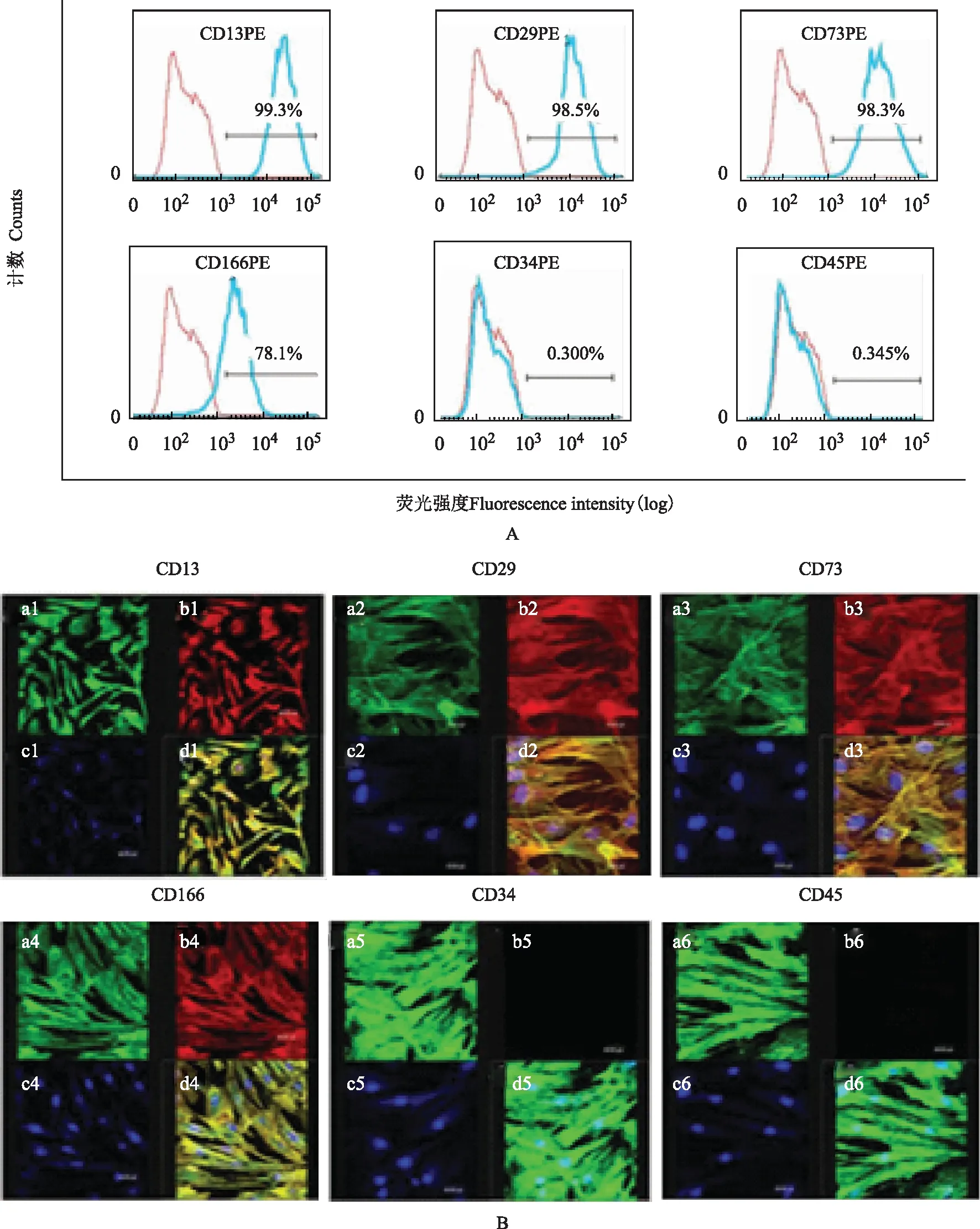
MSCs:间充质干细胞;DAPI:4’,6-二脒基- 2-苯基吲哚
MSCs:mesenchymal stem cells;DAPI:4’,6-diamidino- 2-phenylindole
A.流式法鉴定MSCs;B.免疫荧光标记方法标记CD13、CD29、CD73、CD166、CD34、CD45[ a1~a6:肌动蛋白F(绿色);b1~b6:分别为间充质干细胞表面标志CD13、CD29、CD73、CD166、CD34、CD45(红色);c1~c6:DAPI(蓝色);d1~d6:均为对应的合并图]
A.evaluating MSCs by fluorescence-activated cell sorting;B.identification of surface markers including CD13,CD29,CD73,CD166,CD34,and CD45 by immunofluorescence labeling [a1-a6:F-actin(green);b1-b6:the surface markers including CD13,CD29,CD73,CD166,CD34,and CD45(red),respectively;c1-c6:DAPI(blue);d1-d6:the corresponding merge]
图1MSCs流式及免疫荧光法的鉴定
Fig1Identification of MSCs by fluorescence-activated cell sorting and immunohistochemical staining technique
AAMSCs与正常人MSCs细胞的基因表达全基因测序结果显示:AA MSCs与正常人MSCs相比有多个基因发生显著性变化,其中上调基因768个,下调基因910个。与造血、成血管、成骨和成脂等相关多个显著性差异基因中AA MSCs组VCAM1(CD106)基因表达量与正常人MSCs组VCAM1(CD106)基因表达量相比显著降低,降低12.13倍(图2A)。实时定量PCR验证正常人MSCs CD106基因表达量与AA MSCs CD106基因表达量,结果显示正常人MSCs CD106 mRNA含量为1.000±0.000(n=4),而AA MSCs细胞中CD106 mRNA含量为0.020±0.004(n=4)(P=0.000)(图2B)。
正常人MSCs、AAMSCs细胞中CD106+细胞亚群的含量取AA患者与正常人骨髓第4代MSCs,标记抗人PE-CD106 抗体,流式细胞仪检测CD106+MSCs细胞含量,结果显示AA CD106+MSCs细胞含量为(28.03±17.71)%,正常人 CD106+MSCs细胞含量为(59.61±12.26)%,AA患者骨髓CD106+MSCs细胞含量显著低于正常人CD106+MSCs细胞含量(t=6.719,P=0.000)(图3)。
CD105+CD106+MSCs在新鲜正常人、AA骨髓中的含量在新鲜骨髓中,将CD106和CD105的共同表达作为骨髓MSCs中CD106+MSCs的标记。流式细胞仪检测CD105+CD106+MSCs在新鲜AA骨髓中CD106+MSCs含量为(0.33±0.10)%,较在新鲜正常人骨髓中CD106+MSCs的含量(2.98±0.46)%显著降低(t=5.612,P=0.0005)(图4)。
诱导AAMSCs及正常人MSCs成CD31+内皮细胞将诱导的正常人与AA患者骨髓MSCs细胞7 d时原位标记鼠抗人FITC-CD31抗体,用DAPI染细胞核,共聚焦显微镜扫描观察照相,结果显示正常人 MSCs组比AA MSCs更容易诱导成有内皮细胞(CD31)标志的细胞,7 d时正常人 MSCs组CD31+细胞占(43.24±0.96)%,AA MSCs组CD31+细胞占(13.67±1.50)%(t=11.14,P=0.0004)(图5)。
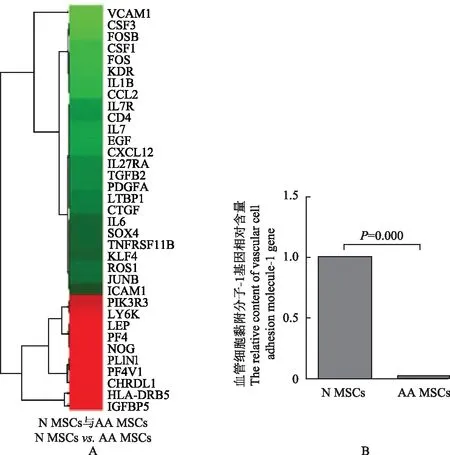
AA:再生障碍性贫血;N:正常人
AA:aplastic anemia;N:normal
A.基因测序方法的AA MSCs 与N MSCs比较的差异基因聚类图(红色为上调基因,绿色为下调基因);B.实时定量PCR方法验证AA MSCs 与N MSCs 血管细胞黏附分子-1(CD106)基因表达变化
A.a clustering dendrogram was constructed according to the gene sequencing results of AA MSCs and N MSCs(the red indicates the up-regulated genes,and the green shows the down-regulated ones);B.the real-time polymerase chain reaction was used for the verification of vascular cell adhesion molecule- 1(CD106) gene expression in AA MSCs and N MSCs
图2AA MSCs 与N MSCs的基因表达比较
Fig2Comparison of the gene expression of AA MSCs and N MSCs
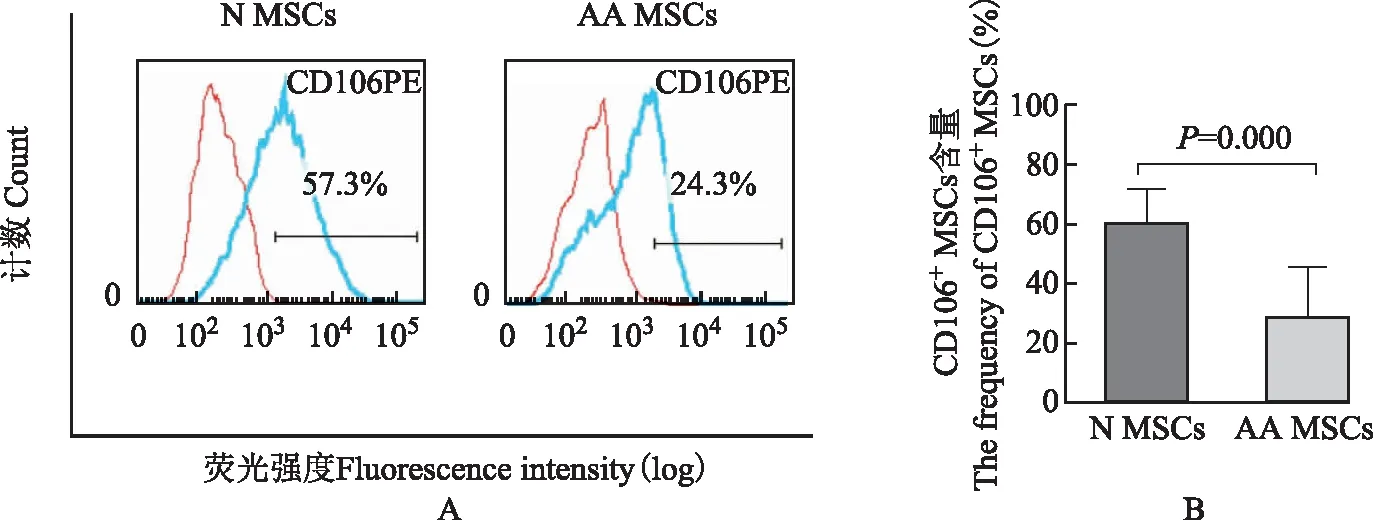
A.流式测定N MSCs、AA MSCs中CD106+MSCs的含量;B.比较AA MSCs、N MSCs 中CD106+MSCs的含量图
A.the levels of CD106+MSCs in N MSCs and AA MSCs were measured by fluorescence-activated cell sorting;B.the levels of CD106+MSCs in N MSCs and AA MSCs was compared
图3CD106+MSCs亚群在N MSCs、AA MSCs中的含量
Fig3Contents of CD106+MSCs in AA MSCs and N MSCs
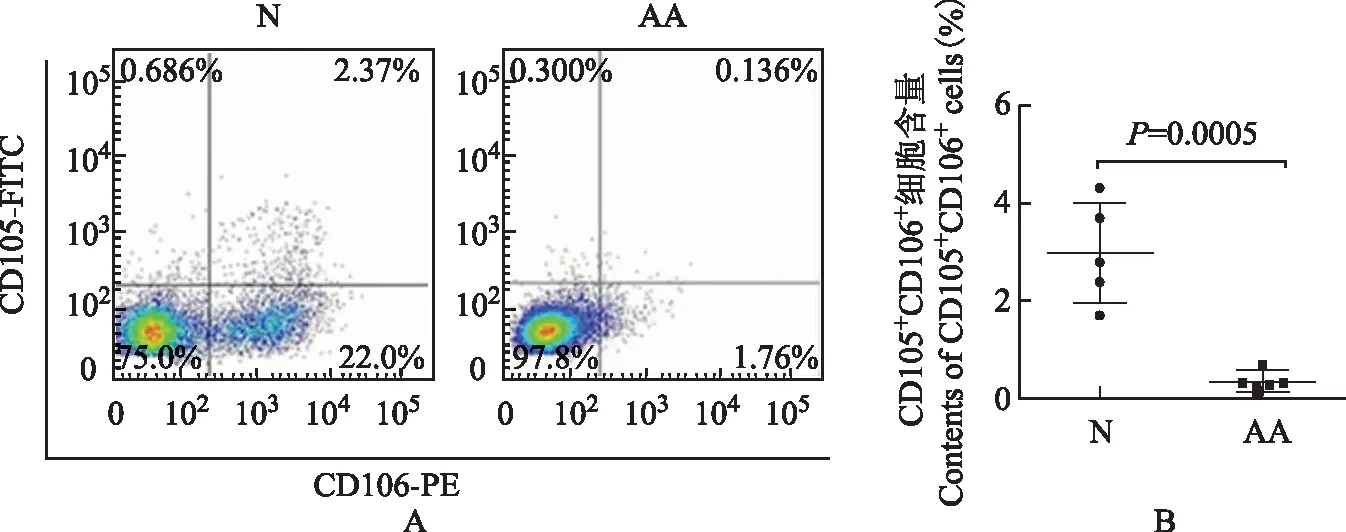
A.流式测定在N、AA新鲜骨髓MSCs中CD106+MSCs的含量;B.比较新鲜骨髓AA MSCs、N MSCs 中 CD106+MSCs的含量
A.the content of CD106+MSCs in N and AA fresh bone marrow MSCs was measured by fluorescence-activated cell sorting;B.the contents of CD106+MSCs in fresh bone marrow of N MSCs and AA MSCs were compared
图4CD106+MSCs亚群在新鲜骨髓N MSCs、AA MSCs中的含量
Fig4The contents of CD106+MSCs in fresh bone marrow of AA MSCs and N MSCs
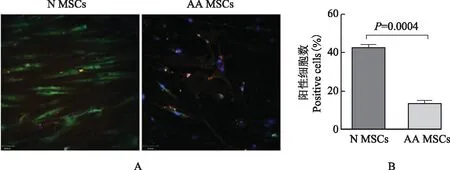
A.共聚焦检测AA MSCs及N MSCs成内皮CD31+细胞;B.被诱导成CD31+细胞在AA MSCs及N MSCs 中所占比例
A.CD31+endothelial cells were detected by confocal microscopy;B.the proportion of CD31+cells induced from N MSCs and AA MSCs
图5AA MSCs及N MSCs被诱导成CD31+内皮细胞
Fig5The MSCs from AA MSCs and N MSCs were induced into CD31+endothelial cellsinvitro
CD106分子被封闭后,诱导MSCs成CD31+细胞被封闭的正常人阻断组细胞被诱导形成CD31+细胞能力显著降低,14 d时对照组CD31+细胞为(91.78±2.44)%(n=3),正常人 阻断组CD31+细胞为(26.00±2.65)%(n=3)(t=18.29,P=0.000)(图6)。
CD106分子被封闭后,诱导正常人MSCs细胞成管状形成能力被封闭的正常人阻断组细胞接种到基质胶中,MSCs管状形成能力显著降低,而且出现的环状结构不完整,显微镜照相,通过Image J软件测量小管长度,管状结构形成能力对照组为(68.12±6.781)mm,阻断CD106组为(13.81±1.979)mm(t=7.688,P=0.0015)(图7)。
讨 论
AA是一组由多种病因所致的骨髓造血功能衰竭性综合征,以骨髓造血细胞增生减低和外周血全血细胞减少为特征,临床以贫血、出血和感染为主要表现。尽管已知某些病毒、药物、化学物质及电离辐射等与AA的发病有关,但其确切发病机制迄今仍未完全明了。目前认为,异常免疫、HSC缺陷和造血微环境支持功能低下为AA病理机制的3个重要环节。
关于AA造血微环境的研究近年有较大进展,国内外均有文献报道AA患者骨髓中血管衰竭[13]。亦有文献报道AA患者MSCs存在异常,其成脂能力增强、成骨能力减弱[17],但其形成骨髓血管龛的能力如何报道较少。本研究显示扩增培养的AA MSCs比正常人 MSCs在体外被诱导成内皮细胞的能力也明显减弱,表明AA MSCs细胞比正常人骨髓中MSCs细胞更难生成血管;全基因测序显示AA MSCs中VCAM1(CD106)基因表达显著降低,流式检测显示AA患者骨髓体外培养的MSCs缺失CD106+细胞亚群,进一步研究显示,抽取新鲜骨髓后流式检测CD105+CD106+MSCs含量,AA患者较正常人明显降低,均表明CD106+MSCs在形成骨髓血管龛中发挥了重要作用。为进一步证实此结论,本研究利用中和抗体阻断正常MSCs的CD106分子,然后诱导成内皮细胞,研究表明阻断CD106分子后的正常MSCs被诱导成内皮和形成管状结构能力都明显降低,进一步表明CD106+MSCs细胞群是骨髓干细胞血管龛中重要的细胞成分。
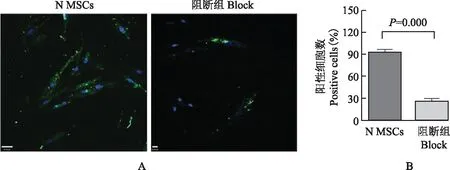
A.共聚焦检测N MSCs和阻断CD106后的N MSCs诱导成的内皮CD31+细胞;B.被诱导成CD31+细胞在对照组和阻断组中所占比例
A.detection of CD31+endothelial cells differentiation from N MSCs and CD106-blocking N MSCs by confocal microscopy;B.the proportion of CD31+cells induced in N MSCs group and N block group
图6N MSCs及阻断血管细胞黏附分子-1(CD106)抗原后的N MSCs诱导形成的CD31+细胞
Fig6The CD31+cell differentiation from N MSCs and vascular cell adhesion molecule- 1(CD106)-blocking N MSCs
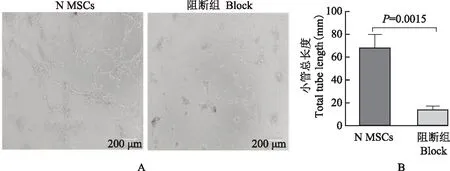
A.显微镜照相N MSCs及N MSCs-阻断组形成管状结构图;B.正常对照组及正常阻断组形成管状结构小管长度
A.the tubular structures formation from N MSCs group and N block group by photomicrography;B.the total tube length of tubular structures in N MSCs group and N block group
图7在基质胶中N MSCs及N MSCs-CD106阻断形成管状结构的比较
Fig7The tubular structures formation in N MSCs group and N block group
CD106是能介导细胞与细胞、细胞与细胞外基质相互接触和结合的一类分子,是内皮细胞标志性分子,为具有多种生物活性的跨膜蛋白。在骨髓中造血干细胞和间充质干细胞之间的相互作用通过α4β1(VLA4)/VCAM1(CD106)交互作用介导[21- 26]。其中HSC与间质细胞以及HSC与干细胞龛之间附着力的交互作用在调控HSC的命运中被认为发挥着重要的作用[8,24]。另外,有CD106缺陷的小鼠胚胎是不能成活的,其一半的胚胎在胚胎期的第11天前死亡,并在胎盘发育过程中表现出严重的缺陷,剩下的胚胎存活到胚胎期的11.5~12 d,并且在心脏发育过程中出现了异常[27]。粒细胞集落刺激因子动员干细胞也是通过CD106和CXCL12的表达减少,得以对HSC的动员[28]。所以更加说明CD106+MSCs细胞亚群是骨髓干细胞龛中重要细胞。
本研究显示AA新鲜骨髓CD105+CD106+MSCs含量较正常人显著降低,其体外培养后CD106+MSC含量显著降低,形成内皮细胞及血管能力下降,进一步阻断CD106抗原后,形成内皮及血管能力显著下降,表明CD106与血管形成密切相关。
综上,AA患者骨髓MSCs CD106基因表达缺失、CD106+MSCs含量降低,致使被诱导成血管内皮细胞的能力明显迟缓,如将MSCs封闭CD106抗原后,其被诱导成CD31+细胞能力及管状结构形成能力显著降低,可能促进患者的骨髓血管衰竭。
[1] Winkler IG,Sims NA,Pettit AR,et al. Bone marrow macrophages maintain hematopoietic stem cell(HSC) niches and their depletion mobilizes HSCs [J]. Blood,2010,116(23):4815- 4828. DOI:10. 1182/blood- 2009- 11- 253534.
[2] Christopher MJ,Rao M,Liu F,et al. Expression of the G-CSF receptor in monocytic cells is sufficient to mediate hematopoietic progen it or mobilization by G-CSF in mice [J]. J Exp Med,2011,208(2):251- 260. DOI:10. 1084/jem. 20101700.
[3] Mendez-Ferrer S,Michurina TV,Ferraro F,et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche [J]. Nature,2010,466(7038):829- 834. DOI:10. 1038/nature09262.
[4] Lv FJ,Tuan RS,Cheung KM,et al. Concise review:the surface markers and identity of human mesenchymal stem cells [J]. Stem Cells,2014,32(6):1408- 1419. DOI:10. 1002/stem. 1681.
[5] Morikawa S,Mabuchi Y,Kubota Y,et al. Prospective identification,isolation,and systemic transplantation of multipotent mesenchymal stem cells in murine bone marrow [J]. J Exp Med,2009,206(11):2483- 2496. DOI:10. 1084/jem. 20091046.
[6] van Pel M,Fibbe WE,Schepers K. The human and murine hematopoietic stem cell niches:are they comparable ? [J]. Ann N Y Acad Sci,2016,1370(1):55- 64. DOI:10. 1111/nyas. 12994.
[7] Kfoury Y,Scadden DT. Mesenchymal cell contributions to the stem cell niche [J]. Cell Stem Cell,2015,16(3):239- 253. DOI:10. 1016/j. stem. 2015. 02. 019.
[8] Frenette PS,Pinho S,Lucas D,et al. Mesenchymal stem cell:keystone of the hematopoietic stem cell niche and a stepping-stone for regenerative medicine [J]. Annu Rev Immunol,2013,31:285- 316. DOI:10. 1146/annurev-immunol- 032712- 095919.
[9] 朱少芳,何援利,付霞霏. 人脐带间充质干细胞的生物学特性和超微结构[J]. 中国医学科学院学报,2011,33(4):382- 386. DOI:10. 3881/j. issn. 1000- 503X. 2011. 04. 007.
[10] 葛薇,姜文学,李长虹,等. 负载转化生长因子β1的生物蛋白胶促进骨髓间充质干细胞体内构建组织工程软骨[J]. 中国医学科学院学报,2005,27(6):692- 695.
[11] Pittenger MF,Mackay AM,Beck SC,et al. Multilineage potential of adult human mesenchymal stem cells [J]. Science,1999,284(5411):143- 147. DOI:10. 1126/science. 284. 5411. 143.
[12] Wei X,Liu C,Wang H,et al. Surface phosphatidylserine is responsible for the internalization on microvesicles derived from hypoxia-induced human bone marrow mesenchymal stem cells into human endothelial cells [J]. PLoS One,2016,11(1):e0147360. DOI:10. 1371/journal. pone. 0147360. eCollection 2016.
[13] 梁峰,王韫芳,南雪,等. 体外诱导人骨髓间充质干细胞定向血管内皮细胞分化[J]. 中国医学科学院学报,2005,27(6):665- 669.
[14] Matsuoka Y,Nakatsuka R,Sumide K,et al. Prospectively isolated human bone marrow cell-derived MSCs support primitive human CD34-negative hematopoietic stem cells [J]. Stem Cells,2015,33(5):1554-1565. DOI:10. 1002/stem. 1941.
[15] Chow A,Lucas D,Hidalgo A,et al. Bone marrow CD169+macrophages promote the retention of hematopoietic stem and progenitor cells in the mesenchymal stem cell niche [J]. J Exp Med,2011,208(2):261- 271. DOI:10. 1084/jem. 20101688.
[16] Lu S,Ge M,Zheng Y,et al. CD106 is a novel mediator of bone marrow mesenchymal stem cells via NF-κB in the bone marrow failure of acquired aplastic anemia [J]. Stem Cell Res Ther,2017,8(1):178. DOI:10. 1186/s13287- 017- 0620- 4.
[17] Li J,Lu S,Yang S,et al. Impaired immunomodulatory ability of bone marrow mesenchymal stem cells on CD4+T cells in aplastic anemia [J]. Results Immunol,2012,2:142- 147. DOI:10. 1016/j. rinim. 2012. 07. 002.
[18] Iqbal F,Szaraz P,Librach M,et al. Angiogenic potency evaluation of cell therapy candidates by a novel application of theinvitroaortic ring assay [J]. Stem Cell Res Ther,2017,8(1):184. DOI:10. 1186/s13287- 017- 0631- 1.
[19] Schneider CA,Rasband WS,Eliceiri KW. NIH Image to ImageJ:25 years of image analysis [J]. Nat Methods,2012,9(7):671- 675.
[20] Cheng H,Hao S,Liu Y,et al. Leukemic marrow infiltration reveals a novel role for Egr3 as a potent inhibitor of normal hematopoietic stem cell proliferation [J]. Blood,2015,126(11):1302- 1313. DOI:10. 1182/blood- 2015- 01- 623645.
[21] Papayannopoulou T. Current mechanistic scenarios in hematopoietic stem/progenitor cell mobilization [J]. Blood,2004,103(5):1580- 1585. DOI:10. 1182/blood- 2003- 05- 1595.
[22] Hu Y,Davison F,Zhang Z,et al. Endothelial replacement and angiogenesis in arteriosclerotic lesions of allografts are contributed by circulating progenitor cells [J]. Circulation,2003,108(25):3122- 3127. DOI:10. 1161/01. CIR. 0000105722. 96112. 67.
[23] Scott L,Priestley G,Papayannopoulou T. Deletion of α4-integrins from adult hematopoietic cells reveals roles in homeostasis,regeneration and homing [J]. Mol Cell Biol,2003,23(24):9349- 9360. DOI:10. 1128/MCB. 23. 24. 9349- 9360. 2003.
[24] Valenzuela-Fernandez A,Planchenault T,Baleux F,et al. Leukocyte elastase negatively regulates stromal cell-derived factor- 1(SDF- 1)/CXCR4 binding and functions by amino-terminal processing of SDF- 1 and CXCR4 [J]. J Biol Chem,2002,277(18):15677- 15689. DOI:10. 1074/jbc. M111388200.
[25] Kimura T,Asada R,Wang J,et al. Identification of long-term repopulating potential of human cord blood-derived CD34-flt3- severe combined immunodeficiency-repopulating cells by intra-bone marrow injection [J]. Stem Cells,2007,25(6):1348- 1355. DOI:10. 1634/stemcells. 2006- 0727.
[26] Jacobsen RN,Forristal CE,Raggatt LJ,et al. Mobilization with granulocyte colony-stimulating factor blocks medullar erythropoiesis by depleting F4/80pVCAM1pCD169pER-HR3pLy6Gp erythroid island macrophages in the mouse [J]. Exp Hematol,2014,42(7):547- 561. DOI:10. 1016/j. exphem. 2014. 03. 009.
[27] Kwee L,Baldwin HS,Shen HM,et al. Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule(VCAM- 1) deficient mice [J]. Development,1995,121(2):489- 503.
[28] Heissig B,Hattori K,Dias S,et al. Recruitment of stem and progenitor cells from the bone marrow niche requires MMP- 9 mediated release of kit-ligand [J]. Cell,2002,109(5):625- 637.
