北京协和医院嗜酸性粒细胞性肺病40例临床分析
2018-05-03张旭东巩海红高金明
张旭东,巩海红,高金明
中国医学科学院 北京协和医学院 北京协和医院呼吸内科,北京 100730
ActaAcadMedSin,2018,40(2):170-177
嗜酸性粒细胞性肺病(eosinophilic lung diseases,ELD)是多种肺组织和/或外周血嗜酸性粒细胞(eosinophil,EOS)增多导致的肺部疾病的统称,以肺组织中EOS浸润为特征,可伴或不伴有外周血EOS增高[1- 2]。ELD分为原发性和继发性2类,原发性:急/慢性嗜酸性粒细胞性肺炎(acute/chronic eosinophilic pneumonia,A/CEP)、特发性高嗜酸性粒细胞综合征和变应性肉芽肿性血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)。继发性:变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)、哮喘、自身免疫性疾病、闭塞性细支气管炎、机化性肺炎、结缔组织疾病、药物/毒素反应、嗜酸性支气管炎、过敏性肺炎、感染、肿瘤性疾病引起的肺EOS增多[3]。由于ELD病因复杂,临床表现多种多样,为疾病诊断及治疗带来一定困难。本研究通过回顾性分析北京协和医院40例ELD住院患者的临床资料,提高对本组疾病的认识,以期早期诊断和治疗,提高预后。
资料和方法
资料选取2013年1月至2016年12月在呼吸内科住院、符合诊断标准、经临床和/或病理诊断为ELD的患者40例,其中ABPA 20例、EGPA 10例、CEP8例、寄生虫感染所致ELD 1例、药物反应所致ELD 1例。ABPA患者符合2013年国际人类与动物真菌学学会[4]或2002年Greenberger[5]推荐的诊断标准;EGPA患者符合1990年美国风湿病协会制定的血管炎分类标准[6];CEP患者、寄生虫感染所致ELD及药物反应所致ELD均符合2012年Cottin和Cordier[7]推荐的诊断标准。回顾性分析患者的病因、病程、临床表现、实验室检查、影像学表现、病理学、治疗及预后等资料。
结 果
一般情况40例ELD患者,男19例、女21例,年龄14~80岁,平均(48.58±18.25)岁。
临床表现20例ABPA患者,男9例、女11例。20例(100%)均出现哮喘;咳嗽、咳痰20例(100%);痰栓3例(15%),包括棕色、黄绿色块状、条状痰栓;呼吸困难14例(70%);发热6例(30%);盗汗2例(10%);乏力7例(35%);体重下降7例(35%);11例(55%)患者肺部闻及哮鸣音,4例(20%)闻及湿罗音。3例(15%)合并鼻窦炎,8例(40%)合并过敏性鼻炎,2例(10%)合并慢性阻塞性肺疾病。10例(50%)有食物花粉等过敏史。8例(40%)一级亲属患哮喘,2例(10%)一级亲属患过敏性鼻炎。
10例EGPA患者,女5例、男5例,均以咳嗽、咳痰为首发症状。脏器受累情况包括:呼吸系统:哮喘10例(100%),呼吸困难9例(90%),咯血1例(10%),鼻窦炎8例(80%),以多组鼻窦受累为主;心脏受累2例(20%):心肌损伤、心律失常、心包积液;1例(10%)合并下肢深静脉血栓及肺栓塞;肾脏受累2例(20%):镜下血尿及少量蛋白尿;皮肤受累5例(50%):红色针尖样、粟粒样皮疹,或荨麻疹样皮疹,以四肢分布为主;发热4例(40%);10例均无神经系统受累。8例(80%)肺部闻及哮鸣音,2例(20%)闻及湿罗音。4例(40%)有过敏性鼻炎病史。1例(10%)有食物花粉等过敏史,1例(10%)有药物过敏史。
8例CEP患者,女5例、男3例,均无明显诱因起病。8例(100%)均有咳嗽;咳痰7例(87.5%);呼吸困难6例(75%);发热5例(62.5%);皮疹3例(37.5%)。2例(25%)肺部闻及湿罗音,2例(25%)哮鸣音。8例均无食物花粉等过敏史。1例(12.5%)有哮喘病史,3例(37.5%)有过敏性鼻炎病史。
寄生虫感染患者,发病前在非洲工作,有食用当地不洁鱼生活史,表现为咳嗽,咳块状黄痰,憋气。药物反应所致ELD患者,发病前1个月内因溃疡性结肠炎通过口服及灌肠应用美沙拉嗪,表现为发热、咳嗽、咳白痰、消瘦。
我的画:有位画家说过,“好的绘画在你面前是往后退的。”多年的绘画实践更明白了其中的道理。优秀的绘画呈现的是一种整体的氛围,吸引你去感受画面背后的一种精神性的东西,而不是停留在表面的技法、色彩等物质性上。精神性的呈现,需要你对物的持续关注和体验,才能在最为熟悉的物上得到灵感。因此我画身边的人与物,通过和谐的色调,细腻的手法,书写的笔意,努力营造画面的氛围,给物以升华,如同打开一扇窗。
实验室检查结果20例ABPA患者,3例(15%)血白细胞(white blood cell,WBC)升高[(11.25~15.29)×109/L],16例(80%)EOS升高,EOS百分比0.052~0.370,绝对值(0.51~4.40)×109/L。18例行血沉(erythrocyte sedimentation rate,ESR)及C反应蛋白(C-reactive protein,CRP)检查,4例(22.2%)ESR升高(28~58 mm/h),10例(55.6%)CRP升高(3.86~106 mg/L)。14例行血1- 3-β-D葡聚糖浓度(G实验)检查,9例(64.3%)阳性;2例行血半乳甘露聚糖(GM实验)检查,均阳性。20例(100%)血清总IgE均升高,其中6例>5000 IU/ml,8例1000~5000 IU/ml,4例417~1000 IU/ml;19例行烟曲霉特异性IgE(aspergillus fumigatus-specific IgE,A-sIgE)检查,16例(84.2%)阳性,8例行烟曲霉特异性IgG(aspergillus fumigatus-specific IgG,A-sIgG)检查,8例(100%)均>40 mg/L,其中4例>200 mg/L。20例均行痰病原学检查,1例(5%)放线菌培养阳性,1例(5%)嗜麦芽窄食单胞菌培养阳性,2例(10%)绿脓杆菌培养阳性,1例(5%)卡他莫拉菌培养阳性,3例(15%)烟曲霉培养阳性,1例(5%)鲍曼不动菌涂片阳性。5例完善支气管肺泡灌洗液(bronchoalveolar lavage fluids,BALF)检查,4例(80%)EOS比例升高,为0.005~0.420。2例皮试对曲霉呈速发阳性反应。
10例EGPA患者,2例(20%)血WBC升高(10.23×109/L、11.95×109/L),10例(100%)均有EOS升高,EOS百分比0.069~0.716,绝对值(0.41~4.48)×109/L。10例均行ESR、CRP检查,4例(40%)ESR升高(28~49 mm/h),9例(90%)CRP升高(3.57~125.57 mg/L)。10例患者均完善抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA)检查,髓过氧化物酶-ANCA阳性1例(10%),蛋白酶3-ANCA均阴性。9例行血清总IgE检查,8例(88.9%)升高,3例<1000 IU/ml,4例1000~2000 IU/ml,1例>5000 IU/ml。尿常规1例(10%)镜下血尿,1例(10%)蛋白尿。10例痰病原学检查均未见致病菌。7例行G实验,1例GM实验,均阴性。9例行A-sIgE检查,4例A-sIgG检查,均阴性。4例完善BALF检查,EOS比例均升高,为0.02~0.70。
8例CEP患者,3例(37.5%)血WBC升高[(13.24~22.20)×109/L],7例(87.5%)EOS升高,EOS百分比0.149~0.698,绝对值(1.23~15.50)×109/L。8例均行ESR、CRP检查,7例(87.5%)ESR升高(24~116 mm/h),6例(75%)CRP升高(5.52~53.79 mg/L)。6例(75%)血清总IgE升高(88~558 IU/ml),2例正常。8例痰病原学检查均未见致病菌。6例行G实验,均阴性。6例行A-sIgE检查,均阴性。7例完善BALF检查,EOS比例:2例>0.40,2例0.30~0.40,3例0.02~0.13(检查前用过激素)。
寄生虫感染患者,血WBC 13.85×109/L,EOS百分比0.379,绝对值5.25×109/L;血清总IgE 590 IU/ml;BALF中EOS比例为0.32;血清曼氏裂头蚴IgG抗体、旋毛虫IgG抗体阳性。药物反应所致ELD患者,血WBC 5.65×109/L,EOS百分比0.20,绝对值1.13×109/L;ESR 80 mm/h、CRP 78.9 mg/L;血清总IgE正常;BALF中EOS比例为0.16。
40例ELD患者粪便寄生虫及幼虫检查均阴性。
血气分析及肺功能检查结果20例ABPA患者呼吸室内空气的动脉血气示,8例(40%)低氧血症[氧分压45.8~82.6 mmHg(1 mmHg=0.133 kPa)],12例正常。14例完善肺功能检查,12例(85.7%)有通气功能障碍,1例为混合性,10例为阻塞性,1例为限制性,1例一秒用力呼气容积(forced expiratory volume in one second,FEV1)及用力肺活量(forced vital capacity,FVC)下降,但FEV1/FVC、肺总量(total lung capacity,TLC)正常,6例(42.9%)伴有弥散功能减低;12例行支气管舒张试验,4例(33.3%)阳性;1例行激发试验,阴性。
10例EGPA患者呼吸室内空气的动脉血气示,9例(90%)低氧血症(氧分压57.6~77.8 mmHg),1例正常。10例均完善肺功能检查,8例(80%)有通气功能障碍,1例为混合性,7例为阻塞性;3例(30%)有弥散功能减低;6例行舒张试验,2例(33.3%)阳性;1例行激发试验,阴性。
8例CEP患者呼吸室内空气的动脉血气示,6例(75%)出现低氧血症(氧分压32.3~78.5 mmHg)。7例完善肺功能检查,1例肺功能正常,6例(85.7%)有通气功能障碍,1例为混合性,2例为阻塞性,1例为限制性,2例FEV1及FVC下降(但FEV1/FVC、TLC正常),3例(42.9%)弥散功能减低;4例行舒张试验,3例(75%)阳性。
寄生虫感染患者ABG、通气、弥散功能均正常。药物反应所致ELD患者,ABG正常,肺功能示限制性通气功能障碍,弥散功能正常。
影像学检查结果20例ABPA患者,CT 示15例(75%)支气管扩张,其中双侧13例(65%),左侧2例(10%),均为中心型支气管扩张,以双侧中上肺为主;18例(90%)斑片、条索影;3例(15%)结节影;12例(60%) “指套样”、“条状”黏液嵌塞征(图1A、1B);1例(5%)树芽征;6例(30%)纵隔及肺门淋巴结肿大;12例(60%)胸膜增厚(双侧增厚为主);2例(10%)胸腔积液(双侧、左侧各1例);3例(15%)以肺间质病变为主要表现。此外,影像学分析显示7例(35%)存在肺部游走性斑片影。
10例EGPA患者,CT以肺浸润为主,有结节影、磨玻璃影、斑片实变影等;9例(90%)以片状浸润影为主,8例双侧,1例右侧;8例(80%)结节影;2例(20%)浸润影沿支气管血管束分布(图1C、1D);4例(40%)胸膜增厚;1例(10%)以肺间质病变为主,伴胸膜增厚及胸腔积液;2例(20%)支气管扩张;7例(70%)纵隔及肺门淋巴结肿大。8例行鼻窦CT,均提示鼻窦炎,上颌窦炎最多见。2例行头部影像学检查,均正常。
8例CEP患者,6例(75%)CT呈双肺弥漫分布的磨玻璃影、斑片实变或索条影;2例(25%)表现为呈周边分布的云絮状片状阴影,边缘模糊,与肺水肿影像相反,即“肺水肿反转征”(图1E、1F);4例(50%)结节影;4例(50%)胸膜增厚,均为双侧;5例(62.5%)纵隔及肺门淋巴结肿大;1例(12.5%)双侧局部轻度支气管扩张。
寄生虫感染患者,CT示双肺间质纹理增多,双肺多发结节影,结节周围见磨玻璃影。药物反应所致ELD患者,CT示双肺多发磨玻璃影、索条影及斑片影,以右肺为著,伴右侧胸膜增厚。
病理学检查结果20例ABPA患者,2例行经纤维支气管镜肺活检(transbronchoscopic lung biopsy,TBLB):肺组织慢性炎。1例行经皮穿刺肺活检:肺肉芽肿性炎,符合慢性机化性肺炎。
10例EGPA患者,4例支气管镜黏膜活检:2例黏膜显慢性炎,2例黏膜显急、慢性炎,且其中1例见上皮下EOS团伴坏死。1例TBLB:小血管的坏死性血管炎及肉芽肿,周围见EOS浸润。1例中鼻道组织活检:被覆假复层纤毛柱状上皮的黏膜显慢性炎,间质可见较多EOS浸润(图1G)。3例皮肤病理活检:血管周围可见EOS浸润,符合嗜酸性血管炎改变。7例骨髓细胞学涂片,4例EOS百分比增高(0.15~0.22)。
8例CEP患者,1例支气管黏膜活检:见支气管黏膜上皮细胞及EOS。4例TBLB:支气管黏膜、肺组织显慢性炎,肺泡腔内可见较多EOS浸润(图1H)。1例经皮肺穿刺活检:肺泡腔内可见机化伴较多EOS浸润。4例骨髓细胞学涂片,EOS百分比均增高(0.11~0.47)。
寄生虫感染患者,TBLB示小块软骨、支气管黏膜及极少许肺组织显慢性炎,肺泡腔内可见散在EOS及吞噬细胞聚集。药物反应所致ELD患者,骨穿涂片示中性分叶核粒细胞及嗜酸性分叶核粒细胞比例升高。
误诊情况20例ABPA患者中,2例(10%)曾误诊为肺结核,3例(15%)肺部感染,12例(60%)哮喘,1例(5%)CEP,从出现症状到确诊为ABPA的时间为3个月~15年;10例EGPA患者,8例(80%)曾误诊为哮喘,5例(50%)肺部感染,1例(10%)CEP,从出现症状到确诊为EGPA的时间为1个月~7年;8例CEP患者,3例(37.5%)曾误诊为哮喘,7例(87.5%)肺部感染,1例(12.5%)EGPA,1例(12.5%)ABPA,从出现症状到确诊为CEP的时间为1个月~8年;寄生虫感染患者,曾被误诊为肺部感染、过敏性肺炎,从出现症状到确诊为寄生虫感染的时间为5个月。
治疗及预后确诊ABPA后,20例患者中,11例给予口服泼尼松+伊曲康唑治疗;3例单用泼尼松;1例单用伊曲康唑;5例单用吸入激素(1例肺CT有支气管扩张、4例无支气管扩张);7例因合并肺部感染用抗生素。12例患者随诊资料显示(随诊4个月~8年),8例经治疗缓解后处于稳定状态(包括2例随诊4个月、1年的非支气管扩张型单用吸入激素患者),血清总IgE水平下降,血EOS计数及ESR、CRP可降至正常;4例病情反复加重(包括1例随诊半年的支扩型单用吸入激素患者),加重时伴血清总IgE水平再次升高。
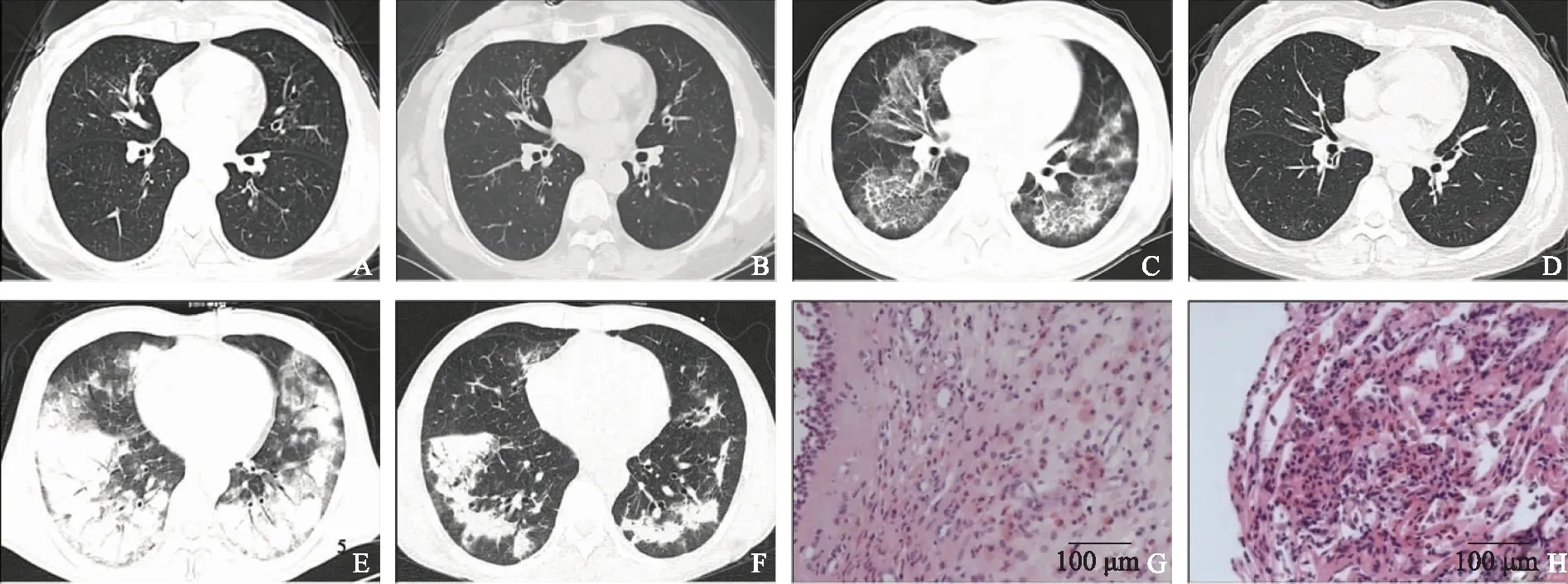
A.管壁增厚,可见沿支气管分布的高密度条带影及结节影,即黏液填充支气管后的黏液嵌塞征;B.泼尼松+伊曲康唑治疗5个月后,斑片结节影较前减少;C.变应性肉芽肿性血管炎,双肺沿支气管血管束分布的磨玻璃、斑片影及网格影;D.泼尼松+环磷酰胺治疗5个月后,渗出影完全吸收;E.慢性嗜酸粒细胞性肺炎,双肺多发斑片实变影,内见空气支气管征,周边分布为主,即肺水肿反转征;F.静脉输入甲泼尼龙1周后斑片实变影较前明显好转;G.变应性肉芽肿性血管炎鼻道组织活检,被覆假复层纤毛柱状上皮的黏膜显慢性炎,间质可见较多嗜酸性粒细胞浸润(HE染色,×200);H.慢性嗜酸粒细胞性肺炎肺组织活检,肺泡腔内可见较多嗜酸性粒细胞浸润(HE染色,×200)
A.bronchial wall was thickened,along with high-density zebraic,nodular shadows along the bronchi,i.e.“mucous plug syndrome”;B.after treatment with prednisone+itraconazole for 5 months,the opacities were partially absorbed;C.eosinophilic granulomatosis with polyangiitis:bilateral multifocal consolidation,reticular and ground-glass opacities along bronchial vascular bundles;D.after 5-month treatment with prednisone+cyclophosphamide,infiltrations disappeared completely;E.chronic eosinophilic pneumonia:multiple patchy consolidations in both lungs,showing air bronchogram sign and reverse pulmonary edema;F.after 1-week treatment with intravenous methylprednisolone,the patchy consolidations were significantly decreased;G.nasal tissue biopsy in a patient with eosinophilic granulomatosis with polyangiitis:the mucosa covered by ciliated pseudostratified columnar epithelia showed chronic inflammation,with abundant eosinophils in interstitial space(HE staining,×200);H.lung biopsy in a patient with chronic eosinophilic pneumonia:a large number of eosinophils infiltrated in the alveolar cavity(HE staining,×200)
图1变应性支气管肺曲霉病,双肺多发支气管扩张
Fig1Allergic bronchopulmonary aspergillosis and bilateral central bronchiectasis
确诊EGPA后,10例患者均给予口服激素治疗,其中8例以泼尼松0.75~1 mg/(kg·d)起始,治疗4~6周后规律减量;2例以泼尼松0.5 mg/(kg·d)起始,治疗4周后规律减量。6例加用环磷酰胺、1例加用硫唑嘌呤,均能达到临床缓解。8例患者随诊资料显示(随诊6个月~3年),5例经治疗缓解后处于稳定状态,血EOS计数及ESR、CRP可降至正常;3例病情反复加重,伴随ESR、CRP再次升高,肺CT出现新发病灶。
确诊CEP后,8例患者均给予口服激素治疗。其中2例病情严重,伴有I型呼吸衰竭,口服激素前予1周静脉甲泼尼龙(80 mg/d)治疗,序贯泼尼松 60 mg/d,5例以泼尼松30~40 mg/d起始,1例以美卓乐48 mg/d起始,均治疗4周后规律减量,均能达到临床缓解。5例患者随访6个月~3年,均未复发,血EOS计数及ESR、CRP降至正常,复查肺CT病灶吸收,无新发病灶。
确诊寄生虫感染后,予吡喹酮驱虫治疗后,2个月复查血EOS恢复正常,肺部阴影大部分吸收,半年后复查阴影完全吸收;随诊2年未复发。药物反应所致ELD患者,以泼尼松 30 mg/d起始,治疗4周后规律减量,15 mg/d维持治疗1年,随诊2年未复发。
讨 论
ELD是一组以EOS弥漫性浸润肺间质、肺泡腔为特点的变态反应性疾病[8]。其发病可能与寄生虫、真菌感染、药物、化学毒物接触有关,或肿瘤、结节病、过敏性肺炎等继发的肺EOS升高,或系统性疾病肺受累;多数病因不明确[9]。全球ELD中寄生虫感染是最常见的病因,食源性蠕虫感染也是我国ELD的最常见病因之一,梁琼等[10]报道的广西地区25例ELD中,10例(40%)由寄生虫感染所致,占所有导致ELD病因中最高比例。本研究40例ELD中,仅1例(2.5%)由寄生虫感染所致,这是由于寄生虫感染所致ELD患者多有寄生虫流行疫区生活史,而本研究为协和医院单中心的40例病例,因地区和患者群的差异,寄生虫感染导致ELD的比例较低。
ABPA多发生于哮喘、囊性纤维化患者,在二者中的发病率分别为1%~2%、7%~10%[8,11]。典型临床表现为反复发作的喘息、咳嗽、咳痰,慢性期出现肺纤维化导致的呼吸困难,支气管扩张合并感染[4]。CT典型特征为中心型支气管扩张,高密度管状、指套状黏液嵌塞征,约占30%[12]。本研究病例以支气管扩张、斑片、条索影为主,12例(60%)患者具有痰栓征。ABPA诊断不需要病理活检,2002年Greenberger[5]制定的5条必要标准:(1)哮喘;(2)中心型支气管扩张;(3)血清总IgE>1000 ng/ml;(4)曲菌抗原皮试阳性;(5)血清A-sIgE/IgG升高;5条均满足者为伴中心型支气管扩张的ABPA,无中心型支气管扩张而满足其余4条者为血清学阳性的ABPA。2013年国际人类与动物真菌学学会推荐的ABPA诊断标准:(1)易患因素:哮喘或囊性纤维化;(2)两条必备标准:①烟曲霉皮试速发阳性反应或血清A-sIgE水平升高;②血清总IgE>1000 ng/ml(若血清总IgE<1000 ng/ml,但符合其他全部标准也可诊断为ABPA);(3)至少以下2条:①血清中出现烟曲霉沉淀素或IgG抗体;②影像学示肺部浸润影;③未使用激素时血EOS>500/ul[4]。本研究20例患者均符合国际人类与动物真菌学学会标准;15例符合Greenberger[5]制定的标准(2例血清总IgE<1000 ng/ml、5例无支气管扩张),故国际人类与动物真菌学学会标准更敏感,与之前研究结果一致[13]。ABPA最有效的治疗方法为口服激素,急性期可短暂静脉内使用甲泼尼龙[14]。吸入激素可能减少口服激素的用量[15];对于单独吸入激素的疗效很难评价,因为大多为小样本研究,有报道指出单纯应用高剂量吸入激素可以改善患者哮喘症状,但不能完全控制[16]。抗真菌药主要作用为减少真菌在气道内定殖,目前推荐口服伊曲康唑200 mg,2次/d,至少使用16周[4]。
EGPA是一种累及中小血管的系统性疾病。35%~40%的患者可出现ANCA阳性[17],有肾脏受累的患者更多见[18]。典型的EGPA临床分为3期,1期即过敏期,表现为哮喘、过敏性鼻炎、鼻窦炎;2期以外周血EOS升高或器官组织EOS浸润为特点;3期即血管炎期[19],3个阶段可以重复。影像学以非固定肺浸润为主,表现为弥漫分布的斑片渗出影,也可有结节影,但结节影很少出现空洞,这是与韦格纳肉芽肿的鉴别之处。受累组织活检病理结果为诊断“金标准”,典型的EGPA病理特点为坏死性的血管炎、EOS浸润和血管外肉芽肿形成[8],但不一定同时存在于同一例EGPA患者。目前多用1990年美国风湿病协会制定的血管炎分类标准:(1)哮喘;(2)外周血EOS增多(百分比≥0.10或绝对值≥1.5×109/L);(3)单发或多发神经病变;(4)非固定性肺浸润;(5)鼻窦炎;(6)活检见血管外EOS浸润,以上6条符合4条可诊断为EGPA[6]。激素治疗是EGPA治疗的基础,起始剂量通常为口服泼尼松1 mg/(kg·d),病情严重时可短期静脉内应用甲泼尼龙[20]。对存在影响预后因素的患者,联合应用激素及环磷酰胺可改善预后,影响预后的因素包括年龄≥65岁、心脏受累、胃肠道受累、肾功能不全(血肌酐≥150 μmol/L)、缺乏耳鼻喉症状[21- 22]。
CEP是一种少见的、病因未明的进展性肺部疾病,发病高峰在50岁左右[23]。多隐匿起病,常见症状为咳嗽、呼吸困难、发热、体重下降,肺外症状很少见。外周血EOS可明显增多,比例达0.90,痰液检查见大量EOS。CT多表现为双侧、外周分布的斑片状实变、磨玻璃影。特异性影像学表现为“肺水肿反转征”,但仅不到1/3的患者出现此征象[24]。CEP的诊断基于以下几点:(1)影像学示肺组织浸润影,以肺野周边为主;(2)外周血EOS计数>1.0×109/L和/或BALF中EOS比例占0.40以上;(3)呼吸系统症状持续2~4 周;(4)肺活检示肺间质及肺泡腔EOS浸润;(5)排除药物、寄生虫感染等其他明确病因的ELD[7]。若具备临床症状及影像学表现,且外周血和/或BALF中EOS计数显著增高达诊断标准,并排除其他继发的ELD,则可临床诊断CEP。CEP治疗以口服激素为主,对激素反应快速且明显是CEP的特征之一,少数患者可自发缓解。目前公认的方法是以泼尼松0.5 mg/(kg·d)起始,口服2周后逐渐减量至停药,总疗程6个月以上[25]。在激素减量过程中或停药后,CEP的复发率可达0.50,故激素减量过程应谨慎而缓慢。
多种寄生虫种属均可导致ELD。患者多有寄生虫流行疫区生活史,且对一种寄生虫感染的患者还需排除其他寄生虫感染的可能,如本研究患者同时感染曼氏裂头蚴、旋毛虫。寄生虫感染所致的ELD诊断主要基于以下几点:(1)存在寄生虫流行疫区生活史;(2)发热、呼吸道症状及哮鸣音;(3)胸部影像学提示肺部浸润影;(4)外周血EOS升高;(5)寄生虫特异性补体结合试验阳性,粪便找到寄生虫卵,血清学检测抗体阳性;同时满足以上几点即可诊断[10]。寄生虫感染导致的ELD治疗措施包括驱虫治疗、口服激素、手术治疗[24]。药物引起的ELD在症状、影像学及病理学上很难与急性嗜酸粒细胞性肺炎、CEP鉴别,临床症状与药物之间在时间上的因果关系是诊断的关键,停药后症状缓解及重复用药后症状再发也有诊断价值,但后者风险较大,临床很少应用。常见的引起ELD的药物包括:抗生素(呋喃妥因、达托霉素、氨苯砜、米诺环素),心血管类药物(胺碘酮、β受体阻滞剂、血管紧张素转化酶抑制剂),抗抑郁药(阿米替林、文拉法辛、氟西汀),抗惊厥药(卡马西平、苯妥英钠)及美沙拉嗪[24]。尽管多数患者停药后能自发缓解,但对部分病情严重或持续的患者,仍需激素治疗[26]。
确定导致ELD的病因对诊断和治疗有意义,如寄生虫感染;但由于多数ELD病因难以明确,且CT多表现为斑片条索状浸润影或磨玻璃、结节、实变影等,因而易被误诊为肺部感染、肺结核。当血EOS升高并伴有肺部疾病或BALF中EOS增多或肺组织活检EOS增多时,需考虑ELD,且多数ELD出现血清总IgE升高,均可与感染、结核鉴别。由于ELD的症状及肺功能均与哮喘相似,易被误诊为单纯的支气管哮喘,临床对于难以控制的哮喘,且CT出现肺部浸润影或存在其他系统受累时需考虑ELD可能。部分ELD之间也可能出现误诊。本研究存在ABPA、EGPA、CEP之间误诊。对于ABPA患者,血清A-sIgE/IgG、G/GM实验阳性及CT典型支气管扩张、黏液栓征可用于与EGPA、CEP鉴别[27]。本研究10例(50%)ABPA患者存在食物、花粉等过敏,较EGPA(1例,10%)、CEP(0例)明显增多;7例(35%)合并肺部感染,而EGPA、CEP痰病原学均阴性,提示对于痰病原学检查及过敏史阳性的患者,可能更倾向于ABPA。EGPA与CEP病理均可有肺泡腔EOS浸润,但EGPA的血管炎及血管外肉芽肿有助于与CEP鉴别,且CEP很少出现肺外表现,而EGPA为多系统受累疾病。此外,本研究所有ABPA患者血清总IgE均升高,6例(30%)>5000 IU/ml,14例(70%)>1000 IU/ml,而EGPA、CEP均存在总IgE正常的患者,5例(55.6%)EGPA>1000 IU/ml,仅1例(11.1%)EGPA>5000 IU/ml,而所有CEP均<1000 IU/ml,提示血清总IgE水平有助于三者的鉴别。
ELD临床表现缺乏特异性,为其诊断和治疗带来难度。ELD主要依靠临床症状、影像学表现、血及BALF中EOS升高进行诊断。ELD之间易误诊或被误诊为感染、结核等其他疾病,少数临床表现不典型或鉴别诊断不明确的情况下,需完善病理学检查。口服激素是ELD治疗的基础。
[1] Allen JN,Davis WB. Eosinophilic lung diseases[J]. Am J Respir Crit Care Med,1994,150(5 Pt 1):1423- 1438.DOI:10. 1164/ajrccm. 150. 5. 7952571.
[2] Bernheim A,McLoud T. A review of clinical and imaging findings in eosinophilic lung diseases[J]. AJR Am J Roentgenol,2017,208(5):1002- 1010.DOI:10.2214/AJR.16. 17315.
[3] Rose DM,Hrncir DE. Primary eosinophilic lung diseases[J]. Allergy Asthma Proc,2013,34(1):19- 25. DOI:10. 2500/aap. 2013. 34. 3628.
[4] Agarwal R,Chakrabarti A,Shah A,et al. Allergic bronchopulmonary aspergillosis:review of literature and proposal of new diagnostic and classification criteria[J]. Clin Exp Allergy,2013,43(8):850- 873.DOI:10.1111/cea. 12141.
[5] Greenberger PA. Allergic bronchopulmonary aspergillosis[J]. J Allergy Clin Immunol,2002,110(5):685- 692. DOI:10. 1067/mai. 2002. 130179.
[6] Masi AT,Hunder GG,Lie JT,et al. The American College of Rheumatology 1990 criteria for the classification of churg-strauss syndrome(allergic granulomatosis and angiitis)[J]. Arthritis Rheum,1990,33(8):1094-1100.DOI:10. 1002/art. 1780330806.
[7] Cottin V,Cordier JF. Eosinophilic lung diseases[J]. Immunol Allergy Clin North Am,2012,32(4):557- 586. DOI:10. 1016/j. iac. 2012. 08. 007.
[8] Cottin V. Eosinophilic lung diseases[J]. Clin Chest Med,2016,37(3):535- 556. DOI:10. 1016/j. ccm. 2016. 04. 015.
[9] Jeong YJ,Kim KI,Seo IJ,et al. Eosinophilic lung diseases:a clinical,radiologic,and pathologic overview[J]. Radiographics,2007,27(3):617- 637. DOI:10. 1148/rg. 273065051.
[10] 梁琼,陈一强,孔晋亮,等. 嗜酸性肺部疾病25例临床资料分析[J]. 中华内科杂志,2015,54(5):426- 430. DOI:10. 3760/cma. j. issn. 0578- 1426. 2015. 05. 010.
[11] Janahi IA,Rehman A,Al-Naimi AR. Allergic bronchopulmonary aspergillosis in patients with cystic fibrosis[J]. Ann Thorac Med,2017,12(2):74- 82. DOI:10. 4103/atm. ATM_231_16.
[12] Phuyal S,Garg MK,Agarwal R,et al. High-attenuation mucus impaction in patients with allergic bronchopulmonary aspergillosis:objective criteria on high-resolution computed tomography and correlation with serologic parameters[J]. Curr Probl Diagn Radiol,2016,45(3):168- 173. DOI:10. 1067/j. cpradiol. 2015. 07. 006.
[13] 张明强,高金明. 北京协和医院77例变应性支气管肺曲菌病住院患者临床特征分析[J]. 中国医学科学院学报,2017,39(3):352- 357.DOI:10.3881/j.issn.1000- 503X. 2017. 03. 009.
[14] Singh Sehgal I,Agarwal R. Pulse methylprednisolone in allergic bronchopulmonary aspergillosis exacerbations[J]. Eur Respir Rev,2014,23(131):149-152.DOI:10.1183/09059180. 00004813.
[15] Agarwal R,Gupta D,Aggarwal AN,et al. Allergic bronchopulmonary aspergillosis:lessons from 126 patients attending a chest clinic in north India[J]. Chest,2006,130(2):442- 448. DOI:10. 1378/chest. 130. 2. 442.
[16] Agarwal R,Khan A,Aggarwal AN,et al. Role of inhaled corticosteroids in the management of serological allergic bronchopulmonary aspergillosis(ABPA)[J]. Intern Med,2011,50(8):855- 860.
[17] Calatroni M,Oliva E,Gianfreda D,et al. ANCA-associated vasculitis in childhood:recent advances[J]. Ital J Pediatr,2017,43(1):46. DOI:10. 1186/s13052- 017- 0364-x.
[18] Jennette JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J]. Clin Exp Nephrol,2013,17(5):603- 606. DOI:10. 1007/s10157- 013- 0869- 6.
[19] Gioffredi A,Maritati F,Oliva E,et al. Eosinophilic granulomatosis with polyangiitis:an overview[J]. Front Immunol,2014,5:549. DOI:10. 3389/fimmu. 2014. 00549.
[20] 李国安,蔡柏蔷. 变应性肉芽肿性血管炎25例临床分析[J]. 中华结核和呼吸杂志,2012,35(1):45- 49. DOI:10. 3760/cma. j. issn. 1001- 0939. 2012. 01. 015.
[21] Guillevin L,Pagnoux C,Seror R,et al. The five-factor score revisited:assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group(FVSG) cohort[J]. Medicine(Baltimore),2011,90(1):19- 27. DOI:10. 1097/MD. 0b013e318205a4c6.
[22] Tsurikisawa N,Oshikata C,Kinoshita A,et al. Longterm prognosis of 121 patients with eosinophilic granulomatosis with polyangiitis in Japan[J]. J Rheumatol,2017,44(8):1206- 1215. DOI:10. 3899/jrheum. 161436.
[23] Bhatt NY,Allen JN. Update on eosinophilic lung diseases[J]. Semin Respir Crit Care Med,2012,33(5):555- 571. DOI:10. 1055/s- 0032- 1325164.
[24] Price M,Gilman MD,Carter BW,et al. Imaging of eosinophilic lung diseases[J]. Radiol Clin North Am,2016,54(6):1151- 1164. DOI:10. 1016/j. rcl. 2016. 05. 008.
[25] Blanc S,Albertini M,Leroy S,et al. Chronic eosinophilic pneumonia with persistent decreased diffusing capacity for carbon monoxide[J]. Case Reports,2013,2013(15):bcr2012008238. DOI:10. 1136/bcr- 2012- 008238.
[26] Park JE,Hwangbo Y,Chang R,et al. Mesalazine-induced eosinophilic pneumonia in a patient with Crohn’s disease [J]. Korean J Gastroenterol,2009,53(2):116- 120.
[27] Agarwal R,Sehgal IS,Dhooria S,et al. Developments in the diagnosis and treatment of allergic bronchopulmonary aspergillosis[J]. Expert Rev Respir Med,2016,10(12):1317- 1334. DOI:10. 1080/17476348. 2016. 1249853.
