浅析闪锌矿氧压浸出的酸平衡和热平衡
2018-05-02张候文李衍林
张候文, 李衍林
(1.云南驰宏锌锗股份有限公司, 云南 曲靖 655011; 2.云南省铅锌资源综合利用企业重点实验室, 云南 曲靖 655011)
硫化锌精矿(简称锌精矿)处理工艺分为先焙烧后浸出和直接浸出两种,直接浸出又分为常压氧浸和加压浸出,两种直接浸出原理相同,只是实现方式不同[1]。锌精矿氧压浸出需要在高温、加压下使硫化物中的有价金属以硫酸盐形式进入溶液,元素硫被氧化为单质硫,该浸出过程是一个耗酸和放热过程,本文就锌精矿氧压浸出的酸平衡和热平衡进行探讨。
1 锌精矿氧压浸出酸平衡
1.1 锌精矿氧压浸出化学反应
锌精矿中的锌、铅和镉以ZnS、PbS和CdS形态存在,一部分铁以FeS形态存在,一部分铁与铜以CuFeS2形态存在,钙、镁以CaCO3和MgCO3形态存在,硅以SiO2形态存在。浸出时的主要化学反应为:
ZnS+H2SO4+1/2O2=ZnSO4+H2O+S
(1)
CdS+H2SO4+1/2O2=CdSO4+H2O+S
(2)
CuFeS2+2H2SO4+O2=CuSO4+FeSO4+2H2O+2S
(3)
FeS+H2SO4+1/2O2=FeSO4+H2O+S
(4)
PbS+H2SO4+1/2O2=PbSO4+H2O+S
(5)
CaCO3+H2SO4=CaSO4+H2O+CO2
(6)
MgCO3+H2SO4=MgSO4+H2O+CO2
(7)
1.2 锌精矿氧压浸出酸平衡
尽管上述反应(1)~(7)均是耗酸反应,但由于锌电积时可以使大部分硫酸再生,需要补充的硫酸只是少部分。
氧压浸出液通常先用含锌物料降低酸度,再用石灰中和除铁,因此锌、镉、铜浸出反应消耗的酸是可以在电解时再生的,而铁、铅、钙、镁浸出时消耗的酸就不能在电解时再生,必须补加硫酸来平衡。
以表1和表2的锌精矿和废液为例,假设(1)~(7)反应完成率分别为98%、99%、90%、98%、95%、100%和100%,可以计算出1t锌精矿浸出反应需要硫酸量为936.54 kg,其中废液提供硫酸744.99 kg,需要电解液体积为4.97 m3,浸出反应需补加硫酸191.55 kg。如果浸出液在石灰中和除铁之前的残酸为5 g/L,则石灰中和除铁过程消耗的硫酸量为24.83 kg,因此补加硫酸总量为216.38 kg。浸出液含锌约为148.6 g/L。

表1 锌精矿化学成分 %

表2 废电解液(废液)成分 g/L
注:废液密度为1.26 g/mL。
锌精矿浸出所需废液体积与锌精矿中锌、镉、铜含量和废液酸度有关,锌精矿中锌、镉、铜含量越高和(或)废液酸度越低,所需废液的体积越大,升温需要的热量越多。补加硫酸量与锌精矿中铁、铅、钙、镁含量和浸出液石灰中和除铁前残酸有关,锌精矿中铁、铅、钙、镁含量和(或)浸出液石灰中和除铁前残酸越高,需要补加的硫酸越多。
可见,锌精矿氧压浸出在通常情况下是无法实现酸平衡的,需要补加硫酸。
2 锌精矿氧压浸出热平衡
体系的焓变只取决于起始状态与终结状态,与变化所经过的途径无关[2],本文选择先从初始温度状态升温到最终温度状态后再发生化学反应这一途径来计算焓变。另外,由于压力对固体和液体的焓值影响很小[3-4],因此采用标准压力下的焓值代替加压状态下的焓值。为了简化计算过程,假定反应物料只有锌精矿和废液,升温到150 ℃后发生化学反应,忽略环境热损失、硫酸稀释热和氧气吸热的影响。
2.1 锌精矿氧压浸出反应放热
根据上述焓变计算方法,计算150 ℃(即423 K)浸出反应焓,反应焓大于零为吸热反应,小于零为放热反应。
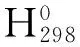
通过上述计算,1t锌精矿在150 ℃下浸出反应放出热量为2 222.80 MJ。
2.2 锌精矿升温吸热
根据上述焓变计算方法,计算表1的硫化锌精从25 ℃加热到150 ℃需要吸收的热量。
首先,查无机物热力学数据手册[5],获得锌精矿中各组元的标准恒压热容Cp=a+b×10-3T+c×105T-2+d×10-6T2的参数。
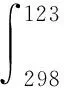
再者,根据求和公式ΔH0=∑niΔiH0计算锌精矿实际吸热量,式中ni为锌精矿中某一组元的物质量。
通过上述计算,1 t锌精矿从25 ℃加热到150 ℃需要吸收的热量为68.22 MJ。
2.3 废液升温吸热
根据上述焓变计算方法,计算表2的废液从35 ℃加热到150 ℃所吸收的热量。
首先,查无机物热力学数据手册[5],获得废液中各组元的标准恒压热容Cp=a+b×10-3T+c×105T-2+d×10-6T2的参数。

再者,根据求和公式ΔH0=∑niΔiH0计算废液实际吸热量,式中ni为废液中某一组元的物质量。
通过上述计算,将4.97 m3废液从35 ℃加热到150 ℃需要吸收的热量为2 703.70 MJ。
2.4 锌精矿氧压浸出热平衡
1 t锌精矿反应放热为2 222.80 MJ,1 t锌精矿和4.97 m3废液升温需要吸收的热量为2 771.93 MJ,因此还需要外界提供热量549.13 MJ,占总吸热量的19.8%。可见,在通常情况下锌精矿氧压浸出是无法实现自热平衡的,还需要从外界补充部分热量。
3 酸平衡和热平衡优化
3.1 提高废液酸度
从前文的热平衡计算可知,废液用量越大,要吸收的热量越多,如果将废液酸度从150 g/L提高到186 g/L,1 t锌精矿需要的废液就从4.97 m3减少到4.01 m3。
采用前文计算方法,计算4.01 m3含酸186 g/L、含锌62 g/L、比重1.30 g/mL的废液,从35 ℃升温到150 ℃所吸收的热量为2 161.35 MJ。
此时,锌精矿反应放热还是2 222.80 MJ,锌精矿和废液共吸收热量为2 229.57 MJ,还需要外界提供热量6.77 MJ,仅占总吸热量的0.3%。
通过提高废液酸度,降低锌精矿对废液需求量,可以基本实现锌精矿氧压浸出自热平衡。但反应后浸出液含锌也从148.4 g/L提高到184.2 g/L,给生产带来不利影响,所以通过提高废液酸度来实现锌精矿的热平衡作用十分有限。
3.2 提高浸出氧势
前文已知浸出1 t锌精矿需要额外补加硫酸216.38 kg(2.21 kmol),以补充铁、铅、钙、镁浸出耗酸和浸出液石灰中和除铁耗酸。由锌精矿氧压浸出电位—pH图可知,提高氧势(氧分压)可以使硫以硫酸根的形式进入溶液。反应如下:
ZnS+2O2=ZnSO4
(8)
CdS+2O2=CdSO4
(9)
CuFeS2+4O2=CuSO4+FeSO4
(10)
FeS+2O2=FeSO4
(11)
PbS+2O2=PbSO4
(12)
采用前文计算方法,可以计算出反应(8)~(12)在150 ℃时的反应焓,并与反应(1)~(5)在150 ℃的反应焓对比,见表3。

表3 150 ℃时锌精矿各组元不同浸出产物的反应焓比较
提高氧势后硫化物中的硫不再被氧化成单质硫,而是硫酸根,反应放出的热量也比前者大幅提高,而且不再耗酸。为了实现锌精矿氧压浸出的酸平衡和热平衡,可以通过提高氧分压, 使少部分部分硫化物中的硫氧化成高价的硫酸根。
为了简化计算,假设提高氧势后只有少量ZnS中的硫被氧化成高价的硫酸根。为了使酸平衡,1 t锌精矿需要有2.21 kmol的ZnS中的硫被氧化成高价硫酸根,将多放出热量1 381.94 MJ。
以表1和表2提供的1 t锌精矿和4.97 m3废液为例,反应放热变成3 604.74 MJ,锌精矿和废液共吸收热量为2 771.93 MJ,多出热量832.81 MJ。可见,提高氧势使部分硫化物中的硫氧化成高价硫酸根,可以实现酸平衡,除了满足浸出物料升温外,还有多余热量产出。
4 结论
(1)锌精矿氧压浸出在通常情况下无法实现酸平衡,需要补加硫酸来平衡铁、铅、钙、镁浸出耗酸和浸出液石灰中和除铁耗酸。
(2)锌精矿氧压浸出在通常情况下无法实现热平衡,需要从外界补充热量以平衡物料升温所需。
(3)提高废液酸度、减少废液用量,可以减少升温需要热量,但会给生产带来不利影响,因此该法对锌精矿氧压浸出热平衡作用十分有限。
(4)通过提高氧势,使硫化物中的硫少部分氧化成硫酸根,可以实现锌精矿氧压浸出的酸平衡,除了满足浸出物料升温外,还有多余热量产出。
[参考文献]
[1] 梅光贵,王德润,周敬元,等.湿法炼锌学[M].湖南:中南大学出版社,2001.
[2] 杨显万, 邱定蕃.湿法冶金[M].北京:冶金工业出版社, 1998.
[3] 谢克强,杨显万,王吉坤.硫化锌精矿加压浸出过程的热平衡[J].有色金属设计,2007(1):17-24.
[4] 马荣骏.湿法冶金原理[M]. 北京:冶金工业出版社,2007.
[5] 梁英教,车荫昌.无机物热力学数据手册[M].沈阳:东北大学出版社,1994.
