赤藓糖醇对豌豆分离蛋白结构和功能特性的影响
2018-05-01周向军朱敏涛袁毅君
周向军,朱敏涛,袁毅君
(天水师范学院生物工程与技术学院,甘肃天水 741001)
糖醇是羰基加氢生成的多元醇化合物,在食品加工过程中常需添加一些天然糖醇类化合物,不仅可改善脱水食品的复水性、控制结晶程度和降低水分活度,还可改善蛋白质部分功能,如热稳定性、溶解性、起泡性、乳化性、稳定性胶凝性等[7-11],糖醇还可稳定和保护溶液中的生物大分子、抑制大分子聚集体形成、抑制空气-水界面的蛋白质变性以及提高蛋白乳化液在不同环境因素条件下的稳定性等。功能性糖醇主要包括山梨醇、麦芽糖醇、木糖醇、D-甘露糖醇、赤藓糖醇和乳糖醇等,其中赤藓糖醇是一种通过自然发酵获得的四碳糖醇,具有一系列优点,如极低热值、极高耐受量和安全性、不易引起肠胃不适、无龋齿性等。根据不同需要,其添加量可达0.5%~40%,是一种极具应用前景的新型天然甜味剂,可作为糖尿病和肥胖症病人的食糖替代品,在食品行业广泛用作抗冻剂、抗氧化剂,从而可延长产品货架期[12-13]。另外,赤藓糖醇具有很强的抗氧化性,有助于防止体内由高血糖引起的血管损伤。
本文采用8-苯胺基-1-萘磺酸钠荧光探针法、紫外和荧光光谱法,研究不同质量分数赤藓糖醇处理豌豆粉时,其对豌豆分离蛋白溶解性、持水性、表面疏水性、紫外及荧光光谱的影响,为豌豆分离蛋白在食品行业中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
豌豆粉 云南意蜂特产散装纯豌豆粉;8-苯胺基-1-萘磺酸钠 购自京化成工业株式会社;赤藓糖醇 购自Bio Basic Inc公司;牛血清白蛋白(BSA) 购自生工生物工程(上海)股份有限公司;考马斯亮蓝G250、氯化钠、磷酸二氢钠、磷酸氢二钠和正己烷等 均为国产分析纯。
RF-5301PC荧光分光光度计 日本岛津;UV-1800紫外可见分光光度计 日本岛津;722可见分光光度计 上海欣茂有限公司;PHS-3D雷磁pH计 上海精密科学有限公司;TGL-20M型高速台式冷冻离心机 湘仪离心机仪器有限公司;AL-204型电子天平 梅特勒-托利多有限公司;90-3型定时恒温双向磁力搅拌器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 PPI制备 参考Miroljub[14]方法,稍作修改。称取50.00 g豌豆粉,按1∶5加入正己烷,脱脂两次。5000 r/min离心15 min,沉淀分散于0.1 mol/L NaCl溶液1250 mL中,调节pH9.0,40 ℃水浴搅拌3 h,5000 r/min离心15 min。上清液调至pH4.5,静置过夜。8000 r/min离心15 min,沉淀水洗2次,真空干燥得PPI。
1.2.2 溶解性 可溶性蛋白含量测定采用考马斯亮蓝法,其标准曲线制作参考李迎秋[15]方法。标准曲线方程为Y=23.602X-0.0027,R2=0.9988,X为蛋白质量,mg;Y为OD595。称取5.00 g PPI,溶于0.01 mol/L pH7.0磷酸缓冲液95 mL中,搅拌2 h。取2 mL PPI共36份,分成6组,分别加入40%(m/V)赤藓糖醇0、0.625、1.25、2.5、3.75和5 mL,用蒸馏水补至10 mL,使其终质量分数分别为0、2.5%、5%、10%、15%和20%。处理2 h后,5000 r/min离心15 min,上清液定至25 mL。每组分别用1 mol/L HCl或1 mol/L NaOH调pH2.0、3.0、4.0、5.0和6.0。取0.5 mL测定吸光度,计算蛋白质含量。溶解性以每克总蛋白所含上清液中蛋白质的毫克数表示,mg/g;总蛋白含量采用凯氏定氮法。
1.2.3 持水性 5.00 g PPI溶于0.01 mol/L pH7.0磷酸缓冲液100 mL中。取5.00 mL PPI溶液共25份,分别加40%赤藓糖醇液0、0.625、1.25、2.5和5.00 mL,蒸馏水补至10.00 mL。处理2 h后,分别用1 mol/L HCl或1 mol/L NaOH调pH3.0、4.0、5.0、7.0和9.0,5000 r/min离心15 min,弃掉上清液,擦掉管壁多余水分,利用称量法[16]进行水分质量测定。
持水性(%)=W0/W1×100
式中:W0为水分质量,g;W1为蛋白质量,g。
1.2.4 乳化性 称取1.00 g PPI,溶于100 mL磷酸缓冲液。分别用0、2.5%、5%、10%、20%的赤藓糖醇处理2 h。准确量取8 mL,加2 mL菜籽油,2500 r/min磁力搅拌3 min后,即刻吸取底部乳浊液50 μL与3 mL SDS溶液中,以SDS溶液为空白,在500 nm 处测定其初始吸光值(A0)及10 min后吸光值(A10),计算乳化活性(EAI)及乳化稳定性(ESI)。
式中,N-稀释倍数(60);C-蛋白质质量浓度(g/mL);Φ-乳化液中油相体积分数(1/4);A0-0 min时吸光值;A10-10 min时吸光值;L-比色皿厚度,1 cm。
1.2.5 起泡性 准确称取1.00 g PPI,溶于100 mL磷酸缓冲液中。分别用0、2.5%、5%、10%、20%赤藓糖醇处理2 h,2500 r/min磁力搅拌2 min后,移入量筒中,记录其初始体积(V1),静置10 min后体积(V2)和总体积100 mL V总,计算起泡性及泡沫稳定性。


1.2.6 紫外光谱 1.00 g PPI溶于0.01 mol/L pH7.0磷酸缓冲液100 mL中,5000 r/min离心15 min,取上清液1 mL,分别加入40%赤藓糖醇0、0.625、1.25、2.5和5 mL,缓冲液补至10 mL。处理2 h后,进行紫外光谱扫描。
1.2.7 荧光光谱 1.00 g PPI溶于0.01 mol/L pH7.0磷酸缓冲液100 mL中,5000 r/min离心15 min,取上清液5 mL,分别加入40%赤藓糖醇0、0.625、1.25、2.5和5 mL,补至10 mL,使其终浓度分别为0、2.5%、5%、10%、15%和20%。处理2 h后,在激发波长280 nm、狭缝宽均为5 nm条件下,进行荧光光谱扫描[17]。
1.2.8 表面疏水性 用0.01 mol/L pH7.0磷酸缓冲液配成2% PPI溶液,5000 r/min离心15 min,取0.02、0.04、0.06、0.08和0.1 mL上清液,添加40%赤藓糖醇,使其质量分数分别为0、2.5%、5%、10%和20%,蒸馏水补至4 mL。加50 μL ANS溶液,8~15 min内测定荧光强度。激发和发射波长分别为350、496 nm,激发和发射狭缝宽均为5 nm条件下,以相对荧光强度对PPI质量分数作图,曲线初始阶段斜率为PPI表面疏水性指数[18]。以表面疏水性指数为纵坐标,赤藓糖醇质量分数为横坐标作图。
1.3 数据统计
采用SPSS 16.0进行ANOVA差异显著性分析(p<0.05)。采用0rigin7.5作图。
2 结果与讨论
2.1 PPI基本含量测定
采用凯氏定氮法测得豌豆粉蛋白含量为19.87%±0.09%,PPI蛋白含量为76.87%±0.29%。采用差值法测得水分含量为8.66%±0.06%,采用3,5-二硝基水杨酸法测得总糖含量为2.37%±0.01%。
2.2 赤藓糖醇对PPI溶解性的影响
不同质量分数赤藓糖醇对PPI溶解性的影响见图1。当不同质量分数赤藓糖醇处理PPI时,其溶解性均在pH4.0处最低,原因是PPI分子中酸性氨基酸比例明显占优,Asp含量10 g/100 g蛋白质,Glu含量20 g/100 g蛋白质[4],PPI等电点在pH4.0~5.0范围[19],此时蛋白质发生聚集而沉淀。在pH2.0、pH3.0和pH6.0时,PPI溶解性相对较高,原因是酸性或中性环境偏离了等电点pH4.0~5.0范围[20],增加了PPI解离程度,静电斥力增加,从而有利于PPI与水分子间形成离子-偶极作用,分散性更好,故溶解性增强。

图1 赤藓糖醇对PPI溶解性的影响Fig.1 Effects of erythritol on solubility of PPI
当赤藓糖醇质量分数在0~5%范围时,除pH3.0处理组外,其余各组PPI溶解性均随其质量分数增大而增加(p<0.05),原因是低质量分数的赤藓糖醇主要与蛋白质分子相互作用形成氢键,增强了蛋白质表面的水化层,因而减少了蛋白质分子间的相互作用,使PPI与水分子间作用力增强[20],故溶解性增大。当赤藓糖醇质量分数在0~5%范围时,pH3.0处理组则先降低后增加,原因有待进一步研究。当赤藓糖醇质量分数在5%~15%范围时,除pH2.0和pH3.0处理组外,其余各组PPI溶解性随其质量分数增加基本趋于稳定(p>0.05),但当继续增加赤藓糖醇质量分数时,PPI亲水能力逐渐占优,将不同程度破坏PPI表面水化层,溶解性又逐渐降低。pH3.0处理时,当赤藓糖醇质量分数在5%~15%范围时,均可提高PPI溶解性,这是因为赤藓糖醇多羟基可间接影响体系中水分子的结构,水分子结构的改变,进一步诱导蛋白质分子表面更加亲水[21],继续增大赤藓糖醇质量分数时,PPI溶解性逐渐下降。其余各pH处理组,随赤藓糖醇质量分数增加,均使PPI溶解性增加。
2.3 赤藓糖醇对PPI持水性的影响
赤藓糖醇对PPI持水性的影响见图2。蛋白质持水性本质是一种超分子水平作用,是溶胀、粘度增加和凝胶形成等物理化学综合作用的体现[22]。随赤藓糖醇质量分数增加,PPI持水性基本呈逐渐增大趋势,其中,pH3.0和pH9.0处理组显著增加(p<0.05),其余各组不显著(p>0.05)。pH3.0和pH9.0处理时,PPI持水性最高,原因是处于偏酸或偏碱环境时,PPI带正电荷或负电荷,同种电荷间相互排斥,更易于与溶剂水分子间产生相互作用。pH5.0时,各处理组持水性均最低。这是因为PPI等电点在pH4.0~5.0范围内[19],此时蛋白质分子净电荷接近零,缺乏蛋白质与水分子间的离子-偶极作用,从而持水性最低。

图2 赤藓糖醇对PPI持水性的影响Fig.2 Effects of erythritol on water holding power of PPI
2.4 乳化性
不同质量分数赤藓糖醇对PPI乳化性的影响见图3。当赤藓糖醇质量分数在0~10%范围时,PPI的乳化性及其稳定性均显著增加(p<0.05),随后继续增大赤藓糖醇质量分数时,PPI乳化性及其稳定性均保持平稳。这可能是赤藓糖醇增加了PPI乳液的表观粘度,使得乳液微粒间碰撞机会减少,因而PPI乳液的稳定性增强[17]。

图3 赤藓糖醇对PPI持水性的影响Fig.3 Effects of erythritol on emulsifying properties of PPI
2.5 起泡性
不同质量分数赤藓糖醇对PPI起泡性及其稳定性的影响见图4。当赤藓糖醇质量分数在0~5%范围时,起泡性随其含量增加而逐渐增加,随后继续增大赤藓糖醇含量至20%时,起泡性基本保持不变。起泡性的增加,可能是由于赤藓糖醇使PPI结构更加松散、柔性进一步增加所致。另外,表面疏水性的增加,有利于表面张力下降,因此增加了泡沫的形成能力[18]。当赤藓糖醇质量分数在0~20%范围内,泡沫稳定性始终保持稳定。

图4 赤藓糖醇对PPI泡沫性的影响Fig.4 Effects of erythritol on spumescence of PPI
2.6 赤藓糖醇对PPI表面疏水性的影响
不同质量分数赤藓糖醇对PPI表面疏水性的影响见图5。当赤藓糖醇质量分数在0~2.5%时,表面疏水性逐渐增加,在2.5%~10%范围时,表面疏水性显著增大(p<0.05),这表明赤藓糖醇并不主要与PPI通过氢键形成亲水层,即未增加蛋白质的水化作用,因而表面疏水性增强[23]。另一方面,受赤藓糖醇的影响,蛋白质分子表面的原子或基团结构可能发生重排,疏水性残基转至分子外部且排列较为聚集,形成了明显的疏水区域,相当于增加了其与ANS的结合位点[24-26],因而表面疏水性增强。当赤藓糖醇质量分数在10%~20%范围时,表面疏水性趋于稳定或略有下降,其原因是PPI空间结构已相当伸展而几乎彻底解折叠,其表面疏水残基开始与溶剂体系发生荧光猝灭现象[27]。

图5 赤藓糖醇对PPI表面疏水性的影响Fig.5 Effects of erythritol on surface hydrophobicity of PPI
2.7 赤藓糖醇对PPI紫外光谱二阶导数的影响
不同质量分数赤藓糖醇对PPI紫外二阶导光谱的影响见图6。由于PPI分子中Tyr和Trp残基均在280 nm附近有紫外吸收,普通紫外光谱法难以分辨叠加峰的相互影响,因此,选择导数光谱法可消除重叠光谱的干扰,有助于分析芳香族氨基酸微环境变化。在280~300 nm范围内有两个最大值(289、296 nm)和两个最小值(286、291 nm)。296 nm吸收峰是Trp残基特征性吸收峰。当不同质量分数的赤藓糖醇处理后,PPI紫外吸收峰发生1~2 nm蓝移,这说明处理后的Trp残基微环境更加亲水[28]。随赤藓糖醇质量分数增加,286、289 nm对应的谷-峰间纵向距离几乎未明显发生变化,但291、296 nm对应的谷-峰间纵向距离明显降低,当赤藓糖醇质量分数在0~10%范围时,291、296 nm对应的二阶导数值之比呈增加趋势,但当其质量分数继续增加时,二阶导数值之比呈减小趋势,这表明Tyr微环境由疏水逐渐变得更加亲水[28],与后续荧光光谱结论相一致。
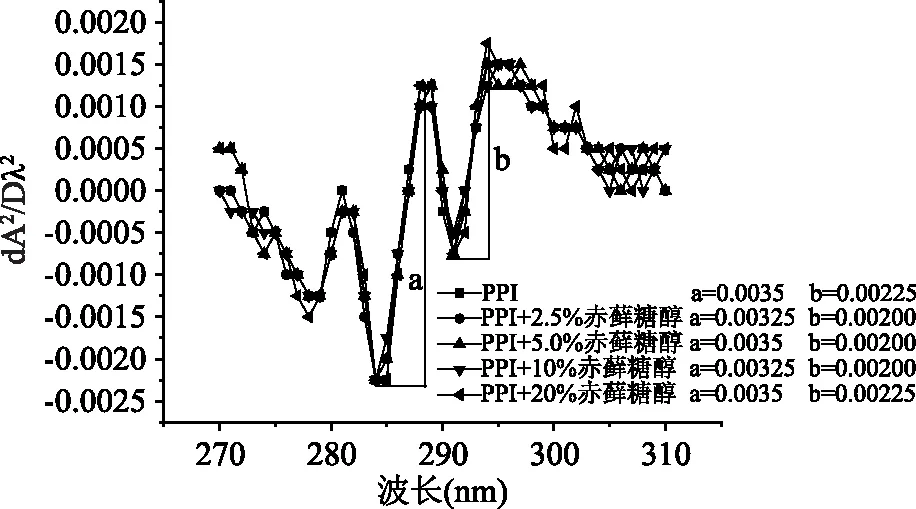
图6 赤藓糖醇对PPI紫外光谱的影响Fig.6 Effects of erythritol on ultraviolet spectrum of PPI
2.8 赤藓糖醇对PPI荧光光谱的影响
不同质量分数赤藓糖醇对PPI荧光光谱的影响见图7。荧光光谱激发波长为280 nm时,Phe不被激发,PPI最大荧光发射波长(λmax)为327 nm,可认为是PPI分子中Trp和Tyr残基的荧光发射峰[29]。但由于Trp到Tyr残基间发生能量转移,引起了Tyr残基荧光熄灭和Trp残基的荧光增强,因此,PPI荧光峰实际是Trp的荧光峰[30]。当赤藓糖醇质量分数在0~10%范围内,λmax从327nm逐渐增至330 nm,发生轻微红移,表明PPI原来包埋在分子内部非极性环境中的Trp或Tyr残基逐渐暴露于分子表面[31],其微环境极性增强,这可能是糖醇与PPI发生相互作用而促进其解聚造成的。但当赤藓糖醇质量分数增至20%时,λmax逐渐蓝移至327 nm,与未处理组λmax一致,原因是解聚的PPI分子通过疏水相互作用和氢键等分子间作用力,重新形成聚集体,同时,高质量分数赤藓糖醇的亲水能力较强,使Trp残基周围水分子减少,部分Trp残基又逐渐被包埋进分子内疏水微环境中[32-33]。当赤藓糖醇质量分数在0~2.5%范围内,荧光强度逐渐增加,进一步增大赤藓糖醇质量分数,荧光强度呈稳定趋势,这可能是已解聚的Tyr残基不断补充的结果。当继续增加赤藓糖醇质量分数至20%时,由于暴露的部分Trp残基与发生荧光猝灭的Trp部分达到平衡[35],而使荧光强度不再增大。

图7 赤藓糖醇对PPI荧光光谱的影响Fig.7 Effects of erythritol on fluorescence spectroscopy of PPI
3 结论与讨论
随赤藓糖醇质量分数增加,除pH3.0组外,其余各组PPI溶解性呈先增加后下降趋势,且均在pH4.0处最低,与表面疏水性变化并不完全一致。持水性逐渐增加,各处理组均在pH5.0处最低。表面疏水性呈先增加后趋于稳定趋势,疏水基团进一步暴露,荧光强度先逐渐增加后趋于稳定,且与表面疏水性呈正相关。
不同糖醇由于其结构和理化性质存在差异,对不同蛋白质溶解性的影响不同。由于溶解性较好的蛋白质,一般其表面存在相对较少的疏水性氨基酸残基,从而导致蛋白质表面疏水性降低。本实验中当赤藓糖醇质量分数小于15%时,除pH3.0处理组外,其余各组溶解性和表面疏水性保持一致,呈逐渐增加趋势,但当赤藓糖醇质量分数大于15%时,其溶解性和表面疏水性变化并不一致,这说明较高浓度糖醇质量分数对食品蛋白质溶解性具有较大影响。一般而言,糖醇可增加蛋白质持水力,本实验也证明了这一点。潘明喆[17]研究表明,甘露醇、山梨醇和木糖醇对大豆分离蛋白溶解性的影响有明显不同,三种糖醇均使大豆分离蛋白表面疏水性和荧光强度降低,作者认为,糖醇使蛋白质分子的Trp等疏水残基发生内裹作用,因而降低了表面疏水性和荧光强度,与本实验结论不一致。但王忠江[35]研究表明,Trp和Tyr残基的微环境变化,仍无法预测非变性状态下蛋白质表面疏水性变化,可能原因是非变性条件下,蛋白质三级结构并未发生类似于变性过程中的解折叠现象,疏水基团未彻底释放,而是逐渐卷曲为其它构象,使疏水残基得以“暴露”,这种“暴露”对表面疏水性的影响不具代表意义。
[1]Tömösközi S,Lásztity R,Haraszi R,et al. Isolation and study of the functional properties of pea proteins[J]. Nahrung,2001,45(6):399-401.
[2]Swiatecka D,Narbad A,Ridgway K P,et al. The study on the impact of glycated pea proteins on human intestinal bacteria[J]. International Journal of Food Microbiology,2011,145(1):267-272.
[3]De Almeida Costa G E,Da Silva Queiroz-Monici K,Pissini Machado Reis S M,et al. Chemical composition,dietary fibre and resistant starch contents of raw and cooked pea,common bean,chickpea and lentil legumes[J]. Food Chemistry,2006,94(3):327-330.
[4]蒋将,李开放,刘元法,等. pH偏移处理豌豆分离蛋白的胶凝性质[J]. 食品科学,2013,34(21):10-15.
[5]梁晗妮,唐传核. 豌豆蛋白的功能特性研究[J]. 现代食品科技,2012,28(12):1640-1644.
[6]李开放,蒋将,刘元法. 干燥方式对pH改性豌豆分离蛋白功能性和结构的影响[J]. 中国油脂,2014,39(3):74-78.
[7]Chanasattru W,Decker E A,Mcclements D J. Modulation of thermal stability and heat-induced gelation ofβ-lactoglobulin by high glycerol and sorbitol levels[J]. Food Chemistry,2007,103(2):512-520.
[8]Chanasattru W,Decker E A,Mcclements D J. Impact of cosolvents(polyols)on globular protein functionality:ultrasonic velocity,density,surface tension and solubility study[J]. Food Hydrocolloids,2008,22(8):1475-1484.
[9]Usha R,Raman S S,Subramanlan V,et al. Role of polyols(erythritol,xylitol and sorbitol)on the structural stabilization of collagen[J]. Chemical Physics,2006,430(4/5/6):391-396.
[10]Mcclements D J. Modulation of globular protein functionality by weakly interacting cosolvents[J]. Critical Reviews in Food Science and Nutrition,2002,42(5):417-471.
[11]王忠合,王军,李珍妮,等. 超声波处理对豌豆分离蛋白功能特性的影响[J]. 食品工业科技,2015,36(23):116-119.
[12]高圣君,茅俊. 赤藓糖醇对柠檬汁饮料中维生素C保护作用的研究[J]. 食品工业科技,2014,35(3):49-51.
[13]赵亚,张平平,王淑敏,等. 赤藓糖醇对南美白对虾肉玻璃化转变温度与状态图的影响[J]. 食品工业科技,2016,37(20):317-321.
[14]Miroljub B,Slavica C,Mirjana P,et al. Profile and functional properties of seed proteins from six pea(Pisumsativum)genotypes[J]. International Journal of Molecular Science,2010,11:4973-4990.
[15]李迎秋,陈正行. 高压脉冲电场对大豆分离蛋白功能性质的影响[J]. 农业工程学报,2006,22(8):194-198.
[16]古扎努尔·艾斯卡尔. 表面活性剂对大豆分离蛋白及其水解物物化特性影响的研究[D]. 杭州,浙江大学,2014.
[17]潘明喆. 环境因素和糖醇化合物对大豆蛋白结构和功能特性的影响[D]. 沈阳:沈阳农业大学,2016.
[18]潘明喆,李斌,孟宪军. 木糖醇对大豆分离蛋白结构和起泡特性的影响[J]. 食品科学,2016,37(15):63-68.
[19]沙金华. 豌豆分离蛋白的制备、性质及应用研究[D]. 无锡:江南大学,2009.
[20]Semenova M G,Antipova A S,Belyakova L E. Food protein interactions in sugar solutions[J]. Current Opinion in Colloid and Interface Science,2002,7(5/6):438-444.
[21]Antipova A S,Semenova M G. Influence of sucrose on the thermodynamic properties of the 11S globulin of Vida faba-dextran-aqueous solvent system[J]. Food Hydrocolloids,1997,11(4):415-421.
[22]华欲飞,顾玉兴. 大豆蛋白的吸水和持水性能[J]. 中国油脂,1999,24(4):64-67.
[23]Guzey D,Mcclements D J,Weiss J. Adsorption kinetics of BSA at air-sugar solution interfaces as affected by sugar type and concentration[J]. Food Research International,2003,36(7):649-660.
[24]Raibekas A A,Massey V. Glycerol-assisted restorative adjustment of flavoenzyme conformation perturbed by site-directed mutagenesis[J]. Journal of Biological Chemistry,1997,272(35):22248-22252.
[25]Sahu R K,Prakash V. Mechanism of prevention of
aggregation of proteins:a case study of aggregation of α-globulin in glycerol[J]. International Journal of Food Properties,2008,11(3):613-623.
[26]张涛,江波,王璋. 鹰嘴豆分离蛋白的特性[J]. 食品与生物技术学报,2005,24(3):66-71.
[27]蔡建周,张武. 光谱法研究聚赖氨酸与纤维蛋白原的相互作用[J]. 光谱学与光谱分析,2017,37(1):166-171.
[28]Lange R,Balny C. UV-visible derivative spectroscopy under high pressure[J]. Biochimica et Biophysica Acta,2002,1595(1-2):80-93.
[29]Zhang J,Liang L,Tian Z,et al. Preparation andinvitroevaluation of calcium-induced soy protein isolate nanoparticles and their formation mechanism study[J]. Food Chemistry,2012,133(2):390-399.
[30]Kalapathy U,Hettlarachchy N S,Rhee K C. Effect of drying methods on molecular properties and functionalities disulfide bond-cleaved soy proteins[J]. Journal of the American Oil Chemist Society,1997,74(3):195-199.
[31]Chen H,Wu F,Xiang D,et al. Characterization of emulsions prepared by egg yolk phosvitin with pectin,glycerol and trehalose[J]. Food Hydrocolloids,2013,30(1):123-129.
[32]黄友如,华欲飞,卢祥云,等. 脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用的荧光光谱分析[J]. 食品科学,2008,29(5):134-139.
[33]魏冬旭,江连洲,王辰,等. pH对大豆11S球蛋白结构和表面疏水性的影响[J]. 食品科学,2015,36(11):1-5.
[34]葛辉. 亚临界水对酪蛋白及其与乳糖体系结构和性质的影响[D]. 南昌:南昌大学,2014.
[35]王中江,江连洲,魏冬旭,等. pH对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学,2012,33(11):47-51.
