多壁碳纳米管固相萃取/气相色谱质谱测定蔬菜中的苯醚甲环唑农药残留
2018-05-01张彦军周鑫魁柴宗龙王杰斌袁彩霞贾亚莉钱滢文
张彦军,洪 霞,周鑫魁,柴宗龙,王杰斌,袁彩霞,贾亚莉,钱滢文,*
(1.甘肃省商业科技研究所有限公司,甘肃兰州 730010; 2.甘肃中商食品质量检验检测有限公司,甘肃兰州 730010)
苯醚甲环唑又名恶醚唑,是一种三唑类杀真菌剂,在三唑类杀菌剂中占有极重要的地位,已经成为蔬菜种植中使用最广泛的杀菌剂之一。其内吸性强,杀菌谱广,通过抑制麦角甾醇(构成细胞膜的重要成分,对细胞膜的渗透性起重要作用)的生物合成,破坏细胞膜结构功能,从而达到杀菌目的,对蔬菜多种真菌性病害具有很好的保护和治疗作用[1-2]。苯醚甲环唑残留于蔬菜中通过食用进入人体,累积后可能会危害人体健康。Li等[3]用荧光光谱法测定了苯醚甲环唑与人血清白蛋白的结合作用,结果表明在37 ℃条件下苯醚甲环唑与人血清白蛋白结合率高,造成血液中苯醚甲环唑浓度增大,导致血液中毒。刘永霞等[4]对80只大鼠分组连续90 d每天经口灌胃染毒苯醚甲环唑后,动物体重降低,肝及肾组织增大。Mu等[5]将斑马鱼胚胎暴露于苯醚甲环唑水溶液中,研究了苯醚甲环唑对斑马鱼胚胎发育的影响。实验结果表明,苯醚甲环唑在斑马鱼胚胎的发育过程中引起了心率下降、自主运动异常、生长抑制以及多种致畸作用等一系列的不良影响。因此,建立简单、快速、准确、可靠测定蔬菜中苯醚甲环唑残留量的检测方法,对于保护食用者健康具有重要的意义。目前蔬菜中苯醚甲环唑残留量的检测方法有气相色谱(GC)[6],气相色谱-质谱法(GC-MS)[7-8]和液相色谱-质谱法(HPLC-MS)[9-10]等。毛久浪等[11]采用气相色谱电子捕获器检测(GC-ECD)毛豆样品中苯醚甲环唑的残留,结果证明苯醚甲环唑主要残留在毛豆荚中,去荚可降低毛豆仁苯醚甲环唑残留的风险。王远等[12]建立HPLC-MS检测蔬菜中苯醚甲环唑残留的分析方法,结果显示苯醚甲环唑质量浓度在0.001~0.5 μg/mL范围内线性关系良好,检出限为 0.001 mg/kg。薄海波[13]建立GC-MS法测定水果和蔬菜中苯醚甲环唑残留的分析方法,检出限为0.005 mg/kg,方法灵敏度高,选择性好,抗干扰能力强,适合苯醚甲环唑残留量的定性确证分析和定量分析。
多壁碳纳米管(MWCNTs)作为一种新型前处理净化吸附材料,具有机械强度高、表面积大、吸附能力强、耐热性好和pH适用范围宽等特点,可有效去除色素和疏水性物质[14],适用于固相萃取[15]、固相微萃取[16]和分散性固相萃取[17]等技术,应用于水质[18]、环境污染物[19]、农药残留[20]和兽药残留[21]等的检测。目前国内外对蔬菜中苯醚甲环唑农药残留的检测研究主要集中在氧化铝[7]、石墨化碳黑[22]和硅酸镁[23]等方面,对MWCNTs应用于蔬菜中苯醚甲环唑农药残留检测的报道较少。因此,本文研究了MWCNTs固相萃取柱对蔬菜基质的净化效果,以期建立GC-MS法检测了蔬菜中的苯醚甲环唑农药残留的方法,以达到简单、快速、准确的检测苯醚甲环唑农药残留的目的。
1 材料与方法
1.1 材料与仪器
无水硫酸镁 分析纯,使用前650 ℃下灼烧4 h,备用,天津市凯信化学工业有限公司;乙酸乙酯 色谱纯,赛默飞世尔科技(中国)有限公司;二氯甲烷 色谱纯,山东禹王实业有限公司化工分公司;乙腈 色谱纯,北京百灵威科技有限公司;丙酮 色谱纯,西陇科技股份有限公司;多壁碳纳米管(MWCNTs) 直径20~40 nm,长度:1~2 μm,纯度:≥95%,深圳纳米港有限公司;氦气 纯度:99.999%,中国科学院兰州化学物理研究所;丙酮中苯醚甲环唑溶液标准物质(GBW(E)081913) 浓度为100 μg/mL,北京海岸鸿蒙标准物质技术有限责任公司;芹菜、番茄、黄瓜、花椰菜、金针菇、韭菜、菠菜、大白菜、茄子和结球甘蓝等样品 每种10个共80批次,随机购于市场及超市。
7890A-5975C气相色谱-质谱联用仪 美国安捷伦科技有限公司;KS260控制型圆周振荡摇床 艾卡仪器设备有限公司;RJ-TDL-60B离心机 无锡市瑞江分析仪器有限公司;JJ500电子天平 常熟市双杰测试仪器厂;固相萃取空管柱 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 样品的提取与净化 称取5.00 g蔬菜可食部分粉碎后的样品于50 mL带盖的聚丙烯离心管中,准确加入10 mL乙酸乙酯溶液,再加入适量无水硫酸镁,振荡30 min,于3000 r/min离心1 min,用注射器吸取1.0 mL乙酸乙酯上清液待净化。将10 mg MWCNTs和150 mg无水硫酸镁用研钵研细,填入固相萃取空管柱。将吸有1.0 mL乙酸乙酯上清液的注射器与MWCNTs净化柱连接,向下推至进样瓶,然后向上吸至注射器,再向下推收集于进样瓶,供GC-MS分析。
1.2.2 萃取条件的优化
1.2.2.1 萃取溶剂的选择 以黄瓜和结球甘蓝为基质添加0.1 μg/mL苯醚甲环唑标准溶液按照1.2.1步骤处理,考察乙酸乙酯、乙腈和二氯甲烷等不同萃取溶剂对样品中苯醚甲环唑回收率的影响。
1.2.2.2 MWCNTs量的优化 MWCNTs的用量影响净化效果和回收率,为了获得最佳的净化效果及回收率,按1.2.1过程在黄瓜和样结球甘蓝品中添加浓度为0.1 μg/mL苯醚甲环唑,分别以5、8、10、12以及15 mg MWCNTs和150 mg无水硫酸镁填充固相萃取柱,观察不同用量MWCNTs对乙酸乙酯提取液的净化效果和比较不同用量MWCNTs对回收率的影响。
1.2.3 标准溶液的配制 准确移取1 mL 100 μg/mL的苯醚甲环唑标准品溶液至10 mL容量瓶中,用丙酮定容,配成10 μg/mL的标准储备液,吸取以上标准储备液适量,并用丙酮稀释至质量浓度为0.005、0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0 μg/mL系列标准溶液。
1.2.4 气相色谱条件 DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度260 ℃;升温程序:初始温度70 ℃保持5 min,以25 ℃/min升至150 ℃;以3 ℃/min升至200 ℃,再以8 ℃/min升至280 ℃,保持10 min;进样量1.0 μL,不分流进样。
1.2.5 质谱条件 EI电离源,电离电压70 eV;离子源温度230 ℃;四极杆温度150 ℃;传输线温度280 ℃;溶剂延迟:5 min;选择监测离子:定量离子m/z 323;定性离子m/z 325,325,265,267。
1.2.6 加标回收实验 采用对阴性样品进行加标回收实验来考察方法的准确度和精密度,即对本底不含苯醚甲环唑的黄瓜、结球甘蓝、番茄和韭菜样品,分别添加相当于0.01、0.10和1.00 μg/mL的苯醚甲环唑标准溶液,每个添加水平做5个平行样,连续重复进样5次,计算回收率和相对标准偏差。
1.2.7 实样分析 利用本方法按1.2.1样品处理步骤对芹菜、番茄、黄瓜、花椰菜、金针菇、韭菜、菠菜、大白菜、茄子和结球甘蓝等10种80个代表性蔬菜样品进行定性定量分析。
1.3 数据处理
萃取溶剂的选择、加标回收率和实样分析数据均采用Excel软件进行计算分析,MWCNTs量的优化和线性范围采用Origin8.5软件进行计算分析。
2 结果与分析
2.1 萃取溶剂的选择
对乙酸乙酯、乙腈和二氯甲烷提取苯醚甲环唑5平行效果进行了比较。由表1可知,回收率在97.3%~99.5%之间,说明以上3种有机溶剂对苯醚甲环唑的提取具有良好的效率。对于含色素较高结球甘蓝样品经二氯甲烷溶剂提取后,在苯醚甲环唑出峰位置处或附近有干扰现象。而经乙酸乙酯提取样品选择性好,干扰少,且乙腈和二氯甲烷溶剂毒性较强,因此本研究选择乙酸乙酯溶剂作为提取溶剂。
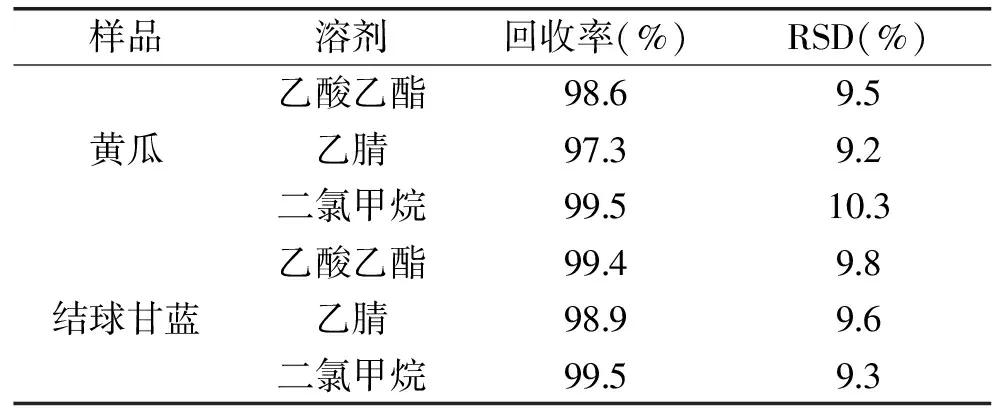
表1 蔬菜中苯醚甲环唑在0.1 μg/kg添加水平下的平均回收率及其相对标准偏差(n=5)Table 1 Average recoveries and the RSD of difenoconazole at 0.1 μg/mL spiked in vegetables(n=5)
2.2 MWCNTs量的优化
实验结果显示,随MWCNTs用量增加,乙酸乙酯提取液的颜色逐渐变浅,几乎接近于纯乙酸乙酯颜色,说明MWCNTs对于提取液中干扰物具有良好的吸附性,且随碳纳米管量的增加净化效果越好。
由图1可知,在结球甘蓝和黄瓜基质中苯醚甲环唑回收率分别为73.5%~96.4%和75.7%~97.9%,呈先增大后降低的趋势,当MWCNTs的量达到10 mg时回收率最高。综合净化效果和回收率,本研究选择10 mg MWCNTs的量填充固相萃取柱净化提取液。
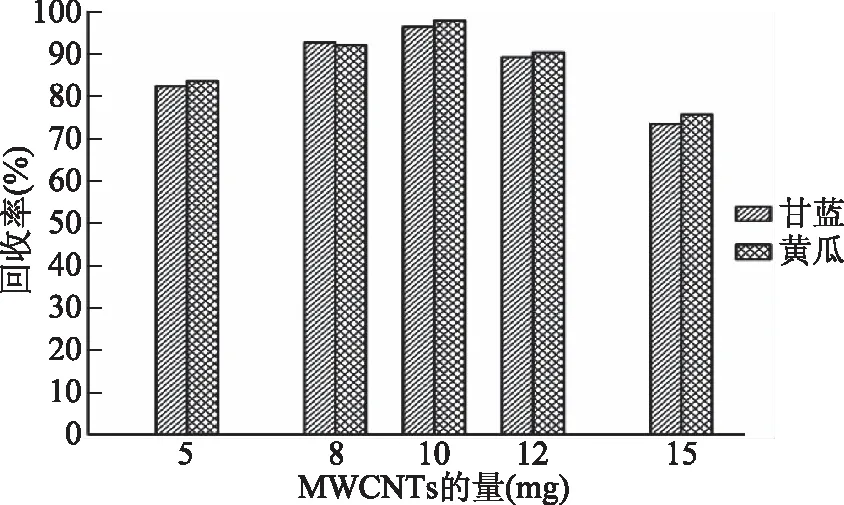
图1 不同MWCNTs米管用量对方法回收率的影响Fig.1 Effects of amount of MWCNTs on method recoveries
2.3 线性范围和检出限
取1.2.3配制的苯醚甲环唑系列标准工作液,在最佳的实验条件下测定,苯醚甲环唑的保留时间为9.752 min,苯醚甲环唑标准溶液的总离子流色谱图和扫描质谱图,分别见图2和图3。以进样质量浓度为横坐标、峰面积为纵坐标(如图4所示),得到标准曲线Y=157086X+922,相关系数r=0.9997,在0.005~2.0 μg/mL范围内线性关系良好,以3倍信噪比(S/N=3)确定检出限为0.001 mg/kg,以10倍信噪比(S/N=10)定量限为0.003 mg/kg,满足残留定量分析要求。
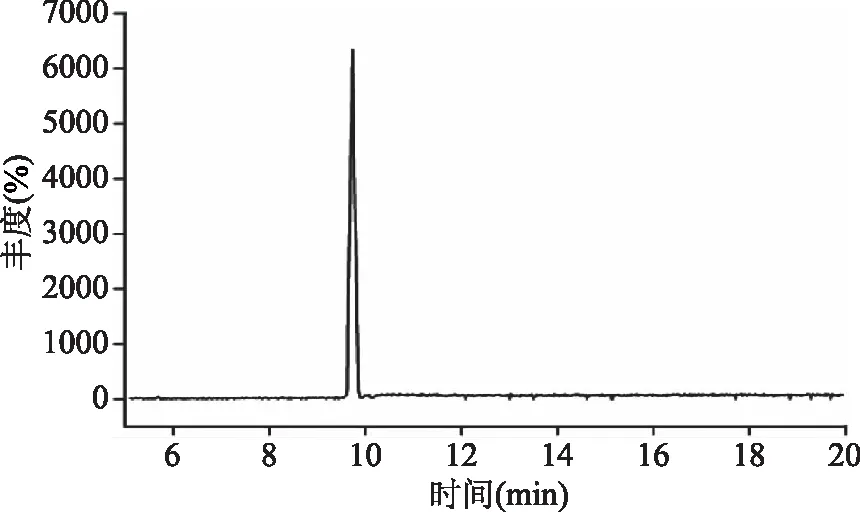
图2 苯醚甲环唑标准溶液(0.1 μg/mL)的总离子流图Fig.2 Total ion chromatogram of difenoconazole standard solution(0.1 μg/mL)
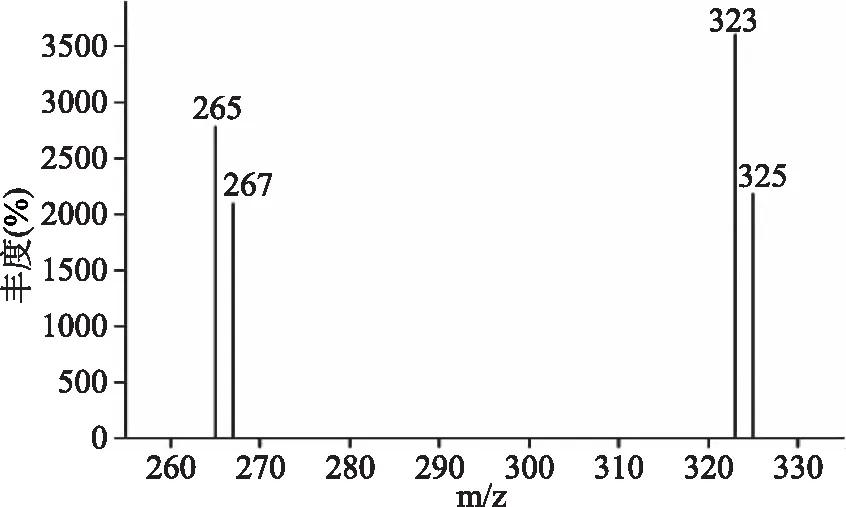
图3 苯醚甲环唑标准溶液(0.1 μg/mL)的扫描质谱图Fig.3 Mass spectrum of difenoconazole standard solution(0.1 μg/mL)
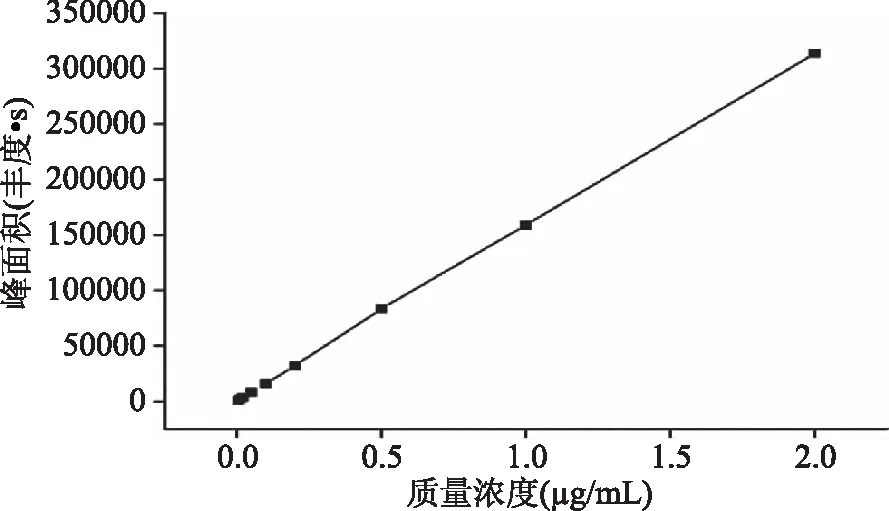
图4 苯醚甲环唑标准曲线Fig.4 The standard curve of the difenoconazole
2.4 回收率和精密度
由表2可知,3个添加水平的回收率在84.2%~111.3%的范围内,相对标准偏差介于5.3%~11.9%之间,表明此方法具有较高的准确度和精密度。因此,实验中开发的方法满足苯醚甲环唑残留分析的要求,可用于黄瓜、结球甘蓝、番茄和韭菜等样品中苯醚甲环唑农药残留的检测。
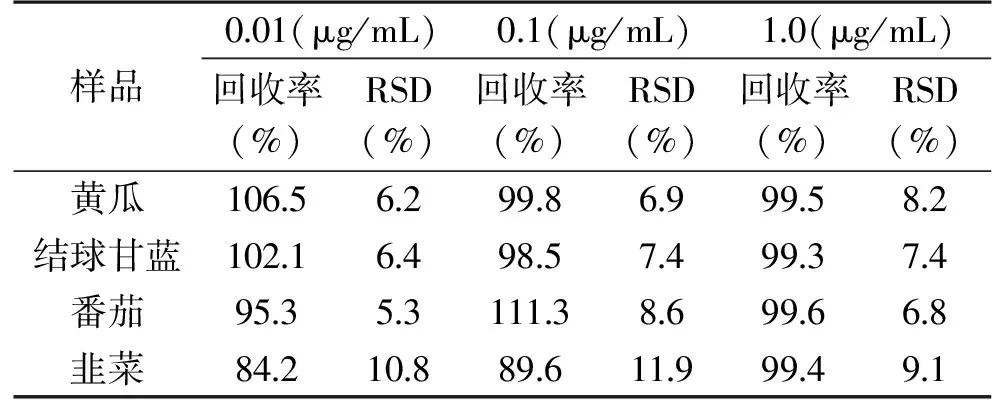
表2 蔬菜中苯醚甲环唑在3个添加水平下的平均回收率及其相对标准偏差(n=5)Table 2 Average recoveries and the RSD of difenoconazole at three spiked levels in vegetables(n=5)
2.5 实样分析
由表3可知,其中番茄、黄瓜和结球甘蓝等5个样品检出苯醚甲环唑残留,其余样品均未检出苯醚甲环唑农药残留,对检出样品5平行检测,苯醚甲环唑含量在0.0407~0.4699 mg/kg之间。根据GB2763-2016[24]检出样品均未超过国家食品安全标准要求。
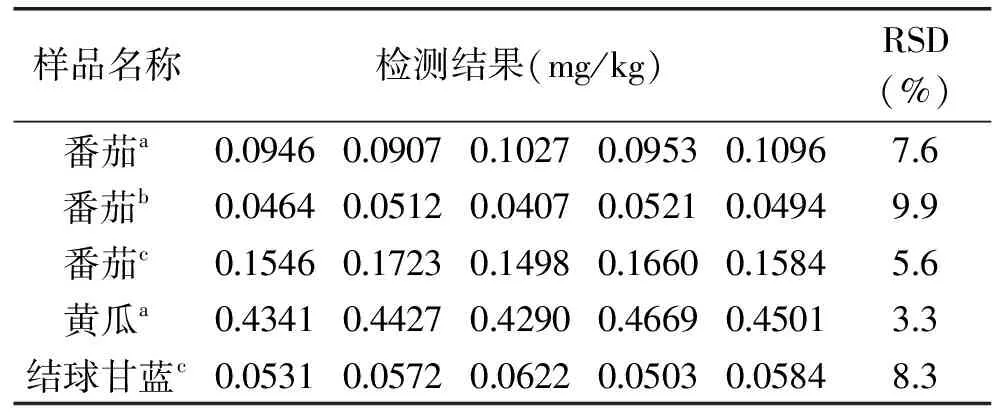
表3 实样检测结果Table 3 Sample test results
3 结论
建立了以MWCNTs作为固相萃取柱吸附剂,应用于蔬菜样品前处理中,联合GC-MS检测蔬菜中苯醚甲环唑农药残留量的方法,方法的线性范围为0.005~2.0 μg/mL,相关系数为0.9997,检出限和定量限分别为0.001和0.003 mg/kg,样品加标回收率为84.2%~111.3%,应用于实样检测,检出苯醚甲环唑残留样品的RSD介于3.3%~9.9%之间。该方法具有操作步骤简单、节省时间、溶剂消耗量少、净化效果好和检出限低等优点,能够满足蔬菜中苯醚甲环唑农药残留的检测要求。
[1]华乃震. 杀菌剂苯醚甲环唑的进展和应用[J]. 世界农药,2013,35(6):7-12.
[2]何永新. 10%苯醚甲环唑等4种药剂防治西瓜炭疽病药效实验[J]. 南方园艺,2016,27(2):44-45.
[3]Li Y,Ma X R,Lu G H. Systematic investigation of the toxic mechanism of difenoconazole on protein by spectroscopic and molecular modeling[J]. Pesticide Biochemistry and Physiology,2013,105(3):155-160.
[4]刘永霞,戈扬,李岩,等. 苯醚甲环唑原药的亚慢性毒性研究[J]. 中国职业医学,2007,34(1):67-68.
[5]Mu X Y,Chai T T,Wang K,et al. Occurrence and origin of sensitivity toward difenoconazole in zebrafish(Danio reio)during different life stages[J]. Aquatic Toxicology,2015,160:57-68.
[6]徐颖洁. SPE-GC-μECD测定蔬菜中6种三唑类农药的残留量[J]. 安徽农业科学,2014,42(18):5813-5815.
[7]沈伟健,杨雯筌,沈崇钰,等. 气相色谱-负化学离子源质谱法检测食品中苯醚甲环唑的残留量[J]. 色谱,2007,25(3):418-421.
[8]钱宗耀,周晓龙,刘河疆,等. 气质联用法测定红枣中苯醚甲环唑残留量[J]. 现代农药,2012,11(3):37-39.
[9]Kong Z Q,Dong F S,Xu J,et al. Determination of difenoconazole residue in tomato during home canning by UPLC-MS/MS[J]. Food Control,2012,23(2):542-546.
[10]王雯,梁颖,钱建亚,等. 液相色谱-质谱联用检测番茄中苯醚甲环唑残留[J]. 江苏农业学报,2011,27(3):668-671.
[11]毛久浪,王珏,毛晨蕾,等. QueCHERS法检测毛豆中苯醚甲环唑的残留量[J]. 浙江农业科学,2013,46(10):1335-1337.
[12]王远,邢丽杰,郝家勇,等. 高效液相色谱-串联质谱法测定蔬菜中苯醚甲环唑的残留量[J]. 食品科学,2011,32(18):296-299.
[13]薄海波. 水果和蔬菜中苯醚甲环唑残留量的气相色谱-串联质谱测定方法研究[J]. 青海师范大学学报:自然科学版,2014,30(1):56-59.
[14]Yu F,Chen L,Pan L,et al. Determination of multi-pesticide residue in tobacco using multi-walled carbon nanotubes as a reversed-dispersive solid-phase extraction sorbent[J]. Journal of separation science,2015,38(11):1894-1899.
[15]Lidia M R,Javier H B,Migue A R,et al. Multi-walled carbon nanotubes as efficient solid-phase extraction materials of organophosphorus pesticides from apple,grape,orange and pineapple fruit juices[J]. Journal of Chromatography A,2008,1211(1):33-42.
[16]Song X Y,Shi Y P,Chen J,et al. Development and Application of Porous Membrane-Protected Carbon Nanotube Micro-Solid-Phase Extraction Combined with Gas Chromatography/Mass Spectrometry[J]. Food Chemistry,2013,139(1-4):246-252.
[17]Zhao H D,Li N Y,Li J W,et al. Preparation and application of chitosan-grafted multiwalled carbon nanotubes in matrix solid-phase dispersion extraction for determination of Trace acrylamide in foods through high-performance liquid chromatography[J]. Food Analytical Methods,2015,8(5):1-9.
[18]Sheng G D,Alsaedi A,Shammakh W,et al. Enhanced sequestration of selenite in water by nanoscale zero valent iron immobilization on carbon nanotubes by a combined batch,XPS and XAFS investigation[J]. Carbon,2016,99:123-130.
[19]Rocha R P,Silva A M,Romero S M,et al. The role of O-and S-containing surface groups on carbon nanotubes for the elimination of organic pollutants by catalytic wet air oxidation[J]. Applied Catalysis B:Environmental,2014,147:314-321.
[20]Dehghani M H,Niasar Z S,Mehrni M R,et al. Optimizing the removal of organophosphorus pesticide malathion from water using multi-walled carbon nanotubes[J]. Chemical Engineering Journal,2017,310(1):22-32.
[21]Hou X L,Wu Y L,Yang T,et al. Multi-walled carbon nanotubes-dispersive solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for the analysis of 18 sulfonamides in pork[J]. Journal of Chromatography B,2013,929:107-115.
[22]Li J,Dong F S,Cheng Y X,et al. Simultaneous enantioselective determination of triazole fungicide difenoconazole and its main chiral metabolite in vegetables and soil by normal-phase high-performance liquid chromatography[J]. Analytical and Bioanalytical Chemistry,2012,404(6):2017-2031.
[23]Kong Z Q,Dong F S,Xu J,et al. Determination of difenoconazole residue in tomato during home canning by UPLC-MS/MS[J]. Food Control,2012,23(2):542-546.
[24]中华人民共和国卫生和计划生育委员会,中华人民共和国农业部,国家食品药品监督管理总局. GB2763-2016食品安全国家标准食品中农药最大残留限量[S]. 北京:中国标准出版社,2016.
