静息态fMRI对抑郁症伴嗅觉功能减退患者功能连接的研究
2018-04-27蔡秋艺谢俊诗杨德雨胡良波
蔡秋艺 谢俊诗 邹 瑜 杨德雨 王 杰 胡良波
抑郁症是临床常见的精神类疾病,大量神经影像学证据提示抑郁症患者和正常人的各脑区特别是与情绪调控相关的大脑边缘系统存在明显差异,其发病机制目前尚未有明确的阐述。近年来有部分学者认为嗅觉异常可能是精神性疾病的一种认知标记[1],而抑郁群体和嗅觉障碍也存在着相互联系[2]。抑郁症患者出现嗅觉障碍的概率约为28%[3]。嗅觉障碍的患者发生抑郁症发病率约40%~76%[4]。嗅觉障碍和抑郁症状的出现,两者因果关系以及发生机制仍不明确。
功能连接(functional connectivity,FC)能反映大脑脑区之间的波动和反应[5],现在临床和科研上被广泛运用,但应用功能磁共振方法对静息状态下抑郁症患者大脑嗅觉区功能连接的研究较少。我们假设伴有嗅觉减退的抑郁症患者较不伴嗅觉减退的抑郁症患者存在特有的大脑异常功能连接。本研究运用FC探讨抑郁症患者嗅觉脑区连接差异并分析差异原因。
方 法
1.研究对象
抑郁症患者均来自于2016年2月-2017年7月于我院就诊的患者共37例,正常对照组来自于38名成人志愿者。所有受试者均签署知情同意书后接受汉密尔顿(HDRS)-24项量表、汉密尔顿焦虑量表(HAMA)、简明智力状态检查量表(MMSE)测试,并由两名以上有经验的精神科医生鉴定。病例组纳入标准:①符合美国精神障碍诊断与统计手册第5版(DSM-V)诊断标准;②年龄范围于18~45岁;③汉密尔顿抑郁量表(HDRS)-24项评分>20分;④首次发病或者有2周以上的药物消除期。NC组纳入标准:①年龄范围于18~45岁;②汉密尔顿抑郁量表(HDRS)-24项评分<8分;③无创伤、精神病史及精神病家族史;④未接受任何精神类药物使用史以及药物、酒精滥用史;⑤嗅觉测试正常。所有受试者排除标准:①DSM-V诊断为其他精神病;②目前在使用抗精神病药物治疗;③近期2周有呼吸道疾病史;④由五官科医生检查后发现有鼻炎或者鼻窦异常等;⑤有其余精神病史、神经系统疾病或者严重颅脑损伤史;⑥汉密尔顿焦虑量表(HAMA)>14分,简明智力状态检查量表(MMSE)<27分; ⑦妊娠;⑧左利手;⑨幽闭恐惧或其他不能行磁共振检查者。
检查方法
2.嗅觉测试
采用“异丙醇吸入试验测试法”,所有受试者均被嘱闭目、闭口,用70%异丙醇试纸置于受试者鼻下约30cm处,要求患者平静呼吸,每呼吸一次,将试纸向鼻腔靠近1cm,直至受试者嗅到异丙醇,测试鼻尖至试纸的距离,连测4次取平均值。<10cm为失嗅,15~10cm为嗅觉减退,>15cm为嗅觉正常[6-7]。
根据嗅觉测试结果,将抑郁症患者分为两组:抑郁症患者伴有嗅觉障碍组(抑郁症a组);抑郁症患者不伴嗅觉障碍或嗅觉障碍不明显组(抑郁症b组)
3.MRI图像采集
采 用 SIEMENS 3.0T磁 共 振(SIEMENS MAGNETOM Verio Dot),固定受试者头部,采用12通道头线圈,结构成像序列参数为:TR=2300ms,TE=2.27ms,矩阵为 256×256,体素为1mm×1mm×1mm,层厚为1mm,层间距为0,FOV=250mm,共192层。静息态功能磁共振BOLD信号通过EPI扫描,功能磁共振参数为:TR=3000,TE=30ms,矩阵为3×3,层厚为3mm,层间距为0,反转角=90°。
4.图像数据后处理
本次研究使用Matlab 12.0a版本的DPARSF 2.3版本软件对图像数据进行处理,功能像数据预处理 使 用 SPM8(Statistical Parametric Mapping,http://www.fil.ion.ucl.ac.uk/spm)。预处理步骤包括,去除前10个时间点,消除磁场不均匀性;时间层校正,消除层间扫描时间差异,时间层校正选取中间层作为参考层;头动校正,消除由于被试头动造成的信号改变,头动校正选取第一个时间点作为参考点;标准化个体被试到MNI空间,通过将T1结构像分割为灰质、白质、脑脊液,运用DARTEL[8](diffeomorphic anatomical registration through exponentiated Lie algebra)方法,配准个体被试到标准空间并重采样至3mm×3mm×3mm。同时将白质、脑脊液,以及头动参数作为协变量回归。为进一步提高减小配准误差,对标准空间中的被试使用FWHM为6mm的高斯核进行平滑操作,之后将数据去线性漂移。由于只关注低频段信号意义,对最终数据进行0.01~0.08Hz的带通滤波。使用球形感兴趣区(regions of interest ROIs)的定位方法对杏仁核的时间序列进行提取,杏仁核的MNI坐标定位于(±20,-3,-16),半径为5[9],以左、右杏仁核的时间序列与全脑时间序列进行相关分析,将头动参数、白质以及脑脊液信号作为协变量去除影响,然后将这些相关系数利用Fisher’s-to-z转换为z值。
5.统计学分析
采用SPSS 22.0软件对数据进行统计学分析,分析前对临床资料数据进行正态性分布以及方差齐性检验,计量资料以均数标准差(±s)表示。fMRI数据以AlphaSim进行校正(single voxel P=0.005,simulations=5000),三个组两两组间使用SPM8软件包进行两独立样本t检验,以年龄、性别及受教育年限等做协变量,对比组间各ROI功能连接差异,使用REST软件包对有无嗅觉差异的抑郁症组间的脑功能连接同嗅觉测试距离结果进行相关性分析。
结 果
1.一般临床资料
本研究发现各组在年龄、性别及受教育年限上无统计学差异,但抑郁症组的嗅觉测试距离、HDRS得分以及HAMA得分跟正常对照组相比,有统计学差异(P<0.05)。抑郁症a组和抑郁症b组在病程,HDRS得分以及嗅觉测试距离存在统计学差异(P<0.05)。详见表 1。

表1 一般临床资料

表2 以左侧杏仁核为ROI显示的抑郁症组间不同的大脑静息态功能连接
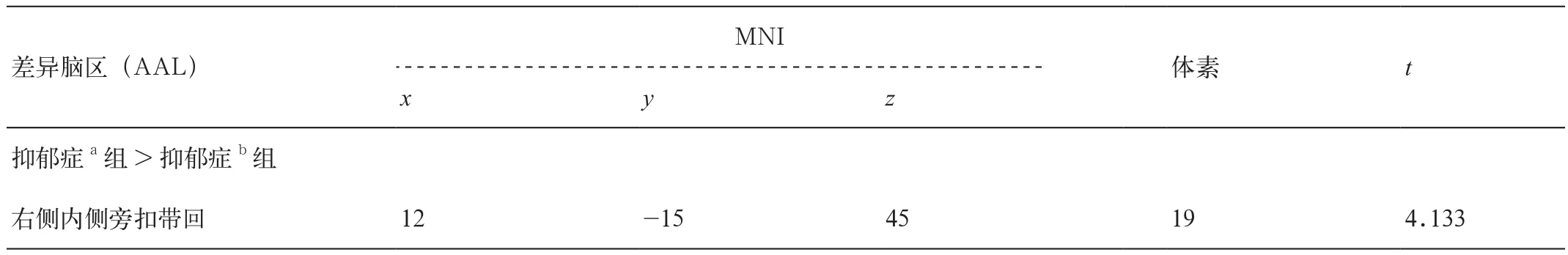
表3 以右侧杏仁核为ROI显示的抑郁症组间不同的大脑静息态功能连接
2.抑郁症患者以杏仁核为种植点的结构-皮质的功能连接
抑郁症患者(抑郁症a组同抑郁症b组)同正常对照组比较,左侧杏仁核与右侧梭状回、左侧颞下回、左侧中央后回、左侧中央前回、双侧内侧旁扣带回功能连接减弱(AlphaSim校正,P<0.005,体素>12,阈值P<0.05),未发现功能连接增强区域。抑郁症a组同抑郁症b组比较,左侧杏仁核与右侧丘脑、右侧内侧旁扣带回功能连接减弱,但是与左侧距状回、右侧岛叶、左侧颞上回、右侧中央沟盖、左侧楔叶、左侧内侧旁扣带回、双侧中央前回、右侧额中回、左侧补充运动区、Cerebelum_Crus1_R功能连接增强(AlphaSim校正,P<0.005,体素>9,阈值P<0.05)(表 2,图 1)。
抑郁症患者(抑郁症a组同抑郁症b组)同正常对照组比较,右侧杏仁核与右侧颞下回、左侧颞上回、左侧三角部额下回、左侧内侧旁扣带回、左侧中央前回、左侧中央后回、右侧中央旁小叶功能连接减弱,左侧海马功能连接增强(AlphaSim校正,P<0.005,体素>14,阈值P<0.05)。抑郁症a组同抑郁症b组比较,右侧杏仁核与右侧内侧旁扣带回功能连接增强,未发现功能连接减弱的区域(AlphaSim校正,P<0.005,体素 >12,阈值P<0.05)(表 3,图2)。
3.嗅觉相关分析
抑郁症a组嗅觉测试值与HDRS-24量表评分呈负相关性(r=-0.519, P=0.033),抑郁症a组左侧杏仁核与左侧颞上回(r=-0.603, P=0.038)、左侧楔叶(r=-0.671, P=0.017)以及 Cerebelum_Crus1_R(r=-0.608, P=0.036)功能连接与嗅觉测试距离呈负相关。
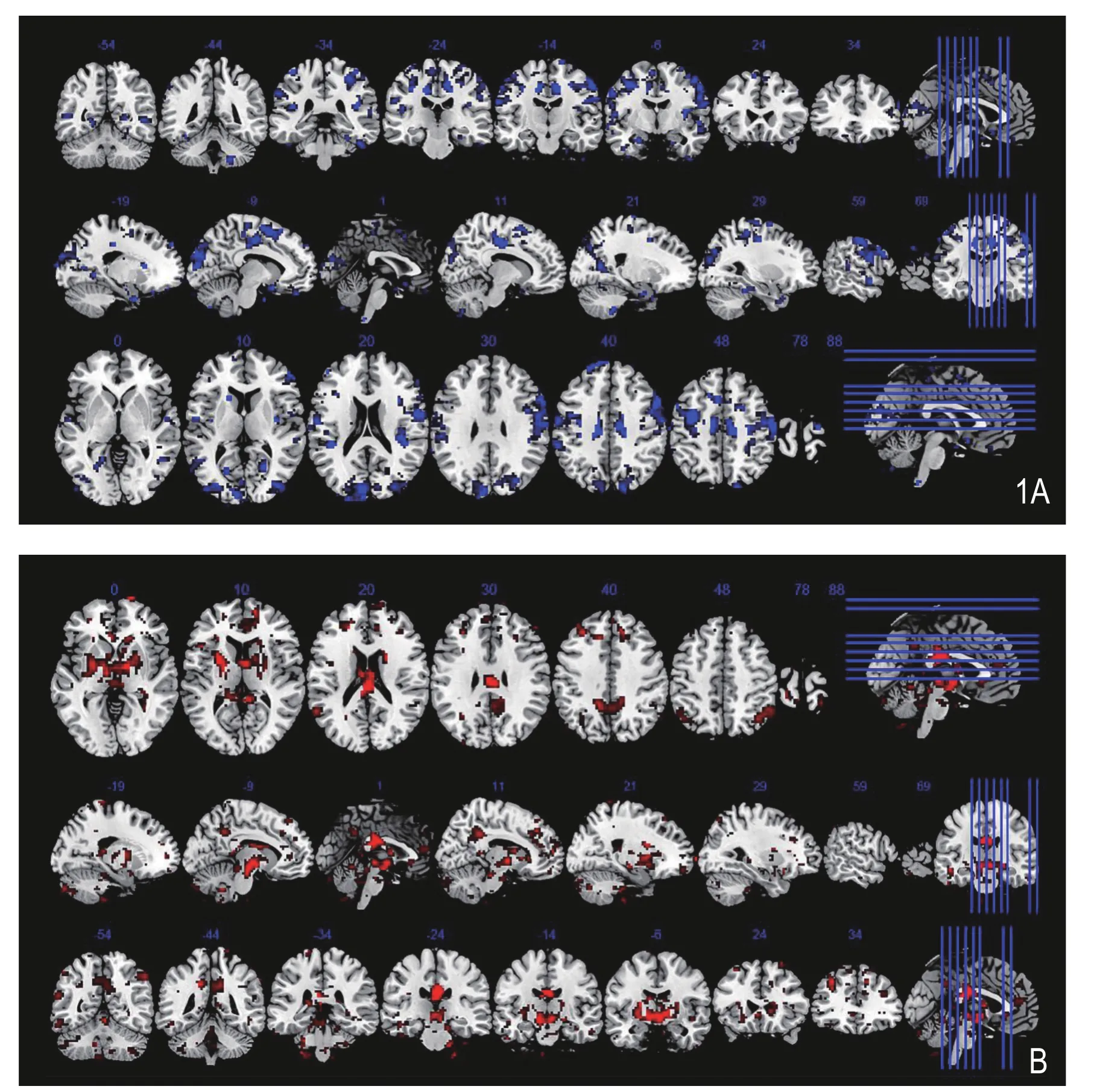
图1 抑郁症a组与抑郁症b组比较,与左侧杏仁核功能连接差异的脑区(AlphaSim校正,P<0.005,体素>9,阈值P<0.05)。A.抑郁症a组与抑郁症b组比较,与左侧杏仁核功能连接增加的脑区;B.抑郁症a组与抑郁症b组比较,与左侧杏仁核功能连接降低的脑区。
讨 论
静息态功能连接(rs-FC)可以衡量各脑区的时间序列的相关性,从而能以整体的角度分析大脑认知记忆以及情感功能[10]。本研究利用rs-fMRI探讨伴发嗅觉障碍的抑郁症患者双侧杏仁核的rs-FC表现。结果发现抑郁症患者的双侧杏仁核较正常人有多个脑区的功能连接降低,伴发嗅觉障碍的抑郁症患者的双侧杏仁核较嗅觉功能正常的抑郁症患者也存在多个脑区的功能连接改变。
杏仁核是所有感觉系统中与嗅觉联系最为紧密的结构,它属于初级嗅觉皮质。气味信号通过嗅球接受之后传递给杏仁核与梨状皮质,再介导次级嗅觉皮质,比如眶额皮质、海马等结构产生作用[11]。有研究发现嗅觉缺失的患者杏仁核大小和结构可塑性发生改变[12]。此外,杏仁核属于边缘系统的一部分,因此也参与机体的情感调控。目前抑郁症患者杏仁核改变研究结果不一,有研究发现抑郁症患者杏仁核体积增大[13],血流代谢增强[14],也有研究认为抑郁症患者杏仁核体积不变[15]或缩小[16],这些研究说明杏仁核变化可能与抑郁症严重程度有关。由于杏仁核是重要的化学感受通路以及情感调控通路的共同信号输出中心[17],而嗅觉功能减退的抑郁症患者的化学感受通路以及情绪刺激通路被发现有相同的处理机制[18],所以杏仁核是联系抑郁症与嗅觉障碍的重要结构。本次研究中,抑郁症患者双侧杏仁核与额、颞以及顶叶均存在连接功能减弱,证实了杏仁核和抑郁症发生机制存在重要联系。同时,本次研究中,伴有嗅觉减退的抑郁症患者较不伴嗅觉减退的抑郁症患者HDRS得分更高,抑郁程度更严重,而伴有嗅觉减退的抑郁症患者的左侧杏仁核与左侧颞上回、左侧楔叶以及Cerebelum_Crus1_R连接增强并与嗅觉测试距离存在相关性。这些结果说明抑郁症的发生引起杏仁核改变,随着病情发展,杏仁核与部分脑区功能连接的异常是导致抑郁症患者出现嗅觉改变的原因之一,而同嗅觉测试距离没有相关性的其他存在功能连接改变的脑区可以认为是同抑郁程度的改变有关。有趣的是,抑郁症两组之间,与左侧杏仁核的连接改变的脑区多于右侧杏仁核,这是由于左、右侧杏仁核功能是不同的,左侧杏仁核对已经存在的负性刺激产生反应,右侧杏仁核只对突然产生的负性刺激产生反应[19]。
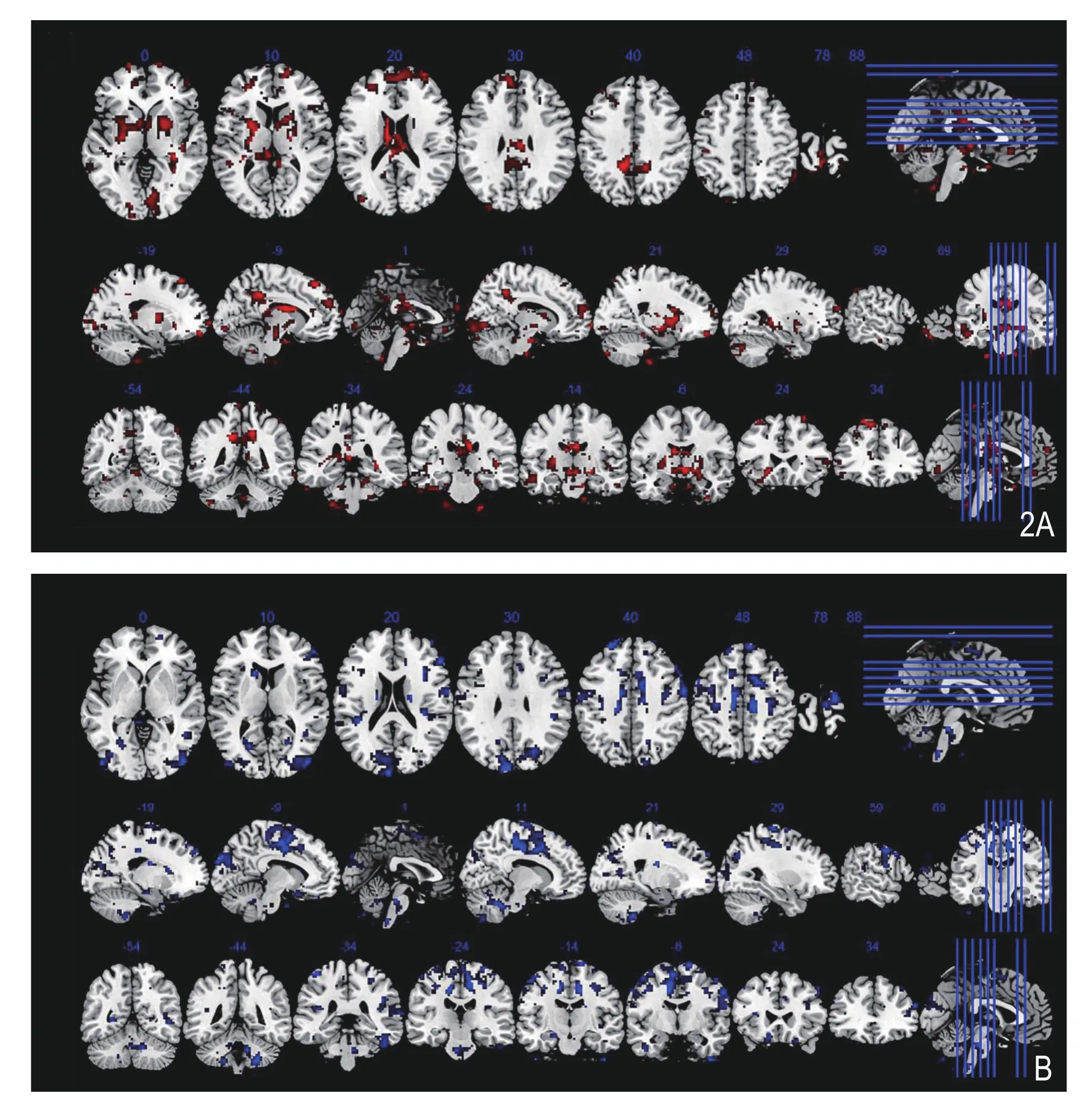
图2 抑郁症a组与抑郁症b组比较,与右侧杏仁核功能连接差异的脑区(AlphaSim校正,P<0.005,体素>12,阈值P<0.05)。A.抑郁症a组与抑郁症b组比较,与右侧杏仁核功能连接降低的脑区;B.抑郁症a组与抑郁症b组比较,与右侧杏仁核功能连接增加的脑区。
当然,本次实验存在一定局限性。首先,本次实验样本量相对较小,需要后期进一步扩大样本量降低数据偏移性;其次,本研究只单采用了脑功能图像的分析,希望在后期的研究中能结合抑郁症患者的嗅皮质的结构像进行综合性分析;另外,抑郁症有多种亚型,例如双相障碍、季节性抑郁等,本次研究纳入病例并未对各抑郁亚型进行分类。
综上所述,抑郁症患者可以存在嗅觉减退的异常表现,并且嗅觉功能障碍可能提示了抑郁症程度的加重,抑郁症患者静息态下双侧杏仁核结构-皮质功能连接模式和嗅觉表现有明显关联,这些结果可能揭示了抑郁症患者嗅觉障碍和情绪调节失控的关系。
[1]Atanasova B, Graux J, Hage W E, et al. Olfaction: A potential cognitive marker of psychiatric disorders. Neuroscience & Biobehavioral Reviews, 2008, 32:1315-1325
[2]Kohli P, Soler ZM, Nguyen SA, et al. The Association Between Olfaction and Depression: A Systematic Review, Chem Senses,2016,14:479-486.
[3]Rossi M, Perez-Lloret S, Millar V P, et al. Olfactory Dysfunction Evaluation Is Not Affected by Comorbid Depression in Parkinson's Disease. Movement Disorders, 2015, 30:1275.
[4]Jung Y G, Lee J S, Park G C. Does post-infectious olfactory loss affect mood more severely than chronic sinusitis with olfactory loss.Laryngoscope, 2014, 124:2456-60.
[5]Fox M D, Greicius M. Clinical applications of resting state functional connectivity. Frontiers in Systems Neuroscience, 2010, 4:19.
[6]Davidson T M, Murphy C. Rapid clinical evaluation of anosmia. The alcohol sniff test. Archives of otolaryngology-head & neck surgery,1997, 123:591.
[7]Ashwin C, Chapman E, Howells J, et al. Enhanced olfactory sensitivity in autism spectrum conditions. Molecular Autism, 2014, 5:53.
[8]Ashburner J. A fast diffeomorphic image registration algorithm.Neuroimage, 2007, 38:95.
[9]Deligiannidis K M, Sikoglu E M, Shaffer S A, et al. GABAergic neuroactive steroids and resting-state functional connectivity in postpartum depression: a preliminary study. Journal of Psychiatric Research, 2013, 47:816-828.
[10]齐志刚, 王晓怡, 邬 霞,等. 健康老年人的海马功能连接:基于体素的相关分析研究. 中国医学计算机成像杂志, 2013,19:115-119.
[11]Hummer T A, Phan K L, Kern D W, et al. A human chemosignal modulates frontolimbic activity and connectivity in response to emotional stimuli . Psycho neuroendocrinology, 2017, 75:15.
[12]Smitka M, Puschmann S, Buschhueter D, et al. Is there a correlation between hippocampus and amygdala volume and olfactory function in healthy subjects. Neuroimage, 2012, 59:1052-1057.
[13]Weniger G, Lange C, Irle E. Abnormal size of the amygdala predicts impaired emotional memory in major depressive disorder. Journal of Affective Disorders, 2006, 94:219-229.
[14]Frodl T, Meisenzahl E M, Zetzsche T, et al. Larger amygdala volumes in fi rst depressive episode as compared to recurrent major depression and healthy control subjects. Biological Psychiatry, 2003,53:338-344.
[15]Munn M A, Alexopoulos J, Nishino T, et al. Amygdala volume analysis in female twins with major depression. Biological Psychiatry, 2007,62:415-22.
[16]Hickie I B, Naismith S L, Ward P B, et al. Serotonin transporter gene status predicts caudate nucleus but not amygdala or hippocampal volumes in older persons with major depression. Journal of Affective Disorders, 2007, 98:137-142.
[17]Soudry Y, Lemogne C, Malinvaud D, et al. Olfactory system and emotion: common substrates. European Annals of Otorhinolaryngology Head & Neck Diseases, 2011, 128:18-23.
[18]Croy I, Symmank A, Schellong J, et al. Olfaction as a marker for depression in humans. Journal of Neurology, 2014, 160:1-8.
[19]Morris J S, Ohman A, Dolan R J. Conscious and unconscious emotional learning in the human amygdala. Nature, 1998, 393:467-470.
