基于影像组学方法的原发性肝细胞癌微血管侵犯和肿瘤分化等级预测
2018-04-27刘桐桐威张炜彬曹佳颖罗惠高余锦华王文平
刘桐桐 董 怡 韩 红 戴 猛 姚 钊 郭 威张炜彬 曹佳颖 罗惠高 余锦华* 王文平*
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种全球性高发的、恶性程度极高、预后极差的肿瘤,流行病学显示其发病率在各种恶性肿瘤中排列第六,死亡率排第四[1]。据统计,有超过80%的HCC病例发生在发展中国家,在我国HCC列恶性肿瘤致死第二位[2]。
根据Edmons-Steiner分级标准,临床将HCC分化情况分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级[3]。这种分级的主要依据为:细胞的胞质嗜酸性、胞核深染、核浆比例以及细胞功能等。根据组织的分化程度不同,肝癌患者在介入治疗的过程中,治疗方式及预后评估会有很大的差别,低分化肝癌预后较差,治疗效果不佳[4]。
肝细胞癌的微血管侵犯(micro vascular invasion,MVI)定义为显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团[5]。有研究表明,MVI是肝癌切除后复发、预后的一项独立指标[6]。据统计,MVI指标对于患者1、3、5年生存率有很大影响(P=0.012),没有MVI的患者各期的生存率更高[7]。目前肝细胞癌的MVI仍要术后组织病理学确诊,术前的影像学预测尚无敏感、特异的指标。以往研究认为,HCC瘤体越大,MVI的发生率越高[6]。此外,有研究发现,患者的体重、年龄等因素也与MVI有关,肥胖者体内瘦素水平较高,发生MVI风险更大,而年龄≤65岁是预测MVI的独立指标[6]。临床上,现有的超声影像学方法,往往不能对HCC分化等级和是否存在MVI做出判断。
影像组学的概念最早是由荷兰学者Lambin等于2012年提出,主要是利用医学影像提取大量的高通量特征,对图像数据进行更深入的挖掘[8]。实验过程包括图像的手动分割标注、高通量特征提取、特征筛选、结果分类判别等。本文拟利用影像组学(Radiomics)的方法,通过回顾性分析经过手术病理证实的HCC的常规灰阶影像,探索通过影像组学无损、精准预测肝细胞癌分化等级和MVI指标的可行性。
方 法
本研究通过基于影像组学的方法,通过回顾性分析经手术病理证实的HCC常规灰阶超声图像,对HCC患者的MVI和肿瘤分化等级进行无损预测。该过程包括4个步骤:图像分割,高通量特征提取,特征筛选和分类判别。所有的图像和数据处理都在MATLAB R2015b (MathWorks, Inc., Natick,MA, USA)中进行。这项研究的工作流程图如图1所示。
1.高通量特征的提取
特征提取是影像组学方法中关键的一步,对之后的分类判别起着重要的作用。本研究使用原始灰阶超声图像和经过小波变换后的图像进行特征提取。小波变换可通过高通和低通滤波器将图像信息层层进行剥离,使小波分解后的图像包含不同频率子带的强度和纹理特征[9]。
我们从这些图像中共提取了452个基本的影像组学特征。肿瘤的病灶区域由医生手工勾画。特征包括反映肿瘤大小、形状、方向、边缘、边界的30个形态特征,以及68个肿瘤的纹理特征,包括直方图特征,基于灰度共生矩阵的特征,基于灰度行程矩阵的纹理特征,基于灰度区域大小矩阵的特征,基于邻域灰调差矩阵的特征,再加上小波变换后图像提取的352个特征和病人的病例中记录的性别和年龄这2个临床信息[9]。
2.特征选择
由于冗余的特征在分类时会对后续的分类造成影响,在分类前需要对所提取的特征进行筛选。本研究采用稀疏表示(sparse representation coefficient,SRC)方法,将特征的重要性量化,并用SRC的值表示,之后根据SRC的绝对值将特征进行排序[10]。之后选取不同数目的特征进行效果评价,比较各个特征集的分类结果,将效果最好的选为用于分类的最终特征集。
3.分类判别
在医学研究中又许多常见的分类器被用于区分从图像中提取的信息,本研究采用目前被广泛使用的支持向量机 (support vector machines, SVM),SVM在高维空间中寻找最有超平面的方式具有很强的辨识性和稳定性[9]。
在我们的研究中,采用SVM和留一法交叉验证(leave-one-out cross-validation, LOOCV)相结合的方式,根据之前所提取的特征集进行分类并评估结果,并将评估结果作为最终的结果呈现,其中,评估标准为受试者工作特征曲线下面积(AUC)、准确度(ACC)、灵敏度(SENS)、特异性(SPEC)、阳性预测值(PPV)、阴性预测值(NPV)和马修相关系数(MCC)[9]。
结 果
1.材料和数据
本文对复旦大学附属中山医院超声科诊断的87例原发性HCC患者的常规灰阶超声图像数据进行分析。本回顾性研究涉及的所有实验均经过伦理委员会的批准。入组条件如下:①原发性HCC患者;②病理诊断报告中包括MVI、肿瘤分化等级结果;③图像采集切面标准,病灶清晰可辨。
灰阶超声图像由3位具有至少10年腹部超声操作经验的超声科医生,使用频率为3~5MHz的超声探头。所使用的超声仪器包括飞利浦(EPIQ-7)、西门子(HELX OXANA)、通用电气(LOGIC E9)以及声科公司(Supersonic)的超声诊断仪器,对病人的肝脏部位进行常规灰阶超声检查,并获取多个标准切面的灰阶图像。所有图像以DICOM格式存储并导出。另外,搜集患者的临床资料,包括性别、年龄信息。并将最终的手术病理结果:MVI、肿瘤分级作为预测的金标准。病人的详细信息见表1。

表1 病人详细信息
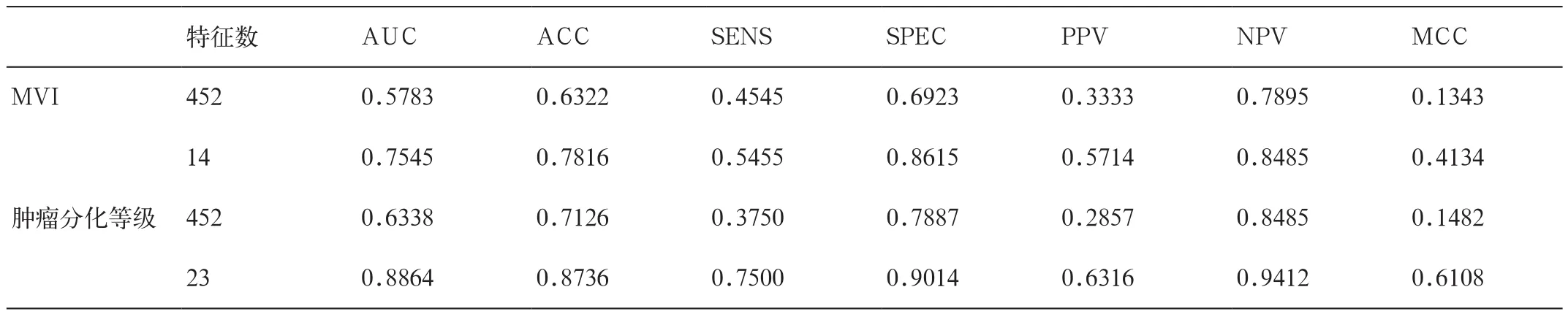
表2 不同模型的预测结果
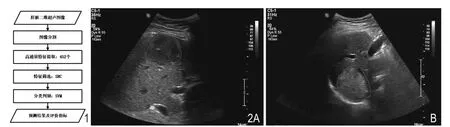
图1 工作流程图。图2 2例典型HCC。A.一位64岁男性患者的肝脏超声图像,肿瘤大小7cm×7cm×6cm,分化等级II级,MVI指标为高危; B.一位78岁男性的肝脏超声图像,肿瘤大小为5.5cm×4cm×2cm,分化等级II级,MVI指标为低危。
2.实验结果
图2所示是2个典型的HCC患者的二维灰阶图像。肿瘤的边界通过手动分割得到,显示为红色的实线。

图3 特征个数的变化对分类器效果AUC的影响变化曲线。图4 ROC曲线。A.原始特征的ROC曲线;B.经过筛选后特征的ROC曲线。
我们从处理过后的灰阶超声图像中提取了450个高通量特征,并添加性别和年龄信息,一共452个特征。然后,使用SRC进行特征筛选和降维。特征个数的变化对分类器效果AUC的影响变化曲线如图3所示。根据曲线选择最优化点,对应的特征数目即为降维达到的数目。对于MVI和肿瘤分级来说,特征的维度分别被降到14和23,分别对应着各自最高的AUC。
利用降维后的数据,通过LOOCV利用SVM分类器建立对MVI和分化等级的预测模型结果如表2所示,ROC曲线见图4对于MVI来说,最终模型的预测AUC为0.7545,ACC 为 0.7816,SENS为0.5455,SPEC为0.8615。对于肿瘤分化等级来说,AUC 为0.8864,ACC 为 0.87360,SENS为0.7500,SPEC 为 0.9014。
讨 论
在精准医疗的背景下,深入研究HCC的分化等级和MVI对HCC的治疗和预后具有重要意义。HCC分化等级越低,癌细胞分化越差,癌变越严重,对于其治疗的预后越差。MVI是HCC术后复发的重要影响因子,是影响HCC早期复发的一个重要因素。目前临床上HCC的分化程度以及MVI指标描述只能通过有创性的手术或穿刺取得肿瘤组织及苏木精-伊红(hematoxylin-eosin, HE)染色法的常规病理检查及免疫组化分析得到,无法在术前进行无创性的影像学精准预测。本研究基于目前最新的影像组学的方法,利用患者常规灰阶超声影像信息无创性预测HCC分化程度和MVI指标,并取得了良好的实验效果。
预测MVI和分化程度,寻找相关预测指标一直以来是研究的重点。Annette等发现在肿瘤直径>4cm情况下MVI发生率是<4cm的2倍[11]。但是在本研究中,肿瘤的大小和MVI无关。利用术前电子计算机断层扫描(computed tomography,CT)检查,Chou等发现肿瘤边缘不光滑是影响MVI的重要因素[13]。本研究得到了类似的结果,肿瘤超声图像的边缘光滑度和MVI相关。另外,在本研究中还发现肿瘤的生长方向、形状、分叶数,以及患者的年龄和MVI密切相关。这些因素在临床诊疗中可能具有一定的判断价值。
对分化等级的研究,领域比较分散。胡国祥等人的研究发现在CT图像中,病灶的形态、厚度与肝细胞性肝癌分化程度密切相关[14]。骆雁翎等人的研究表明,利用超声造影(contrast-enhanced ultrasound,CEUS)图像中各时相回声强度和病理的增强模式等可以帮助评估HCC的分化程度[15]。然而,利用造影方法需要对病人注射对比剂,且存在对医院的医生操作有要求等局限性。本研究的方法则可以通过术前常规灰阶超声图像直接预测HCC分化等级,并发现肿瘤的生长方向、形状,以及病人的性别和HCC分化等级相关。
本研究还存在一定的不足。首先,影像组学方法对数据的维度具有一定的要求,需要更多的高维信息以避免模型的过拟合问题。受限于实际条件,本研究中涉及的数据集还需要进一步扩充。其次,虽然本研究数据库中包含多个厂家的超声诊断仪器,预测模型也取得了不错的效果,未来我们的研究将着眼于大规模多中心的临床数据,进一步扩展预测模型的可靠性。另外,上文提到的研究中提出了很多本研究未涉及的和MVI以及分化相关的指标,在以后的研究中可以关注并考虑添加这些指标。
本研究通过基于影像组学的方法,利用从常规灰阶超声图像中提取的高通量特征建立预测模型,反映了常规灰阶超声图像和MVI以及和肿瘤分级之间存在一定的相关性,显示了通过常规灰阶超声图像在术前无创性预测MVI和肿瘤分级的可行性,为临床上HCC的诊断、治疗和预后判断提供了新的思路。
[1]刘 晨, 孙德光, 高振明,等. 原发性肝细胞性肝癌根治术后序贯性肝动脉化疗栓塞术的治疗进展. 肝胆外科杂志, 2012,20:308-310.
[2]Yang J D, Roberts L R. Hepatocellular carcinoma: a global view.Nature Reviews Gastroenterology & Hepatology, 2010, 7:448.
[3]Edmondson H A, Steiner P E. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies. Cancer, 1954, 7:462.
[4]张 梅, 徐雪房, 李艳明,等. CT 联合血清指标对不同组织分化程度肝细胞肝癌患者T ACE 术后的多元分析评价. 滨州医学院学报, 2014:327-330.
[5]中国抗癌协会肝癌专业委员会. 原发性肝细胞肝癌规范化病理诊断指南(2015年版). 解放军医学杂志, 2015, 21:833-839.
[6]金 赟, 李江涛. 肝癌细胞侵犯微血管的临床相关因素及分子标志物的研究进展. 临床肝胆病杂志, 2013, 29:550-553.
[7]刘臻玉, 武 丹, 区锦玲,等. 肝癌微血管侵犯的特点及相关临床指标. 肝胆胰外科杂志, 2017, 29:107-111.
[8]Lambin P, Riosvelazquez E, Leijenaar R, et al. Radiomics: Extracting more information from medical images using advanced feature analysis. European Journal of Cancer, 2012, 48:441-446.
[9]Yu J, Shi Z, Lian Y, et al. Noninvasive IDH1 mutation estimation based on a quantitative radiomics approach for grade II glioma.European Radiology, 2016,26:1-14.
[10]Aerts H J, Velazquez E R, Leijenaar R T, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nature Communications, 2014, 5:4006.
[11]Li Y, Namburi P, Yu Z, et al. Voxel selection in fMRI data analysis based on sparse representation. IEEE transactions on bio-medical engineering, 2009, 56:2439.
[12]Gouw A S, Balabaud C, Kusano H, et al. Markers for microvascular invasion in hepatocellular carcinoma: where do we stand?. Liver Transplantation, 2011, 17 Suppl 2(Supplement S2):S72.
[13]Chou C T, Chen R C, Lee C W, et al. Prediction of microvascular invasion of hepatocellular carcinoma by pre-operative CT imaging.British Journal of Radiology, 2012, 85:778-783.
[14]胡国祥, 郑丽民. 肝细胞性肝癌CT表现与肿瘤病理分化相关性研究. 中国中西医结合消化杂志, 2013, 21:537-538.
[15]骆雁翎, 熊文文, 张迎春,等. 不同分化程度肝癌患者的超声造影参数分析. 医学临床研究, 2017, 34:381-383.
