弹性成像在鉴别甲状腺结节良恶性中的应用进展
2018-04-27王博许萍
王 博 许 萍
甲状腺癌是发病率上升最快的恶性肿瘤之一,在甲状腺癌大家族中以乳头状癌最为多见,其次为滤泡性癌、髓样癌、未分化癌。其病情进展相对缓慢,生存时间较长,绝大多数的患者预后较好,但仍有少数患者因肿瘤局部侵犯或肿瘤远处转移而死亡,故早期诊断对于延长甲状腺癌患者的生存期具有重要意义。超声作为一种常用的检查方法在甲状腺结节的发现、诊断以及预后随访中具有重要作用,超声弹性成像技术(ultrasonic elastography,UE)的出现,为常规超声在鉴别甲状腺结节良恶性的方面提供了一种辅助手段。但不同弹性成像技术在甲状腺结节良恶性鉴别诊断中的临床应用价值上仍存在争论。近几年新出现的第三代ARFI技术-VTIQ在临床上的应用价值仍处于初步探索阶段。本文就不同类型超声弹性成像技术在鉴别甲状腺结节良恶性方面的研究新进展作一综述。
弹性超声鉴别甲状腺结节良恶性的病理基础
甲状腺良性结节如结节性甲状腺肿等主要由滤泡细胞组成,其内充满胶质成分,质地较软;而甲状腺癌的硬度大于良性病变,如乳头状癌间质多含纤维,血管及呈同心圆排列的砂粒体,组织硬度较高,而且砂粒体越多,硬度越硬[1]。弹性成像技术通过客观反映组织的弹性特征为鉴别甲状腺结节良恶性提供一定依据。
应变弹性成像——施压式应变弹性成像
2007年由Rago等[2]首次报道用于辅助诊断甲状腺恶性结节。临床上需要操作者直接持探头对组织施加压力,弹性图像叠加在二维灰阶图像上,组织的硬度通过连续的颜色变化,呈现出不同颜色的图像。不同仪器生产厂家对组织软硬度的彩色编码是不同的,这里拟定从软至硬依次表现为红色、绿色、蓝色。
1.该技术的评分方法
(1)通过目测结节内部与周围甲状腺组织的颜色对比及蓝色区域即较硬组织所占结节面积比例,文献报道常用为4分评分法及5分评分法。但该方法受操作者的主观性影响,Ko SY等[3]提出,有经验的操作者较经验不足的操作者在诊断方面具有更高的特异度。
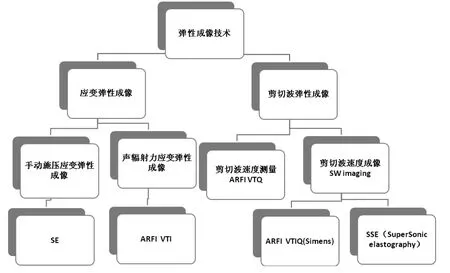
图1 弹性超声的实用简单分类。
4分法评分标准:1分——结节全部呈现绿色;2分——结节大部分区域呈现绿色,小部分蓝色区域;3分——结节大部分呈现蓝色,小部分绿色区域;4分——结节全部呈现蓝色。评分3~4分考虑恶性结节。
5分法评分标准:1分——结节全部呈现绿色;2分——结节大部分区域呈现绿色,小部分蓝色区域;3分——仅结节周边呈现绿色,中央区蓝色;4分——结节全部呈现蓝色;5分——结节及结节周围组织呈现蓝色。评分3~5分考虑恶性结节。
(2)应变率比值(strain ratio,SR)法,是一种半定量测量法,即在结节及周围组织区域分别选择感兴趣区(region of interest,ROI),来计算二者的弹性应变率的比值。WANG等[4]研究得出,以SR阈值设为2.9来鉴别甲状腺结节的良恶性,其敏感性为87%,特异度为92%。良性结节的SR范围为1.64±1.37,恶性结节的SR值明显高于良性结节,SR 范围为 4.96±2.13(P<0.01)。比值越高,硬度越大,恶性病变可能性越大。以上两种评价方法中,后者可克服前者操作及判读的主观性带来的偏倚,然而对于以甲状腺弥漫性病变为背景,后者的准确度明显受限。Gotzberger等[5]提出在以SR为评估方法中,以结节周围正常甲状腺组织为比值比以周围颈部肌肉组织为比值更有意义。在不能以结节周围正常甲状腺组织为比值时可以选择后者,例如甲状腺呈弥漫性病变状态时。
大量文献已经研究了施压式应变弹性成像在鉴别甲状腺结节良恶性上的价值,但结论未达成统一。一些研究中指出,在不考虑操作者经验水平的前提下,单独应用弹性成像在鉴别甲状腺结节良恶性上的准确度不及单独应用传统超声进行诊断[5]。Seong 等[6]提出在传统超声显示并无明确恶性征象的甲状腺结节中,利用施压式应变弹性成像来鉴别甲状腺结节良恶性存在局限性。另一些研究则表明,施压式弹性成像的阳性预测值达到63.1%高于传统超声,且阴性预测值达到97.2%,表明施压式弹性成像也许是最好的鉴别甲状腺良恶性结节的方法[7]。更多研究表明,弹性成像结合传统超声在鉴别诊断上最具价值[8]。
2.该技术的局限性
(1)结节周围甲状腺组织的质地:若甲状腺呈弥漫性病变(如结节性甲状腺肿、桥本甲状腺炎),评分法及应变率比值法得出的结果的可靠度则大大减低。
(2)受结节位置及参照组织的影响:结节过浅、过深贴近或突出于包膜,会误以为结节较软,因为此时结节周围的参照组织为颈部肌肉组织而非甲状腺组织;深面结节受颈部血管搏动影响较大;峡部结节由于周围可参照组织较少且受气管影响,在诊断上也带来难度。同样术后患者残留的腺体过少时,也会缺乏周围正常甲状腺组织的对照。
(3)结节的大小:结节大于3cm则不适用于施压式弹性成像。
(4)结节内性质:结节内出现钙化及纤维化会使结节硬度增加,造成假阳性。结节内出现坏死,尽管没有液化,也会使结节硬度下降。
(5)需操作者手动施压,操作重复性差,受操作者经验影响。
剪切波弹性成像
1.剪切波速度测量(ARFI VTQ)
VTQ是 第 二 代 ARFI(Acoustic Radiation Force Impulse)技术,也称声触诊组织定量技术,其基本原理是超声探头发射声脉冲激励组织发生纵向位移和横向振动,横向振动以剪切波方式向周边传播,VTQ通过计算剪切波速(shear wave velocity,SWV)对组织弹性进行定量评价,SWV值越高,反映该组织越硬。感兴趣区(ROI)大小为5x6mm,置于甲状腺结节的实性成分中,应避免囊性成分及钙化。剪切波速度超过标尺上限,则会显示“X.XXm/s”
大量研究表明VTQ在鉴别甲状腺结节的良恶性方面有价值,具有高敏感度和高特异度,被视为传统超声的一种辅助手段[9]。目前国际上在鉴别甲状腺结节良恶性SWV的诊断阈值上尚未达成统一。Hamidi等[10]研究提出SWV临界值为2.66m/s时在诊断甲状腺良恶性结节的敏感度为100%,特异度82.3%,而Xu等[11]SWV临界值为2.87m/s,Zhang等[12]为2.84m/s。Zhang等[13]研究得出VTQ与传统超声相比,可以提高甲状腺恶性结节的诊断特异度,尤其适用于小于10mm的结节。Zhang等[14]针对甲状腺微小癌(小于10mm)的研究表明,VTQ结合US的声像图特征可以明显提高鉴别甲状腺结节良恶性的敏感度,约登指数最大时,VTQ临界值为2.91m/s,其诊断敏感度、特异度、阳性预测值、阴性预测值及诊断准确度分别为 71.9%, 100%, 100%, 81.2% 和87.3% 。VTQ结合甲状腺结节恶性声像图征象中,VTQ结合灰阶超声中的纵横比大于1,可以将敏感度和特异度提高到90.6%、97.4%。
VTQ的局限性与不足:VTQ不需要操作者手动施压,避免了操作者经验差异性的影响。但仍存在一些局限性:①ROI取样框为固定5×6mm大小不可调节,结节较小时不能避开液化区及钙化。对于较小的结节,由于ROI不仅包含结节本身且将结节周围组织也包括在内,影响对结节硬度测量的准确性。②VTQ声脉冲渗透深度限制在5.5cm,故不适合应用于过大的及过深的结节[15]。③VTQ的测量范围为0~9.00m/s,组织过硬可能导致速度值不能检出。
2.剪切波速度成像——ARFI VTIQ
第二代ARFI具有两种成像模式VTI及VTQ,但普通ARFI 技术仅能对病灶内部某一点弹性参数进行定量测量,但对于内部弹性参数分布不均的病灶测量存在困难,且重复性较差。VTIQ是第三代ARFI技术,VTIQ 将弹性定量信息与相对弹性变化融合在一幅二维图像内,即将传统ARFI 技术的VTQ 和VTI 融合在一起,因此能直观反映病灶内部不同区域的弹性特征[16]。VTIQ 技术ROI 大小可调,最低为1mm×1mm,具有更广的适用性,尤其对直径小于5mm 的病灶。VTIQ 技术测量ARFI 横向SWV范围更精确,测量范围为0.5~10m/s,克服了第二代ARFI 技术测量范围有限,进而出现较多无效测量值的缺陷[16]。VTIQ图像中SWV速度由高到低分别呈现红色、黄色、绿色、蓝色,速度越大,组织越硬。目前已有文献报导在乳腺、唾液腺、颈部淋巴结、睾丸中的临床应用。
目前国内外发表的文献数量有限。Zhou等[17]的研究对VTIQ在甲状腺结节中的诊断价值予以肯定,研究显示,302个结节中,通过细胞学及组织病理学证实,其中恶性65个,良性237个,以VTIQ测量恶性病灶的各种形式SWV值(最大值、最小值、平均值)均高于良性病灶,差异均有统计学意义(P<0.001)。研究还得出,VTIQ相比较传统的超声声像图特征如:纵横比大于1、微钙化、边界不清、极低回声在诊断甲状腺恶性病灶中具均有更高的效用价值(P<0.05)。当取SWV平均值诊断阈值为2.60m/s时,SWV的敏感度及阴性预测值分别为84.6%和94.3%。Zhou等[17]的进一步分析显示>10mm的病灶相比≤10mm 的病灶,AUC 分别在SWV最大值 为(0.862,0.717),SWV 最 小 值为(0.866,0.717),SWV 平均值为(0.891,0.725),认为VTIQ 在>10mm的甲状腺结节鉴别诊断中可能有更高效能。然而国内李延芳等[18]研究却得出相反结论,显示≤10mm 的病灶AUC 为0.951,>10mm的病灶AUC为0.784,认为VTIQ 在≤10mm的甲状腺结节鉴别诊断中可能有较高的实用性。Azizi等[19]通过对676个病人的707个结节的研究则认为,SWV测值中以最大值的诊断效能最佳,与传统超声声像图特征相比,诊断阈值为3.54m/s时,具有更高的诊断敏感度 (79.27%)、特异度 (71.52%)、阳性预测值(26.75%)及阴性预测值 (96.34%),利用 VTIQ 测量甲状腺结节的硬度可以成为预测甲状腺癌的独立性因素。
3.剪切波速度成像SSE (super sonicelastography)
SSE是一种实时的、重复性强的剪切波定量成像技术,剪切波在不同弹性组织中的传播速度与其杨氏模量相关,杨氏模量值越大,组织的硬度越大。在彩色编码成像上,软的组织呈蓝色,硬的组织呈现红色。通过测量ROI的杨氏模量最大值(E-max)、平均值(E-mean)、最小值(E-min)和标准差(Esd),实时获得组织弹性值。ROI的大小和数量可根据需要进行调节,可以反映一个病灶内不同区域的弹性状态,同时可以避免囊性变及钙化带来的影响。
目前国内外已发表的应用SSE鉴别甲状腺结节良恶性的研究很有限,几乎所有研究均得出恶性结节的杨氏模量值高于良性结节,可以作为传统超声的辅助鉴别诊断手段。SSE结合TI-RADS分类可以提高甲状腺微小癌的检出率[20]。但不同研究所得出的杨氏模量诊断阈值差异很大。Duan 等[21]通过对137例结节的统计分析得出E-min、E-mean和E-max的诊断阈值分别为21.8、34.5和53.2kPa时最为合适,同时得出纵横比大于1、微钙化及E-mean值可以作为诊断乳头状微灶癌的独立预测因素,且SWE结合传统超声的敏感度、特异度、准确度、阳性预测值及阴性预测值均高于单独应用传统超声。Liu等[22]得出以2mmROI的E-mean的杨氏模量阈值为39.3kPa时,敏感度为66.3%,特异度84.4%,同时研究得出以该阈值诊断不同大小甲状腺实性结节的AUC具有统计学差异,结节≤10mm AUC 为 0.730, 结节大小为11~ 30mm AUC为0.883,结节>30mm时AUC为0.821,表明SSE对11~ 30mm大小结节的诊断效能最大,对甲状腺微小癌的诊断效能较弱。
弹性成像在甲状腺结节诊断中的局限性
不同类型甲状腺癌由于其组织成分不同,其弹性表现具有差异性,故存在一定局限性:甲状腺滤泡性癌由不同分化程度滤泡构成,依靠弹性值与腺瘤不易区别,需依靠包膜或血管浸润来确定病理诊断,Asteria 等[23]的研究结论也提到弹性成像对于诊断滤泡型甲状腺癌有局限性由于其低敏感度。目前国内外尚缺乏针对弹性成像在甲状腺滤泡性癌的进一步研究报道。针对髓样癌在施压式弹性成像上的表现,仅有两篇文章进行阐述却得出相反的结果,曹轶峥等[24]利用施压式弹性成像分析了32例髓样癌患者的40个结节,并以40个良性结节作为对照组,结果良性结节的弹性评分明显低于髓样癌[(2.020±0.539)比(3.470±0.441)],差异有统计学意义(P<0.01);应变率比值、弹性评分两者联合应用的ROC曲线下面积为0.8895,诊断准确度85.0%。故认为施压式弹性成像诊断甲状腺髓样癌具有较大的应用价值。 而Andrioli等[25]在18个病例的回顾性分析中,结果发现超过一半的(55.6%) 的结节表现出中至低度(1~2分)的弹性程度。这与乳头状癌有很大的不同,认为施压式弹性成像通过弹性表现并没有提高髓样癌的诊断效率。总体来说甲状腺恶性结节以乳头状癌为主,其他病理类型较少,目前极少有应用弹性成像针对不同病理类型甲状腺癌的文献报道。另一方面,一些良性结节如自主高功能腺瘤质较硬,因此利用弹性成像鉴别诊断“热结节”的准确度有很大缺陷[26]。
由于非线性弹性效应,组织的弹性可能会受到外部压力的影响,随着外部压力的增加,如患者呼吸运动、颈部血管搏动和临近气管的影响使弹性值增加[27]。
总结与展望
综上所述超声弹性成像其操作简单、快捷且无创,在甲状腺良恶性结节的鉴别诊断方面具有一定的实用性,且该技术也在持续发展,不断进步。但是SSE及VTIQ在甲状腺结节中的应用的相关文献报道数量较少,上述不足之处也是今后研究的方向,尤其是在特定的情况下应该不断验证弹性成像的效用。
[1]沈 燕, 徐辉雄, 张一峰, 等. 甲状腺影像报告和数据系统与声触诊组织量化成像技术在甲状腺微小癌的诊断价值. 影像诊断与介入放射学, 2015:460-464.
[2]Rago T, Santini F, Scutari M, et al. Elastography: new developments in ultrasound for predicting malignancy in thyroid nodules. J Clin Endocrinol Metab, 2007,92:2917-2922.
[3]Ko S Y, Kim E K, Sung J M, et al. Diagnostic performance of ultrasound and ultrasound elastography with respect to physician experience. Ultrasound Med Biol, 2014,40:854-863.
[4]Wang H L, Zhang S, Xin X J, et al. Application of Real-time Ultrasound Elastography in Diagnosing Benign and Malignant Thyroid Solid Nodules. Cancer Biol Med, 2012,9:124-127.
[5]Gotzberger M, Krueger S, Gartner R, et al. Comparison of color-Doppler and qualitative and quantitative strain-elastography for differentiation of thyroid nodules in daily practice. Hormones(Athens), 2016,15:197-204.
[6]Seong M, Shin J H, Hahn S Y. Ultrasound Strain Elastography for Circumscribed Solid Thyroid Nodules without Malignant Features Categorized as Indeterminate by B-Mode Ultrasound. Ultrasound Med Biol, 2016.
[7]Azizi G, Keller J, Lewis M, et al. Performance of elastography for the evaluation of thyroid nodules: a prospective study. Thyroid,2013,23:734-740.
[8]Shao J, Shen Y, Lu J, et al. Ultrasound scoring in combination with ultrasound elastography for differentiating benign and malignant thyroid nodules. Clin Endocrinol (Oxf), 2015,83:254-260.
[9]Dong F J, Li M, Jiao Y, et al. Acoustic Radiation Force Impulse imaging for detecting thyroid nodules: a systematic review and pooled meta-analysis. Med Ultrason, 2015,17:192-199.
[10]Hamidi C, Goya C, Hattapoglu S, et al. Acoustic Radiation Force Impulse (ARFI) imaging for the distinction between benign and malignant thyroid nodules. Radiol Med, 2015,120:579-583.
[11]Xu J M, Xu X H, Xu H X, et al. Conventional US, US elasticity imaging, and acoustic radiation force impulse imaging for prediction of malignancy in thyroid nodules. Radiology, 2014,272:577-586.
[12]Zhang F J, Han R L. The value of acoustic radiation force impulse(ARFI) in the differential diagnosis of thyroid nodules. Eur J Radiol,2013,82:e686-e690.
[13]Zhang Y F, Xu H X, Xu J M, et al. Acoustic Radiation Force Impulse Elastography in the Diagnosis of Thyroid Nodules: Useful or Not Useful? Ultrasound Med Biol, 2015,41:2581-2593.
[14]Zhang H, Shi Q, Gu J, et al. Combined value of Virtual Touch tissue quantification and conventional sonographic features for differentiating benign and malignant thyroid nodules smaller than 10 mm. J Ultrasound Med, 2014,33:257-264.
[15]Goertz R S, Amann K, Heide R, et al. An abdominal and thyroid status with Acoustic Radiation Force Impulse Elastometry--a feasibility study: Acoustic Radiation Force Impulse Elastometry of human organs. Eur J Radiol, 2011,80:e226-e230.
[16]徐辉雄, 张一峰, 徐军妹, 等. 第三代ARFI技术——VTIQ在甲状腺结节中的初步应用: 第八届中国肿瘤学术大会暨第十三届海峡两岸肿瘤学术会议, 中国山东济南, 2014[C].
[17]Zhou H, Zhou X L, Xu H X, et al. Virtual Touch Tissue Imaging and Quantification in the Evaluation of Thyroid Nodules. J Ultrasound Med, 2016.
[18]李延芳, 徐辉雄, 张一峰, 等. 声触诊组织量化成像(VTIQ)技术对不同大小甲状腺实性结节良恶性鉴别的诊断价值. 影像诊断与介入放射学, 2014,6:511-515.
[19]Azizi G, Keller J M, Mayo M L, et al. Thyroid Nodules and Shear Wave Elastography: A New Tool in Thyroid Cancer Detection.Ultrasound Med Biol, 2015,41:2855-2865.
[20]Lu X, Zhang Y, Liu Y, et al. [Value of thyroid imaging reporting and data system and shear wave elastography for diagnosis of thyroid microcarcinoma]. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2016,30:118-122.
[21]Duan S B, Yu J, Li X, et al. Diagnostic value of two-dimensional shear wave elastography in papillary thyroid microcarcinoma. Onco Targets Ther, 2016,9:1311-1317.
[22]Liu B, Liang J, Zheng Y, et al. Two-dimensional shear wave elastography as promising diagnostic tool for predicting malignant thyroid nodules: a prospective single-centre experience. Eur Radiol,2015,25:624-634.
[23]Asteria C, Giovanardi A, Pizzocaro A, et al. US-elastography in the differential diagnosis of benign and malignant thyroid nodules.Thyroid, 2008,18:523-531.
[24]曹轶峥. 超声弹性成像联合超声弹性应变率对甲状腺髓样癌的诊断价值. 浙江实用医学, 2015:160-163.
[25]Andrioli M, Trimboli P, Amendola S, et al. Elastographic presentation of medullary thyroid carcinoma. Endocrine, 2014,45:153-155.
[26]Ruhlmann M, Stebner V, Gorges R, et al. Diagnosis of hyperfunctional thyroid nodules: impact of US-elastography.Nuklearmedizin, 2014,53:173-177.
[27]Dudea S M, Botar-Jid C. Ultrasound elastography in thyroid disease.Med Ultrason, 2015,17:74-96.
