超声波辅助酶法脱除石莼水溶性膳食纤维中蛋白质的工艺研究
2018-04-27,,
, ,
(福建农林大学食品科学学院,福建 福州 350002)
水溶性膳食纤维(Soluble dietary fiber,SDF)广泛存在于植物中,具有抗氧化、抗衰老、抗癌症和提高机体免疫力的功效,对高血糖、高血脂、高血压等均有降低功效[1-2]。然而在酶法水提石莼SDF的过程中,常会混入溶解性质相同的游离蛋白和一些与SDF结合形成的糖蛋白复合物,而蛋白质因其所带的电荷,会吸附大量其他杂质[3-4],可能影响对SDF结构及生物活性的研究,所以分离、纯化SDF需要脱蛋白。目前植物类SDF脱蛋白常用的方法有Sevage法、三氯乙酸(TCA)法、盐酸法、酶法等[5],这些方法普遍存在SDF损失率高、SDF活性易被破坏、需消耗大量有机溶剂、繁琐耗时及安全等问题。
超声波具有穿透力强和空化、震荡等效应[6],当其作用于酶解体系时,可以改变酶分子的结构及催化点,从而提高酶催化活性,缩短酶解时间[7]。采用超声波辅助酶法脱除天然大分子中蛋白质,可避免引入有机试剂,具有蛋白质脱除率高、产物损失率低、利于保持产物的活性等优势,是一种值得推广的高效脱蛋白方法[8]。
本研究采用超声波辅助碱性蛋白酶法去除石莼SDF中的蛋白质。以蛋白脱除率和SDF保留率作为指标,探讨各主要因素对石莼SDF蛋白质脱除效果的影响,并采用L9(34)正交试验确定超声波辅助酶法脱蛋白的优化工艺参数,为研究石莼SDF的生理活性和开发保健食品、药品等提供参考。
1 材料与方法
1.1 试验材料
孔石莼粉(80目):购于福建海兴保健食品有限公司;石莼SDF粗品粉末:将原材料孔石莼制成悬浮液,提取、过滤、离心,蒸发浓缩至原来体积1/10,按浓缩液与无水乙醇体积比1∶4加入无水乙醇,静置过夜,离心,微量蒸馏水溶解沉淀,冷冻干燥后即为石莼SDF粗提物;碱性蛋白酶(比活力:2.0×105U/g):江苏锐阳生物科技有限公司;95%乙醇、苯酚、浓硫酸、葡萄糖、考马斯亮蓝、柠檬酸、碳酸钠:均为国产分析纯。
1.2 主要仪器与设备
试验用的仪器、设备如表1所示。

表1 试验仪器与设备
1.3 试验内容与方法
1.3.1 石莼SDF超声波辅助酶法脱蛋白工艺流程
石莼SDF粗品粉末→加蒸馏水溶解→调节石莼SDF溶液的浓度→调节pH值→添加碱性蛋白酶→碱性蛋白酶活化30 min→超声波酶解→沸水浴锅中灭酶10 min→冷却、4 000 r/min离心10 min→脱蛋白后的SDF溶液→稀释、定容→紫外分光光度计中在波长510 nm和490 nm处分别测其吸光值→计算石莼SDF中的蛋白质含量和SDF含量。
1.3.2 石莼SDF超声波辅助酶法脱蛋白单因素试验
1)酶解pH对石莼SDF超声波辅助酶法脱蛋白效果的影响
石莼SDF粗品粉末加蒸馏水溶解配制成浓度为0.6%的石莼SDF溶液,准确移取5份等体积的上述溶液,分别调节其pH为 8.0、9.0、10.0、11.0、12.0,按每g石莼SDF粗品粉末1 000 U酶的量分别加入活化后的碱性蛋白酶,混匀,在温度为55℃、功率为200 W的超声波中酶解2 h,结束后灭酶10 min,在4 000 r/min条件下离心10 min,以一定倍数稀释上清液,分别测定并计算SDF中的蛋白质含量和SDF含量。
2)超声时间对石莼SDF超声波辅助酶法脱蛋白效果的影响
试验分五组,固定石莼SDF粗品溶液的pH值11.0,设超声辅助酶解时间依次为0.5、1.0、1.5、2.0、2.5 h,其余条件和操作同1)。
3)超声功率对石莼SDF超声波辅助酶法脱蛋白效果的影响
设五组试验,调节超声波功率分别为0、200、300、400、500 W,超声酶解时间均控制为1.5 h,其余条件和操作同2)。
4)超声温度对石莼SDF超声波辅助酶法脱蛋白效果的影响
试验分五组,控制超声功率为200 W,设超声温度依次为40、45、50、55、60℃,其余条件和操作同3),进行试验。
5)底物浓度对石莼SDF超声波辅助酶法脱蛋白效果的影响
试验设五组,控制超声温度为50℃,配制底物(石莼SDF)浓度依次为0.4%、0.6%、0.8%、1.0%、1.2%,其余条件和操作同4)。
6)碱性蛋白酶使用量对石莼SDF超声波辅助酶法脱蛋白效果的影响
设五组试验,固定石莼SDF的浓度为0.6%,分别设碱性蛋白酶的使用量为800、1 000、1 200、1 400、1 600 U/g石莼SDF粗品粉末,其余条件和操作同5)。
1.3.3 石莼SDF超声波辅助酶法脱蛋白关键工艺优化
根据单因素试验,确定石莼SDF溶液的pH值(A)、超声温度(B)、碱性蛋白酶使用量(C)、超声时间(D)为关键影响因素,以SDF保留率和蛋白质脱除率为考察指标,设计L9(34)正交试验优化超声波辅助酶法脱除SDF蛋白质关键工艺。正交试验因素水平设计见表2。

表2 L9(34)正交试验因素水平表
1.4 指标与测定方法
1.4.1 石莼SDF含量测定
采用苯酚-硫酸法测定SDF含量[9]。
式中:M1、M2分别为脱蛋白前后石莼SDF样液中的SDF含量(mg/g)。
1.4.2 石莼SDF中蛋白质含量测定

1.5 统计分析
采用DPSv7.05软件进行分析,用LSD法对各单因素的均值进行差异性分析,P<0.01为极显著差异,P<0.05为显著差异,P>0.05为差异不显著。
2 结果与分析
2.1 酶解pH对石莼SDF超声波辅助酶法脱蛋白效果的影响
如图1所知,样液pH值落在8~11范围内,石莼SDF的蛋白质脱除率与酶解液pH值呈极显著(P<0.01)正相关关系,从(74.21±0.28)%增加到(81.38±0.36)% (P<0.01);而SDF保留率随酶解液pH值的增大,从(89.29±0.23)%下跌到(84.80±0.20)% (P<0.01);之后随pH的增大,石莼SDF的蛋白质脱除率下降(P<0.01),石莼SDF保留率升高(P<0.01)。
因为碱性蛋白酶的作用条件适合于偏碱性[11],当pH值逐渐接近11时,由于解离基团处于碱性蛋白酶的最合适的解离状态,此时酶分子更易与底物蛋白分子结合,蛋白脱除率升高;但pH值大于11后,由于其带电基团的解离状态偏离其最适构象所需的状态,阻碍了其与底物相结合,酶活性降低,蛋白质脱除率降低[6],同时与蛋白质结合的SDF损失也相应变少;故其理想pH值为11.0左右。

2.2 超声时间对石莼SDF超声波辅助酶法脱蛋白效果的影响
如图2所示,当超声时间在0.5~1.5 h之间时,石莼SDF的蛋白质脱除率随时间延长而升高,对石莼SDF的蛋白质脱除率和SDF保留率的影响均为极显著(P<0.01)。SDF蛋白质脱除率从(72.56±0.19)%提高到(81.51±0.25)%,而石莼SDF保留率从(90.09±0.21)%下降到(84.39±0.24)%,1.5 h后两指标的值随超声时间的延长保持稳定(P>0.05)。
延长超声时间可强化超声波的各种效应,加大分子振动扩散,酶与蛋白质充分作用,加快酶促反应,蛋白质脱除效果明显[12-13],但蛋白酶特异性较强,降解到一定程度后,继续延长超声时间并不能提高其作用;此外,过长时间超声作用反而会使酶活性下降,而且石莼SDF的结构也会遭到破坏,甚至碳环裂解[14],造成损失,综上,超声时间以1.5 h较适宜。

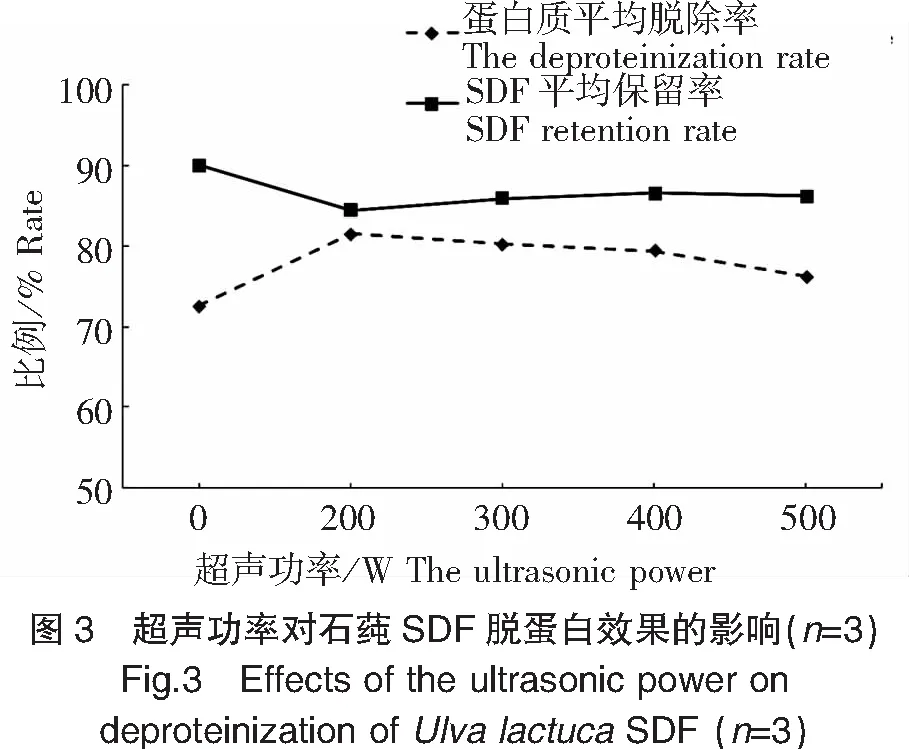
2.3 超声功率对石莼超声波辅助酶法SDF脱蛋白效果的影响
如图3所示,在200 W之内,超声功率对石莼SDF的蛋白质脱除率和SDF保留率的影响均为极显著(P<0.01),其蛋白质脱除率从(72.54±0.17)%提高至(81.52±0.13)%,而SDF保留率却从(90.01±0.32)%降至(84.36±0.11)%;随着超声功率的进一步提高,其蛋白质脱除率反而呈极显著(P<0.01)下降趋势,而SDF保留率先极显著(P<0.01)升高后显著(P<0.05)下降。
在超声波的机械振动和空化效应的影响下,溶质的传递作用加快,有助于反应底物进入酶的催化部位[15],适宜强度的超声波改变了酶分子构象,易与底物分子结合,提高酶解效率[16]。适宜超声处理可削弱蛋白质和SDF之间的作用力,使蛋白质易脱除;当超声功率超过200 W时,过高的超声波强度和强烈的空化效应和机械作用会破坏酶分子的结构,导致酶钝化甚至失活[17],降低SDF蛋白脱除率,而且当超声功率超过400 W时,高热量聚集和强烈的剪切和振动作用亦会打断SDF的链结构,造成SDF保留率下降[18];故石莼SDF脱蛋白的适宜的超声功率为200 W左右。
2.4 超声温度对石莼SDF超声波辅助酶法脱蛋白效果的影响
如图4所示,在40~50℃范围内,超声温度对石莼SDF的蛋白质脱除率和SDF保留率的影响均极显著(P<0.01),当超声温度达到50℃时,脱除率和保留率分别为(81.56±0.23)%和(84.01±0.13)%;但随温度的继续升高,石莼SDF的蛋白质脱除率极显著(P<0.01)降低,而SDF保留率呈显著(P<0.05)递增趋势。
当温度低于酶解最适温度时,酶分子在溶液中的扩散动力随温度上升而增大,加剧酶促反应,提高SDF的蛋白质脱除率,与此同时有些SDF与蛋白质合成糖蛋白质复合物亦可能被脱除,从而降低SDF的保留率[11]。但超声温度超过酶的最适反应温度时,酶的空间结构被破坏而渐渐变性[19],导致SDF的脱蛋白效果急剧下降,而SDF的保留率呈现略微上升趋势,故石莼SDF脱蛋白的理想超声温度为50℃左右。

2.5 底物浓度对石莼SDF超声波辅助酶法脱蛋白效果的影响
如图5所示,当底物浓度为0.4%时,酶的浓度过低,故SDF的蛋白质脱除率极低。随着底物(石莼SDF)浓度增大,对石莼SDF的蛋白质脱除率和SDF保留率的影响均为极显著(P<0.01)。当底物浓度为0.6%,石莼SDF的蛋白质脱除率达到最大值,为(81.56±0.39)%,之后呈逐渐下降,而石莼SDF保留率达到最小值,为(82.87±0.23)%,之后呈逐渐上升趋势。
底物浓度过低时,SDF溶液的流动性较大,底物与酶充分反应,随着底物浓度逐渐增大,酶解程度也随之加大,SDF的蛋白质脱除率提高,SDF损耗增加;但底物浓度过高时,SDF溶液的流动性下降,酶与底物难以完全接触,限制酶解反应速度[20],蛋白质脱除效果变差,而SDF保留率变大,石莼SDF的浓度控制在0.6%左右较适宜。

2.6 碱性蛋白酶使用量对石莼SDF超声波辅助酶法脱蛋白效果的影响
如图6所示,石莼SDF的蛋白质脱除率和SDF保留率与碱性蛋白酶使用量在800~1 200 U/g间存在明显的量效关系,其蛋白质脱除率从(78.56±0.11)%极显著(P<0.01)提高到(82.28±0.11)%;而SDF保留率从(89.15±0.14)%极显著(P<0.01)降到(81.50±0.15)%。酶使用量大于1 200 U/g后,两个指标无显著变化(P>0.05)。
底物浓度在一定的情况下,酶促反应速度随蛋白酶使用量的增多而加快,部分SDF亦受到蛋白酶的作用而发生降解;当酶的使用量达一定程度后,酶促反应达到饱和[21],此时SDF中蛋白质基本去除完全,故石莼SDF脱蛋白的碱性蛋白酶使用量以1 200 U/g左右较适宜。

2.7 石莼SDF超声波辅助酶法脱蛋白关键工艺参数优化
2.7.1 试验结果
由表3中的极差R值可知,各因素对石莼SDF蛋白质脱除率和SDF保留率的影响大小顺序均是:A >C>B >D,即酶解液pH>超声温度>碱性蛋白酶使用量>超声时间,但其蛋白质脱除率和SDF保留率的优化工艺条件组合分别是A2B3C2D2 、A3B2C1D1。由于上述两个指标的优化组合条件不同,故以综合评分来表示试验结果。该处理的综合评分(Z)是将试验各指标的权值加和后得到。指标的权重分别为:蛋白质脱除率占70%、SDF保留率占30%。综合分值公式根据刘魁英的计算方法[22],公式如下:
Zi=(Yi-Ymin)/(Ymax-Ymin);Z=Z1×0.7+Z2×0.3
(3)
式中:Zi为各项指标的得分,Z1为石莼SDF的蛋白质脱除率,Z2为石莼SDF保留率,Z为综合得分;Yi为每组试验各指标值,Ymax为各指标中最大数值,Ymin为各指标中最小数值;0.7、0.3分别为SDF蛋白质脱除率与SDF保留率的加权系数,结果见表4。表4为根据综合评分后获得的极差R值结果,该表数据显示:当pH为11.0、酶使用量为1 400 U/g、超声温度为50℃、超声时间为1.5 h时,石莼SDF的蛋白质脱除效果最好。表6方差分析表明,在本试验的条件下,酶解液pH和碱性蛋白酶使用量对石莼SDF的蛋白质脱除率均为极显著(P<0.01)影响;而超声温度对石莼SDF保留率的影响显著(P<0.05),超声时间影响不显著(P>0.05)。

表3 正交试验设计结果与分析(n=3)

表5 综合评分法极差分析表

表6 综合评分法的正交试验方差分析表
注:*、**分别表示在α为0.05、0.01水平显著;F0.05(2,2)=19.00;F0.01(2,2)=99.00。
Notes:*,* * in the alpha indicated 0.05,0.01 significant level,respectively.F0.05(2,2)=19.00;F0.01(2,2)=99.00.
2.7.2 参数优化及验证性试验
表5数据显示,以综合评分为指标,优化后的石莼SDF脱蛋白关键工艺条件组合为A2B3C2D2,即pH 11.0、碱性蛋白酶使用量1 400 U/g、超声温度50℃、超声时间1.5 h,以此为条件,结合其他因素的理想水平进行验证性试验,重复三次,石莼SDF的蛋白质平均脱除率为(83.91±0.18)%,石莼SDF平均保留率为(86.23±0.25)%。
3 小结
酶法脱蛋白是利用蛋白酶分解石莼SDF粗品中存在的游离蛋白和与SDF相结合的蛋白质,将其降解成肽类、氨基酸等小分子,从而达到脱除蛋白的效果。本研究采用超声波辅助酶法脱除石莼SDF中蛋白质,通过超声波振动传递的能量,可改变大分子物质的结构、功能,以此加快进程[23],为后续石莼SDF的组成、结构、活性等相关研究及其开发利用提供理论参考。
基于单因素试验,在控制石莼SDF浓度为0.6%和超声功率为200 W的前提下,以石莼SDF溶液的pH值、碱性蛋白酶使用量、超声温度、超声时间为关键因素,以石莼SDF的蛋白质脱除率和石莼SDF保留率为指标,进行L9(34)正交试验,获得加权综合后的石莼SDF脱蛋白工艺参数的最佳优化组合条件是酶解液pH 11.0、碱性蛋白酶使用量1 400 U/g、超声温度50℃、超声时间1.5 h,SDF蛋白质平均脱除率为(83.91±0.18)%,SDF平均保留率为(86.23±0.25)%。
参考文献:
[1]Chen P,Sun Y J,Zhu Z C,et al.A controlled release system of superoxide dismutase by electrospun fiber and its antioxidant activity in vitro [J].Journal of Materials Science Materials in Medicine,2010,21(2):609-614.
[2]Lópezrubio A,Sanchez E,Sanz Y,et al.Encapsulation of Living Bifidobacteria in Ultrathin PVOH Electrospun Fibers[J].Biomacromolecules,2009,10(10):2823-2829.
[3]高美风,俞婷婷.黄芪多糖中脱蛋白方法的研究[J].中华中医药学刊,2008,26(3):614-615.
[4]郭思维.虫草多糖脱色脱蛋白工艺研究及抗NCI-H446肿瘤细胞活性检测[D].长沙:湖南师范大学,2014.
[5]王娜.费菜多糖的提取及分离纯化研究[D].泉州:华侨大学,2013.
[6]张丽美.粕多糖提纯工艺、结构初探及体外抗氧化研究[D].南昌:南昌大学,2013.
[7]何余堂,高虹妮,解玉梅,等.超声波协同酶法制备杏仁皮中水溶性膳食纤维及理化研究[J].食品工业科技,2013,34(1):229-232.
[8]Ye C,Ran Y,Luo Y,et al.Novel blasting extrusion processing improved the physicochemical properties of soluble dietary fiber from soybean residue and in vivo,evaluation[J].Journal of Food Engineering,2014,120(1):1-8.
[9]张贺.玉米皮中多糖的提取、纯化、结构表征及抗氧化性的研究[D].黑龙江:黑龙江八一农垦大学,2015.
[10]杨强.银杏果多糖的提取分离及功能特性研究[D].沈阳:沈阳农业大学,2013.
[11]陈俊真.酶法脱除香菇粗多糖蛋白质的工艺研究[J].食品工业,2011,(1):34-36.
[12]Wei X,Chen M,Xiao J,et al.Composition and bioactivity of tea flower polysaccharides obtained by different methods [J].Carbohydrate Polymers,2010,79(2):418-422.
[13]Chen X P,Wang W X,Li S B,et al.Optimization of ultrasound-assisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J].Carbohydrate Polymers,2010,80(3):944-948.
[14]Dhingra D,Michael M,Rajput H,et al.Dietary fibre in foods:a review[J].Journal of Food Science & Technology,2012,49(3):255-266.
[15]孔美兰,刘谋泉,孔德虎,等.超声波辅助酶法水解寻氏肌蛤蛋白[J].食品研究与开发,2014,(6):19-22.
[16]王婷,何荣海,马海乐.物理场对酶活力的影响[J].食品工业科技,2010,31(6):401-403.
[17]何余堂,高虹妮,解玉梅,等.超声波协同酶法制备杏仁皮中水溶性膳食纤维及理化研究[J].食品工业科技,2013,34(1):229-232.
[18]宋国胜,胡松青,李琳.超声波技术在食品科学中的应用与研究[J].现代食品科技,2008,24(6):609-612.
[19]麻佩佩,陈雪峰,李睿.挤压苹果渣中膳食纤维的酶法改性工艺条件研究[J].食品科技,2013,(3):88-91.
[20]曲玲玉,李大为,张鹏,等.酶水解制备山药皮可溶性膳食纤维及性能测定[J].天然产物研究与开发,2015,(3):496-501.
[21]岳金玫.攀枝花块菌多糖的提取、纯化及抗氧化活性研究[D].成都:四川农业大学,2012.
[22]刘魁英.食品研究与数据分析[M].北京:中国轻工业出版社,2009.
[23]唐志红,王硕,鞠宝,等.超声波协同酶法提取浒苔多糖工艺的研究[J].烟台大学学报(自然科学与工程版),2013,26(4):303-306.
