链状亚历山大藻谷氨酰胺合成酶的分离纯化及酶学特性研究
2018-04-27
(福建省海洋环境与渔业资源监测中心,福建 福州 350003)
不管是高等植物还是低等植物,氮素的同化都是一个非常重要的生理过程。无机氮只有被转化为有机氮,才能被植物细胞所吸收利用。细胞内氮的吸收同化过程有三个主要步骤:第一步是氮的跨膜运输,环境介质中的氮被转运到细胞内;第二步是硝酸盐在硝酸还原酶(NR)和亚硝酸还原酶(NiR)作用下转化成氨;第三步是氨在谷氨酰胺合成酶(GS)的作用下被转化为有机氮。GS作为细胞内氮和碳同化的枢纽,在这一同化过程中起着关键性的作用[1-5]。
海洋赤潮是一个严重的生态问题,尤其是有毒赤潮,越来越引起重视。链状亚历山大藻是全球分布较广的有毒赤潮藻种,能产生麻痹性贝类毒素(PSP毒素),毒害人类、鸟类和鱼类[6-8]。本研究以链状亚历山大藻为实验材料,通过离子交换、分子筛和疏水层析等纯化技术来分离纯化GS,并对GS的理化特性进行研究,为从生物化学角度更深入认识链状亚历山大藻对氨的同化机制及氮营养生理提供理论依据。
1 实验材料与方法
1.1 实验材料
链状亚历山大藻分离自长江口,由厦门大学近海海洋环境科学国家重点实验室种质中心提供。藻种培养条件是光照周期(光照14 h,黑暗10 h),光照强度为4 000 Lux,培养温度为21℃。实验用海水采自台湾海峡外海水。海水经过0.45 μm孔径的滤膜过滤后,高温灭菌,然后保存在黑暗处。
藻类培养采用半连续培养的方法。链状亚历山大藻经缺氮f/2培养基驯化后,添加硝酸盐并在第二天GS活力达到最高值后,收集藻细胞用于GS的分离纯化。
1.2 实验方法
1.2.1 GS活力测定
在富集得到的藻细胞中加入1 mL GS抽提液,超声破碎(功率280 W,2 s),间隔时间2 s,破碎次数40次,破碎后的藻细胞在70 000×g下离心50 min,每mL上清液中加入100 mmol/L、pH 7.0的链霉素硫酸盐0.1 mL,充分混合均匀后在70 000×g下离心50 min,得到GS粗提液,按照Bernard等的方法测定GS活力[9]。
1.2.2 GS纯化
用孔径5 μm筛绢过滤收集藻液90 L,离心浓缩至50 mL离心管中(8 000×g,10 min)。加入酶抽提液buffer A(2 mL/g):50 mmol/L tris-HCl、pH=7.5、2 mmol/L DTE、1 mmol/L EDTA 和2.5 mmol/L MgCl2,冰浴超声破碎,功率为280 W,间隔时间/工作时间=2 s/2 s,破碎5 min。破碎后的粗提液加入一定量的酶抽提液在70 000×g下超高速离心,温度4℃,时间50 min。取上清液加入200 μL的链霉素(100 μL/mL)混匀,在70 000×g超高速离心,50 min。上清液用0.45 μm孔径的膜过滤。粗提液通过预先用buffer A平衡过的DEAE-Seoharose column(2.6 cm×25.0 cm),采用0.15至1.00 mmol/L 的NaCl梯度洗脱,收集各组分,测定GS活力。洗脱速度4 mL/min,总洗脱体积400 mL。将DEAE-Seoharose收集到的酶液用超低温真空浓缩至3 mL,用Sephacry1 S-300分子筛柱(1.6 cm×100.0 cm)进一步纯化,用含0.15 mol/L的NaCl缓冲液洗脱,收集各组分,测定GS活力。获得的酶液用超低温真空浓缩至3 mL,经Phenyl-Sepharose CL-4B层析柱(1.6 cm×20.0 cm)进一步纯化,收集各组分,测定GS活力。
1.2.3 GS亚基分子量测定
根据Davis[10]的方法,采用聚丙烯酰胺凝胶电泳测定亚基分子量。
1.2.4 总分子量测定
采用Sephacry1 S-300分子筛柱(1.6 cm×100.0 cm)分离的方法确定。
1.2.5 GS特性研究
反应最适温度和最适pH:GS活力反应温度梯度分别为5、10、15、20、25、30和40℃,pH梯度分别为4.0、5.0、6.0、6.5、7.0、8.0、9.0和10.0。
金属离子对GS活力的影响:选择Fe3+、Fe2+、Cu2+、Mn2+、K+、Zn2+、Ni2+、Ca2+、Ce2+和Mg2+金属例子,反应浓度均为0.5 M。
1.2.6 蛋白含量测定
根据Bradford[11]的方法测定收集峰的蛋白含量,以牛血清蛋白作为标准蛋白。
2 实验结果
2.1 GS纯化
GS粗提物经离子交换柱梯度洗脱结果见表1。DEAE-Sepharos柱(2.6 cm×25.0 cm)经缓冲液预平衡后,用0.15~0.50 mol/L NaCl线性梯度洗脱GS粗提物,根据快速蛋白检测结果分步收集各组峰,并对收集峰进行GS活力测定,当NaCl浓度洗脱至0.32 mol/L时,GS蛋白被洗脱下来,GS活力为3.55 U·mg-1protein。GS凝胶过滤层析洗脱结果表明离子交换层析所得GS样品经冷冻干燥后浓缩至3 mL,上样至Sephacry1 S-300凝胶层析柱中,用0.15 mol/L NaCl抽提缓冲液进行洗脱,收集洗脱峰进行GS活力检测,GS活力为15.6 U·mg-1protein。将凝胶过滤层析所得GS样品,上样至Phenyl-sepharose CL-4B疏水层析柱中,用含70%乙二醇缓冲液进行洗脱,收集洗脱峰进行酶活检测,GS活力为19.86 U·mg-1protein。
2.2 GS分子量及亚基分子量确定
链状亚历山大藻GS分子量采用凝胶过滤法来确定。标准蛋白峰洗脱体积分别为:蓝色葡聚糖(Blue dextran)2 000,45.45 mL;甲状腺球蛋白(Thyroglobulin),54.35 mL;铁蛋白(Ferritin),60.09 mL;醛缩酶(Aldolase),66.53 mL;伴白蛋白(Conalbumin),69.84 mL;卵清蛋白(Ovalbumin),71.00 mL。GS样品峰洗脱体积为60.35 mL,通过计算得出GS分子量为430 kD。
链状亚历山大藻GS亚基分子量通过变性凝胶电泳来确定,见图1,通过换算得到亚基分子量大小为55.6 kD。

2.3 GS酶学特性研究
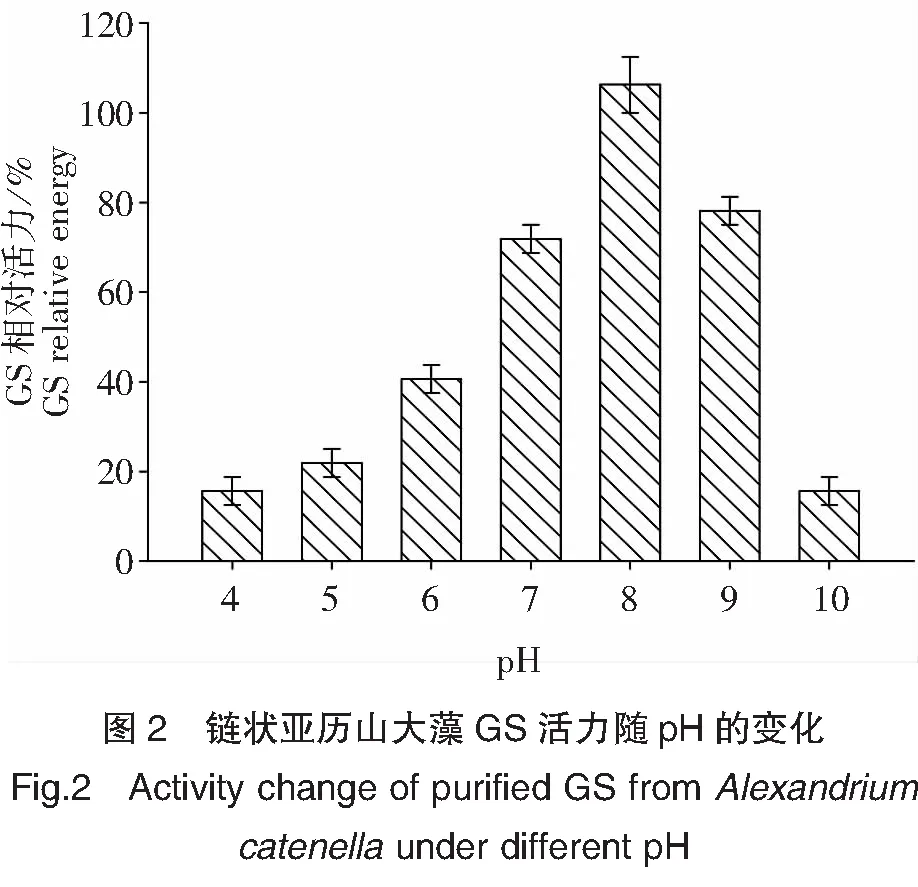
纯GS酶学特性结果表明链状亚历山大藻GS反应的适宜pH范围为7.5到9.5,其中最大酶活力pH为8.0(图2)。GS活力随温度的增加而增加,至25℃时,GS活力达到最大,而后随温度的进一步增加而降低(图3)。金属离子对GS活力影响较大:Fe2+和Fe3+离子参加的反应中未检测到酶活力,Mg2+离子参加的反应中酶活力最高,Cu2+、Ce2+、Mn2+、Ca2+、Ni2+、Zn2+和K+对GS活力有不同程度的抑制作用(图4)。
3 讨论
链状亚历山大藻GS粗提物经DEAE-Sepharose离子交换、Sephacry1 S-300分子筛凝胶过滤和Phenyl-sepharose CL-4B疏水层析等分离纯化步骤后,最终得到纯化的GS,纯化倍数为130,酶活为19.86 U·mg-1protein,其中在离子交换层析过程中,GS量损失最大,但纯化倍数最高(表1)。GS的催化作用受到环境因子的影响,反应环境中温度、pH和离子强度等因素的变化都会影响酶的活力,特别是经过抽提及纯化过程处理后,导致酶损失较大,加上链状亚历山大藻中GS含量极低,致使得率比较低,因此在进行GS纯化时,纯化速度要快,操作要连续。


Mann等[12]、Hirel等[13]研究表明,植物细胞中的GS同功酶因定位不同而产生差异,根据细胞中分布,分为GS1和GS2,GS1以细胞质型GS形式存在;GS2以叶绿体型GS形式存在。根据组成GS单体分子量差别,分为GSⅠ、gGSⅡ和gGSⅢ。Kumadaet等[14]、Amaya[15]等认为GSⅠ广泛分布在细菌、古细菌、真核生物中,其亚基分子量大小为55 kD;GSⅡ分布在植物共生菌、真核生物中,其亚基分子量大小为36 kD;GS Ⅲ分布在蓝细菌中,其亚基分子量为75 kD;相对于GSⅠ,GSⅡ和GSⅢ分布的种类很有限。Meister[1]和Kleinschmidt[16]研究表明,植物和动物组织来源的GS的分子量一般在400 kD左右,有8个相同的亚基组成,但在不同细菌类群中,GS分子量大小差别较大。本实验结果表明,链状亚历山大藻的GS分子量大小为430 kD,由8个分子量为55.6 kD亚基组成。根据亚基分子量大小判断,链状亚历山大藻GS属于GSⅠ类型。

表1 链状亚历山大藻GS纯化
pH是影响酶活力的一个重要因子。细胞或生物体内的酶常常在某一pH范围内才表现出较大活力,而表现出酶最大活力时的pH称为酶的最适pH。pH对酶反应速率的影响,一方面是由于酶本身是蛋白质,过酸或过碱易使酶变性失活;另一方面是pH影响了酶分子的活力中心上有关基团的解离或底物的解离,影响酶与底物的结合,从而影响酶的活力。研究表明,不同生物其GS反应的最适pH范围也不相同。Ahmed等[17]研究多种海洋浮游植物GS反应最适pH范围时发现,GS反应的最适pH范围为7.0到8.0。Bressler等[2]报道,中肋骨条藻(Skeletonemacostatum)、鲁兹帕夫藻(Pavlovalutheri)、伪矮海链藻(Thalassiosirapseudonana)等GS的最适反应pH为7.0到7.8。García-Fernández等[18]报道Monoraphidriumbraunii绿藻的 GS反应最适pH范围为7.5 到8.0。Kim等[19]在研究Klebsiellapneumoniae细菌GS在 pH为8.0时酶活力最大。本研究发现,链状亚历山大藻GS反应较适pH范围较广,为7.5~9.5,其中最大酶活力为pH 8.0。
温度是影响酶活力的另一个重要因子。绝大多数酶在低温时酶反应进行缓慢,当温度逐渐升高时,反应速率也逐渐升高,达到最高值后,反应速率随温度的进一步升高迅速降低[1]。在一定条件下,一种酶只在某一温度时活力最大,该温度就是酶反应的最适温度。链状亚历山大藻GS在温度5~40℃范围均能反应,最适的反应温度为25℃。
GS参加的反应需要在一定金属离子作为底物的条件下才能进行,且对金属离子具有选择性。Kim等[19]在研究Klebsiellapneumoniae细菌GS特性发现,该菌GS在金属Mn2+、Cu2+、Ni2+存在下,GS活力能表达,而在Fe2+、Fe3+、K+、Pb2+、Zn2+、Ca2+、Ce2+存在下GS活力为0。Kameya[20]等在研究嗜热链球菌(Hydrogenobacterthermophilus)时也发现GS在金属Mg2+离子存在下活力最高。本研究发现Cu2+、K+、Zn2+、Ni2+、Ca2+、Ce2+和Mn2+对GS有不同程度的抑制作用,Fe2+和Fe3+则完全抑制了GS的活力,而在Mg2+离子存在下活力最高(图4)。
4 小结
1)链状亚历山大藻GS粗提物经DEAE-Sepharose离子交换、Sephacry1 S-300分子筛凝胶过滤和Phenyl-Sepharose CL-4B疏水层析等处理后,得到纯的GS,分子量为430 kD,由8个分子量为55.6 kD的亚基组成。按照亚基分子量的大小判断,链状亚历山大藻GS属于GSⅠ类型。
2)GS反应的最适pH和温度分别为8.0和25℃。Mg2+离子参与的GS反应,GS活力表达最高,Cu2+、K+、Zn2+、Ni2+、Ca2+、Ce2+、Mn2+对GS活力均有一定的抑制作用,Fe2+和Fe3+则完全抑制了GS活力。
3)本研究从链状亚历山大藻中分离、纯化GS,但所做工作还比较初步,对GS的认识还有待进一步深入研究,如GS的分子调控机制和不同营养盐条件下GS的表达等,有助于更加深入地认识链状亚历山大藻的氮营养生理特性和赤潮形成的营养学机制。
参考文献:
[1]Meister A.Glutamine synthetase of mammals [J].Enzymes,1974,10:699-754.
[2]Bressler S L,Ahmed S I.Detection of glutamine synthetase activity in marine phytoplankton:Optimization of the biosynthetic assay [J].Marine Ecology Progress,1984,14(2-3):207-217.
[3]Caputo C,Criado M V,Roberts I N,et al.Regulation of glutamine synthetase 1 and amino acids transport in the phloem of young wheat plants [J].Plant Physiology & Biochemistry,2009,47(5):335-342.
[4]Thomsen H C,Eriksson D,Møller I S,et al.Cytosolic glutamine synthetase:a target for improvement of crop nitrogen use efficiency? [J].Trends in Plant Science,2014,19(10):656-663.
[5]Li Y,Wang M,Zhang F,et al.Effect of post-silking drought on nitrogen partitioning and gene expression patterns of glutamine synthetase and asparagine synthetase in two maize(Zeamays,L.)varieties [J].Plant Physiology & Biochemistry,2016,102:62-69.
[6]Abi-Khalil C,Finkelstein D S,Conejero G,et al.The paralytic shellfish toxin,saxitoxin,enters the cytoplasm and induces apoptosis of oyster immune cells through a caspase-dependent pathway [J].Aquatic Toxicology,2017,190:133-141.
[7]Shin H H,Li Z,Kim E S,et al.Which species,Alexandriumcatenella(Group I)orA.pacificum(Group IV),is really responsible for past paralytic shellfish poisoning outbreaks in Jinhae-Masan Bay,Korea? [J].Harmful Algae,2017,68(6):31-39.
[8]林佳宁,颜天,张清春,等.福建沿海米氏凯伦藻赤潮对皱纹盘鲍鳃组织抗氧化酶活性的影响研究[J].海洋科学,2016,40(6):17-22.
[9]Bernard S M,Møller A L B,Dionisio G,et al.Gene expression,cellular localization and function of glutamine synthetase isozymes in wheat(TriticumaestivumL.)[J].Plant Molecular Biology,2008,67(1-2):89-105.
[10]Davis B J.Disc electrophoresis.Ⅱ.method and application to human serum proteins [Z].Annals of the New York Academy of Sciences,1964,121(2):404-427.
[11]Bradford M M A.A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of proteindye binding [J].Analytical Biochemistry,1976,72(s1-2):248-254.
[12]Mann A F,Fentem P A,Stewart G R.Tissue localization of barley(Hordeumvulgare)glutamine synthetase isoenzymes [J].FEBS Letters,1980,110(2):265-267.
[13]Hirel B,Gadal P.Glutamine Synthetase Isoforms in Pea Leaves:Intracellular Localization [J].Zeitschrift Für Pflanzenphysiologie,1981,102(4):315-319.
[14]Kumada Y,Benson D R,Hillemann D,et al.Evolution of the glutamine synthetase gene,one of the oldest existing and functioning genes [J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(7):3009-3013.
[15]Amaya K R,Kocherginskaya S A,Mackie R I,et al.Biochemical and mutational analysis of glutamine synthetase type III from the rumen ana erobeRuminococcusalbus8 [J].Journal of Bacteriology,2005,187(21):7481-7491.
[16]Kleinschmidt J A,Kleiner D.The glutamine synthetase fromAzotobactervinelandii:purification,characterization,regulation and localization [J].European Journal of Biochemistry,1978,89(1):51-60.
[17]Ahmed S I,Kenner R A,Packard T T.A comparative study of the glutamate dehydrogenase activity in several species of marine phytoplankton [J].Marine Biology,1976,39(1):93-101.
[18]García-Fernández J,López-Ruiz A,Humanes L,et al.Purification and characterization of glutamine synthetase from the green algaMonoraphidiumbraunii[J].Plant Science,1997,123(1-2):77-84.
[19]Kim Y J,Yoshizawa M,Takenaka S,et al.Ammonium assimilation inKlebsiellapneumoniaeF-5-2:That can utilize ammonium and nitrate ions simultaneously purification and characterization of glutamate dehydrogenase and glutamine synthetase [J].Journal of Bioscience and Bioengineering,2002,93(6):584-588.
[20]Kameya M,Arai H,Ishii M,et al.Purification and properties of glutamine synthetase fromHydrogenobacterthermophilus,TK-6 [J].Journal of Bioscience & Bioengineering,2006,102(4):311-315.
