叶黄素和虾青素对大黄鱼体色及抗氧化能力的影响
2018-04-27,,,
,, ,
(集美大学水产学院,农业部东海海水健康养殖重点实验室,福建 厦门 361021)
大黄鱼(Larimichthyscrocea)是我国传统“四大海产”之首,目前是我国养殖产量最高的海水鱼类,为我国八大优势出口养殖水产品之一[1]。由于长时间人工增养殖,缺乏有效良种选育,加之养殖环境恶化及配合饲料与天然饵料之间的营养差异,造成养殖大黄鱼出现体色退化、体脂含量过高、抗病力下降等现象,极大地影响其商品价值及养殖效益。因此,如何改善大黄鱼的体色并提高其免疫能力是大黄鱼产业亟需解决的问题。
类胡萝卜素分为胡萝卜素类和叶黄素类,其中虾青素和叶黄素属于叶黄素类。研究表明,类胡萝卜素不仅能有效改善养殖鱼类的体色[2-4],还因其分子结构中含多个共轭双键,能够有效地清除动物体内的自由基,减少自由基对细胞遗传物质和细胞膜的损伤而具有抗氧化作用,此外还能增强动物的免疫力,促进动物生长和提高成活率[5]。投喂添加虾青素饲料的大黄鱼亲鱼体内抗氧化能力显著增强[6]。饲料中添加虾青素、叶黄素饲喂大黄鱼幼鱼9周能显著提高其皮肤的红色值和黄色值[7]。饲料色素对鱼类体色及抗氧化能力的影响因鱼种、个体大小、色素添加水平及投喂时间不同会产生不同效果。大黄鱼幼鱼通过摄取外源色素取得的鲜艳颜色在停喂添加色素的饲料后,其体色能否保持至成鱼阶段目前仍不清楚。考虑到全程投喂添加色素饲料会大幅度提高饲料成本,因此本研究旨在探讨类胡萝卜素(虾青素和叶黄素)对大黄鱼成鱼(商品规格)体色和肝脏抗氧化能力的影响效果,以期为饲料色素在大黄鱼的健康养殖及品质改良上的应用提供一些参考依据。
1 材料与方法
1.1 试验鱼
本试验用的大黄鱼由福建省宁德市横屿岛水产有限公司所提供,从海上网箱挑选商品规格平均体质量(365.54±5.83)g大黄鱼2 000尾,并移入室内水泥池驯养一段时间后,开始试验。
1.2 试验饲料
用市售大黄鱼粉状饲料为基础饲料,分别在饲料中添加10%鱼油和不同剂量(0 mg/kg、100 mg/kg、200 mg/kg、300 mg/kg)叶黄素和虾青素(1∶1)混合色素,再加适量水调成糊状,用软颗粒饲料机制成4种含不同色素水平的软颗粒饲料。基础饲料的粗蛋白质、粗脂肪和粗灰分含量分别占干物质的44.4%、16.6%和9.9%,各试验组饲料色素具体添加量见表1。
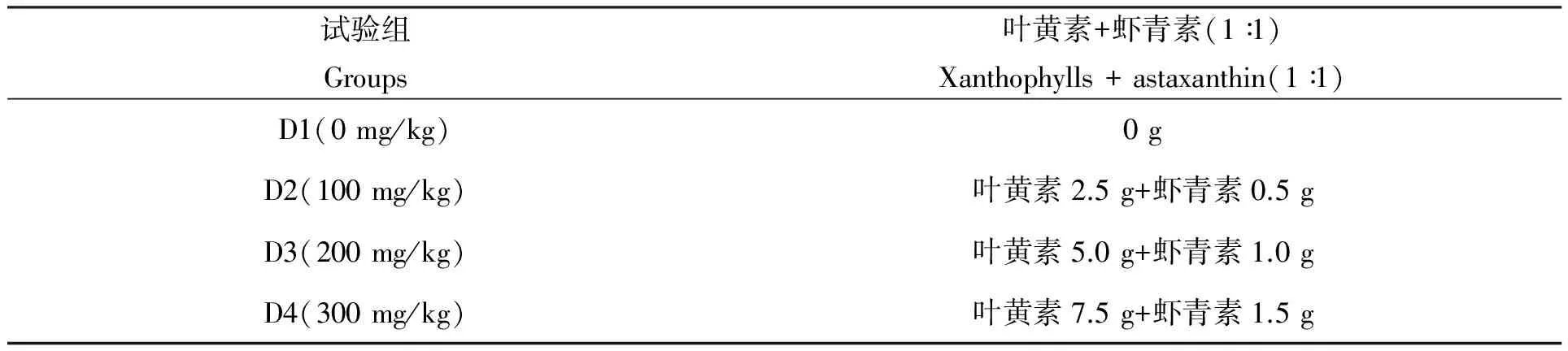
表1 各试验饲料中叶黄素与虾青素添加量
注:添加量根据叶黄素实际含量为2%,虾青素实际含量10%进行换算。
Note:The added amount of feed pigment was calculated by actual contents of xanthophyll(2%)and astaxanthin(10%).
1.3 饲养试验
以基础饲料+10%鱼油的饲料组为对照组(无添加色素,D1组),在对照组饲料中分别添加叶黄素和虾青素(1∶1)混合色素100 mg/kg、200 mg/kg、300 mg/kg的饲料,并分别命名为D2组、D3组和D4组,每组设3个重复,每个重复放150尾饲养于规格为4.0 m×3.5 m×1.8 m室内水泥池,试验为期60 d。
将从海上网箱移入室内水泥池的大黄鱼用对照组饲料驯化直至能摄食配合饲料后开始进行正式饲养试验,试验期间每天投喂饲料2次(上午06∶00,下午17∶00)直至大黄鱼不抢食为止,下午投喂后1 h吸污,每天上午07∶00换水一次,试验期间水温为18.4~23.4℃,pH为7.8~8.0,盐度为 27~29,溶解氧>5 mg /L,氨氮浓度<0.05 mg /L。
1.4 取样及指标测定
1.4.1 皮肤色差值的测定
试验中期及试验结束时各取样一次,取样时间在晚上20∶00~22∶00进行。每个重复随机捞取10尾鱼,用毛巾遮住其眼部以避光,并按住其尾部,使用便携式色彩色差计CM-700d/600d(柯尼卡-美能达,日本)逐尾测定大黄鱼背部及腹部色差值。按照国际发光照明委员会(OE,1976)的规定,分别用L*、a*和b*代表亮度值、红色值和黄色值。色差计使用前用白板进行校准,测定过程中都应避免外源光线对大黄鱼体色的测定造成影响。
1.4.2 肝脏抗氧化指标测定
试验结束时(60 d),每个重复取大黄鱼6尾解剖,取出肝脏,每3尾鱼肝脏合并混匀为一样品,每组共6份样品,分装于塑料封口袋,贮存于液氮罐中带回实验室测定。测定时,取1 g以上的肝脏用冰冷的生理盐水清洗3次后,放到吸水纸上吸干水分,再称取0.5 g组织放入试管中,按比例加入生理盐水(9 mL生理盐水∶1 g样品),用超声反复粉碎(400 A,5 s/次,间隙10 s)3~5次。之后放入低温高速离心机以3 000 r/min离心10 min,制得10%组织匀浆液。各指标测定均采用南京建成生物工程研究所提供的试剂盒进行检测,具体操作参照各试剂盒说明书进行。
1.5 数据分析
相关数据用SPSS22统计软件进行单因素方差分析(ANOVA),若差异显著,则采用LSD多重比较法检验各浓度组之间的差异,差异显著P<0.05。
2 结果
2.1 饲料色素对大黄鱼体色的影响
试验中期(30 d),各组大黄鱼体色测定结果如表2所示。由表2可知,各试验组之间大黄鱼背部及腹部皮肤亮度值(L*)和红色值(a*)均无显著性差异(P>0.05)。但是色素添加组(D2~D4)大黄鱼背部皮肤的黄色值(b*)显著高于对照组(D1)(P<0.05)。其中,D4组显著高于D2和D3组,D2与D3组之间无显著差异(P>0.05)。同样,腹部皮肤的黄色值(b*)色素添加组均显著高于对照组(P<0.05),其中D2组和D4组结果无显著性差异(P>0.05),但都显著高于D3组(P<0.05)。
试验结束时(60 d),各组大黄鱼体色测定结果如表3所示。由表3中可知,背部皮肤中的亮度值(L*)测定结果为D4组显著低于D1、D2和D3组(P<0.05),D1、D2和D3组之间均无显著性差异(P>0.05)。在腹部皮肤的亮度值(L*)测定结果为D2和D3组显著低于D1和D4组(P<0.05),其中D2和D3组、D1和D4组之间无显著性差异(P>0.05),各组之间大黄鱼背部皮肤的红色值(a*)均无显著性差异(P>0.05),D3组腹部皮肤的红色值(a*)显著高于其他试验组(P<0.05)。各色素添加组之间背部皮肤和腹部皮肤的黄色值无显著性差异(P>0.05),但均显著高于对照组(P<0.05)。
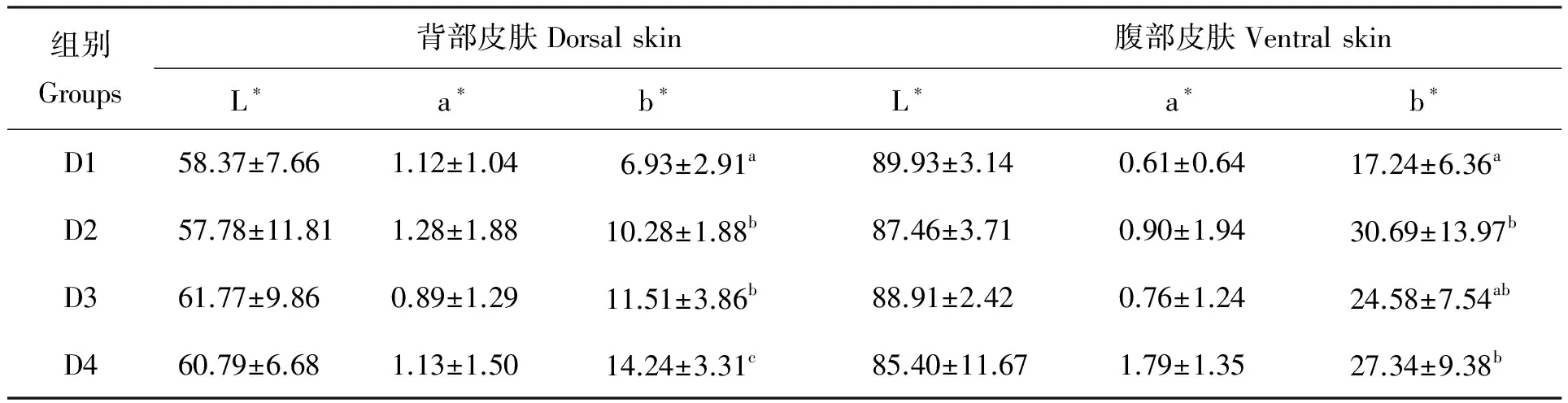
表2 试验30 d后饲料色素对各组试验鱼体色的影响
注:同一列中肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),下表同。L*:亮度值;a*:红色值;b*:黄色值。
Notes:In the same row,values with no letter or the same letter superscripts meant no significant difference(P>0.05),while with different small letter superscripts meant significant difference(P<0.05).The following tables were the same as here.Brightness value was short for L*,red value was a*and yellow value was b*.
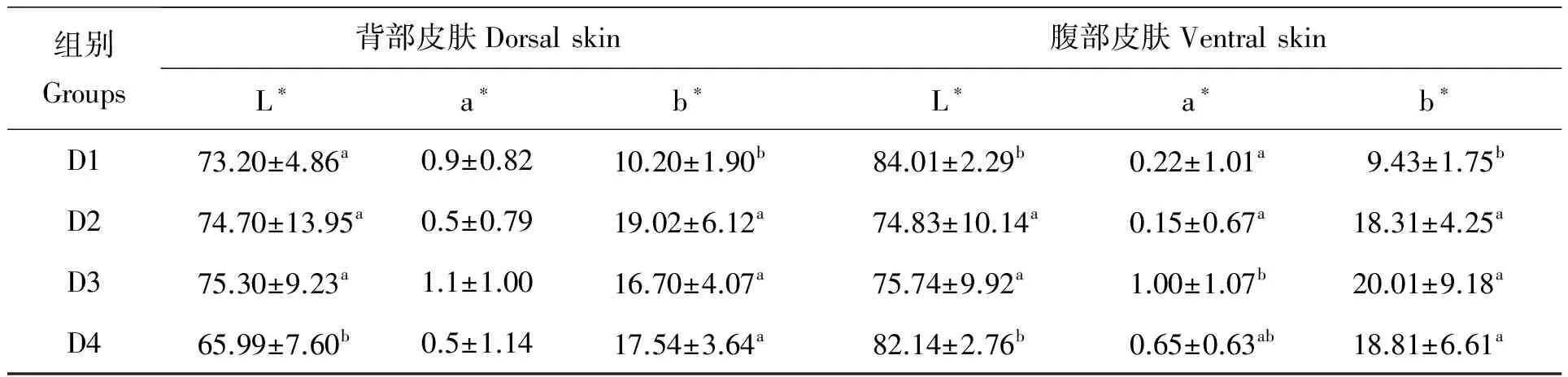
表3 试验60 d时饲料色素对各组试验鱼体色的影响
2.2 饲料色素对大黄鱼抗氧化能力的影响
各组大黄鱼肝脏总抗氧化能力(T-AOC)活力如表4所示。D4组大黄鱼肝脏T-AOC活力最高(4.71 U/mgprot),显著高于D2和D3组,但D2和D3组之间差异不显著(P>0.05)。对照组(D1)大黄鱼肝脏T-AOC活力最低,显著低于其他组(P>0.05)。各组大黄鱼肝脏的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性都随着色素添加水平的增加呈现先上升后下降趋势,D4组两种酶活性均显著低于D3组;D2和D3组SOD酶活性无显著差异,但都显著高于D1组(P<0.05);而D3组CAT活性则显著高于其他组,但D2和D4组之间无显著差异(P>0.05)。D1和D2组肝脏丙二醛(MAD)含量分别为23.55 nmol/mgprot和23.62 nmol/mgprot,显著高于D3(5.79 nmol/mgprot)和D4(2.04 nmol/mgprot)组,且D4组显著低于D3组(P<0.05)。
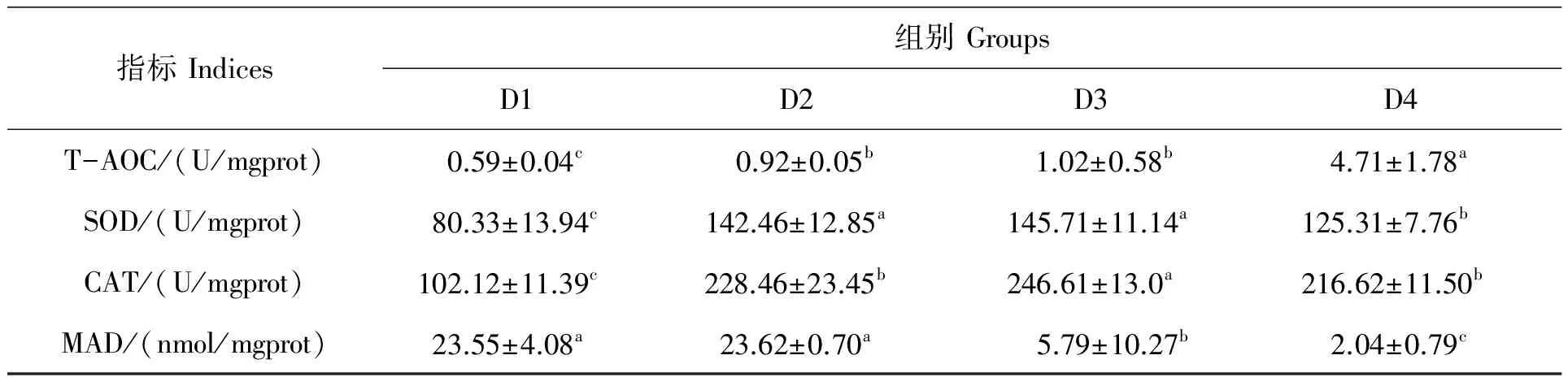
表4 饲料色素对大黄鱼肝脏抗氧化指标的影响
3 讨论
3.1 饲料色素对大黄鱼体色的影响
类胡萝卜素除了能用于改善动物体色外,还具有其它功能,如促进鱼类的生长、提高鱼类的抗病能力和亲鱼的繁殖性能等[8-10]。类胡萝卜素在水产动物上的应用已有不少报道,在杂交大口鲇(CrossNikolskyet)饲料添加类胡萝卜素的饲养试验中发现,随着类胡萝卜素添加量的增加,大口鲇的体色改善效果越明显[11]。在饲料中添加叶黄素对杂交鲶(SilurusmeridionalisChen×Silurusasotus)、金鱼(Carassiusauratus)、血鹦鹉鱼(Cichlasomasynspilum♀×Cichlasomacitrinellum♂)[12-14]等鱼类的体色都有良好的改善效果。添加虾青素的饲料喂养中国金鱼后发现金鱼着色自然,通过化学分析得知金鱼体内的虾青素是以酯化的形式存在。不同鱼类对虾青素的沉积能力不同,这是导致其体内虾青素含量差异大的原因之一[15]。养殖大黄鱼的皮肤颜色均有不同水平的退化,主要是由于投喂饵料中缺乏大黄鱼自身不能合成的类胡萝卜素而造成的。从本研究结果可以看出,通过30 d投喂添加叶黄素和虾青素饲料后,投喂含色素的饲料组与对照组大黄鱼皮肤的亮度值没有显著差别,这与澳大利亚笛鲷(Pagrusauratus)皮肤的亮度值并未受饲料色素的影响的结果相似[16]。大黄鱼背部皮肤的亮度值低于腹部皮肤的亮度值可能是由于背部皮肤中黑色素含量高于腹部皮肤中黑色素含量而造成的[17]。随着色素添加量的提高,大黄鱼背部皮肤黄色值越高,腹部皮肤的黄色值反而降低,但总体相对于对照组来说都有显著性的提高。这可能是背部皮肤和腹部皮肤对不同色素的沉积效果不同所致。从60 d的实验数据结果中可知,随着投喂时间的延长,不管是背部或腹部皮肤的黄色值,各实验组之间的差异并不显著,皮肤黄色值已趋于稳定值。本试验大黄鱼背部及腹部黄色值比大黄鱼幼鱼更快地达到稳定值的原因除了受遗传因素影响外,主要可能是与本试验鱼个体较大和色素添加水平较高有关[7,18]。本实验由于两次测定时间间隔较长,虽然从试验结果可以看出大黄鱼皮肤黄色值趋于稳定值的时间在试验后30~60 d,但具体在哪个时间点,还有待于进一步研究。本试验结果表明,利用外源色素对上市前大黄鱼进行体色调控是有效可行的,并且可以节约色素的使用成本。此外,不同鱼类对类胡萝卜素的利用率不同,如斑点叉尾鱼回(Ictaluruspunctatus)能更好积累黄色素、黄体素和玉米黄质于皮肤中形成黄色体色[19];大西洋鲑(Salmosalar)和虹鳟(Oncorhynchusmykiss)对虾青素的积累能力比角黄素高[20-21]。本实验中大黄鱼皮肤黄色值远高于红色值,这表明大黄鱼对叶黄素的利用率高于虾青素,这与Yi X等[7]对大黄鱼幼鱼的研究结果相似。
3.2 饲料色素对大黄鱼抗氧化能力的影响
动物在正常的生理状态下,活性氧自由基不断产生又不断地被清除,处于动态平衡,从而避免它们对机体造成伤害。其清除机理主要是依靠体内的总抗氧化防御体系,包括酶促(SOD和CAT等)和非酶促体系(维生素、氨基酸、虾青素、金属蛋白等)[22-24]。
总抗氧化能力(T-AOC)是衡量机体抗氧化系统功能状况的综合性指标。崔惟东等[25]在饲料中添加虾青素 、角黄素,结果表明其均可提高虹鳟肝脏总抗氧化能力。本研究结果也证实了在饲料中加入虾青素和叶黄素能够提高大黄鱼肝脏的总抗氧化能力(T-AOC),随着饲料中色素添加量的升高,大黄鱼肝脏T-AOC值也相应升高。
生物机体内的活性氧和自由基的累积将会导致生物体代谢紊乱,酶促和非酶促体系都能产生过氧化氢(H2O2),它是活性氧的前体,有毒害作用[26]。CAT能清除H2O2,还能分解其他的有害物质。赵吉伟等[27]对野生及养殖茴鱼体内ACP、AKP和CAT活力的比较研究表明,CAT清除有害自由基的作用在肝脏中最强,以运动为主的肌肉组织中则相对较弱。本研究结果显示D3组大黄鱼肝脏的CAT活性最高,D2组次之,对照组最小,表明在饲料中加入虾青素和叶黄素,能够提高大黄鱼肝脏CAT的活性,使大黄鱼清除体内H2O2的能力和分解其他有害物质的能力增强。
超氧化物歧化酶(SOD)对平衡机体的氧化与抗氧化过程起着至关重要的作用,此酶能够清除超氧阴离子自由基,保护细胞免受损伤。因此,可以通过检测超氧化物歧化酶和过氧化氢酶活性的变化,来反映机体内的抗氧化状况。李建光等[28]在饲料中添加虾青素、叶黄素、辣椒红素和胡萝卜素阿卜酯四种增色剂,研究其对锦鲤的生长、形体、体色和抗氧化能力的影响,结果表明增色剂能够提高锦鲤的抗氧化能力,随着虾青素添加量的增大,肝胰脏SOD值呈上升的趋势。本试验结果也表明在饲料中加入虾青素和叶黄素能够提高大黄鱼肝脏的SOD酶活性,但是色素的过量添加(300 mg/kg)反而使肝脏的SOD活性出现下降趋势,具体原因有待深入研究。
鱼类在进行正常的生理活动过程中,会产生一定量的氧自由基,氧自由基的产生与消除通常处于动态平衡状态。如果鱼类遇到外源刺激或者内源刺激,机体就会产生过多的氧自由基,导致原有的平衡被破坏,从而产生氧化压力,氧化压力有时会对鱼类造成氧化损伤并促进脂质的过氧化反应[29-30]。氧自由基可以通过过氧化生物膜中多不饱和脂肪酸来引起细胞损伤,还可以通过分解脂氢过氧化物产生可引起细胞损伤的物质。MDA含量可以用来衡量脂质的过氧化程度。赵鑫鑫[31]等分别用添加了100 mg/kg 的虾青素和辣椒红素饲料饲养金鱼和锦鲤,结果表明虾青素组和辣椒红素组的金鱼以及锦鲤的血清和肝脏的MDA含量均显著低于对照组。而本试验中大黄鱼肝脏的MDA含量也随着色素添加量的提高而降低,表明饲料中加入虾青素和叶黄素可显著降低脂质过氧化程度。
参考文献:
[1]《福建鱼类志》编写组编著.福建鱼类志(下卷)[M].福州:福建科学技术出版社,1985:130-132.
[2]冯幼,许合金,刘定,等.鱼类体色研究现状[J].饲料博览,2014,(2):49-52.
[3]冷向军,韦友传.饲料中添加叶黄素对胡子鲶体色的影响[J].水产学报,2003,27(1):38-42.
[4]丁小峰,叶元土,蒋蓉,等.饲料色素对黄颡鱼皮肤类胡萝卜素、叶黄素含量和酪氨酸酶活力的影响[J].水产学报,2010,34(11):1728-1735.
[5]周利梅,周光宏.类胡萝卜素在动物营养中的研究进展[J].粮食与饲料工业,2001,(2):39-41.
[6]席峰,王秋荣,林利民.饲料中n-3 HUFA、降药残添加剂和虾青素添加水平对大黄鱼亲鱼抗氧化酶活性的影响[J].新饲料,2016,(11):38-41.
[7]Yi X,Xu W,Zhou H,et al.Effects of dietary astaxanthin and xanthophylls on the growth and skin pigmentation of large yellow croakerLarimichthyscroceus[J].Aquaculture,2014,433(4):377-383.
[8]Kalinowski C T,Robaina L E,Fernández-Palacios H,et al.Effect of different carotenoid sources and their dietary levels on red porgy(Pagruspagrus)growth and skin colour [J].Aquaculture,2005,244(1):223-231.
[9]Amar E C,Kiron V,Satoh S,et al.Influence of various dietary synthetic carotenoids on bio-defence mechanisms in rainbow trout,Oncorhynchusmykiss(Walbaum)[J].Aquaculture Research,2001,32(Suppl.1):162-163.
[10]Verakunpiriya V,Watanabe K,Mushiake K,et al.Effect of krill meal supplementation in soft-dry pellets on spawning and quality of egg of yellowtail [J].Fisheries Science,1997,63(3):433-439.
[11]袁万安,陈建,童孝兵,等.色素添加剂对大口鲇体色的影响[J].河北渔业,2005,(1):16-18.
[12]史少奕,李小勤,冷向军,等.饲料中添加不同形式叶黄素对杂交鲶体色的影响[J].上海海洋大学学报,2010,19(2):196-200.
[13]冷向军,石英,李小勤,等.饲料中添加叶黄素对金鱼体色的影响[J].浙江大学学报(农业与生命科学版),2010,36(2):168-174.
[14]孙学亮,季延滨,白东清,等.叶黄素混合物对血鹦鹉鱼生长、体色和生理机能的影响[J].吉林农业大学学报,2016,38(6):743-749.
[15]陈晓明,徐学明,金征宇.富含虾青素的发夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[16]Doolan B J,Booth M A,Allan G L,et al.Effects of dietary astaxanthin concentration and feeding period on the skin pigmentation of Australian snapperPagrusauratus(Bloch & Schneider,1801)[J].Aquaculture Research,2009,40(1):60-68.
[17]Hearing V J.Biogenesis of pigment granules:a sensitive way to regulate melanocyte function [J].Journal of Dermatological Science,2005,37(1):3-14.
[18]Torrissen O J,Naevdal G.Pigmentation of salmonids-genetical variation in carotenoid deposition in rainbow trout [J].Aquaculture,1984,38(1):59-66.
[19]Li M H,Robison E H,Oberle D F.Effects of various dietary carotenoid pigments on fillet appearance and pigment absorption in channel catfish,Ictaluruspunctatus[J].Journal of the World Aquaculture Society,2007,38(4):557-563.
[20]Buttle L G,Crampton V O,Williams P D.The effect of feed pigment type on flesh pigment deposition and colour in farmed Atlantic salmon,SalmosalarL [J].Aquaculture Research,2001,32(2):103-111.
[21]Gobantes I,Choubert G,Delanoue J.Astaxanthin and canthaxanthin kinetics after ingestion of individual doses by individual rainbow trout,Oncorhynchusmykiss[J].Journal of Agricultural & Food Chemistry,1997,45(2):454-458.
[22]郭春雨.虾青素对中华绒螯蟹的影响及作用机理[D].保定:河北大学,2007.
[23]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2006,21(10):2069-2074.
[24]Mathew S,Ashok K K,Anandan R,et al.Changes in tissue defence system in white spot syndrome virus(WSSV)infectedPenaeusmonodon[J].Comparative Biochemistry and Physiology Part C:Toxicology Phamacology,2007,145(3):315-320.
[25]崔惟东,冷向军,李小勤,等.虾青素和角黄素对虹鳟肌肉着色和肝脏总抗氧化能力的影响[J].水产学报,2009,33(6):987-995.
[26]谢进金,陈朝阳,史雄略.罗非鱼过氧化氢酶活性的初步研究[J].水利渔业,2006,26(6):16-18.
[27]赵吉伟,李小龙.野生及养殖茴鱼体内ACP、AKP和CAT活力的比较研究[J].水产学杂志,2011,24(4):12-15,36.
[28]李建光,胡世然,刘霆,等.四种增色剂对锦鲤的生长、形体、体色和抗氧化能力的影响[J].中国饲料,2009,(16):33-36.
[29]冯连华.低盐环境对斜带石斑鱼生理、生长的影响[D].广州:广东海洋大学,2012.
[30]徐立红,张甬元,陈宜瑜.分子生态毒理学研究进展及其在水环境保护中的意义[J].水生生物学报,1995,19(2):171-184.
[31]赵鑫鑫.类胡萝卜素对虹鳟、金鱼和锦鲤的着色和抗氧化效应研究[D].上海:上海海洋大学,2016.
