基于枯草芽孢杆菌重组菌株构建技术制备海洋源金属硫蛋白
2018-04-27,,,
,,,
(1.厦门海洋职业技术学院,福建 厦门 361100;2.国家海洋局第三海洋研究所,福建 厦门 361005;3.国家海洋局海洋生物资源综合利用工程技术研究中心,福建 厦门 361005;4.厦门大学,福建 厦门 361005;5.东山出入境检验检疫局综合技术服务中心,福建 东山 363400)
金属硫蛋白(Metallothionein,MT)是一类普遍存在于生物体内的、高度可诱导性的内源金属结合蛋白,具有维持生物体内必须金属含量动态平衡、重金属解毒、清除自由基,改善机体免疫力、增强机体抗应激能力等多种作用[1-3],且与动物机体的生长发育及部分疾病的发病机理有着密切的关系。因此,MT在医学、化妆品、保健食品添加剂、环保等方面得到了广泛应用。
目前,国内市场上常见的MT多数是从兔肝脏中提纯[4],提取工艺中使用大量有机溶剂[5-7],且步骤繁复,产量极低,致使MT的价格极其昂贵,从而使其应用和研究受到限制。采用基因重组技术规模化生产制备金属硫蛋白,对其大规模开发和作用机理的研究有重要意义。目前利用大肠杆菌作为工业生产蛋白质的优选宿主细胞研究MT表达方法多有文献报道[8-9],但其缺少蛋白翻译后进行加工和修饰的功能,且目的蛋白极易形成包涵体,分离纯化繁琐,给生产实践带来困难。
枯草芽孢杆菌(Bacillussubtilis)是一种传统的酶制剂工业生产菌株,具有可操作性强、发酵周期短的优点,可直接将表达产物分泌到培养基中,也是分泌表达外源基因的良好受体菌[10-11]。同时枯草芽孢杆菌不分泌内毒素,具有较好的生物安全性,是美国FDA和我国农业部批准使用的食品安全菌种,其发酵产物可直接用于食品生产中。近年来枯草芽孢杆菌作为外源基因表达的宿主系统发展迅速并展现出良好的工业应用前景[12-16]。
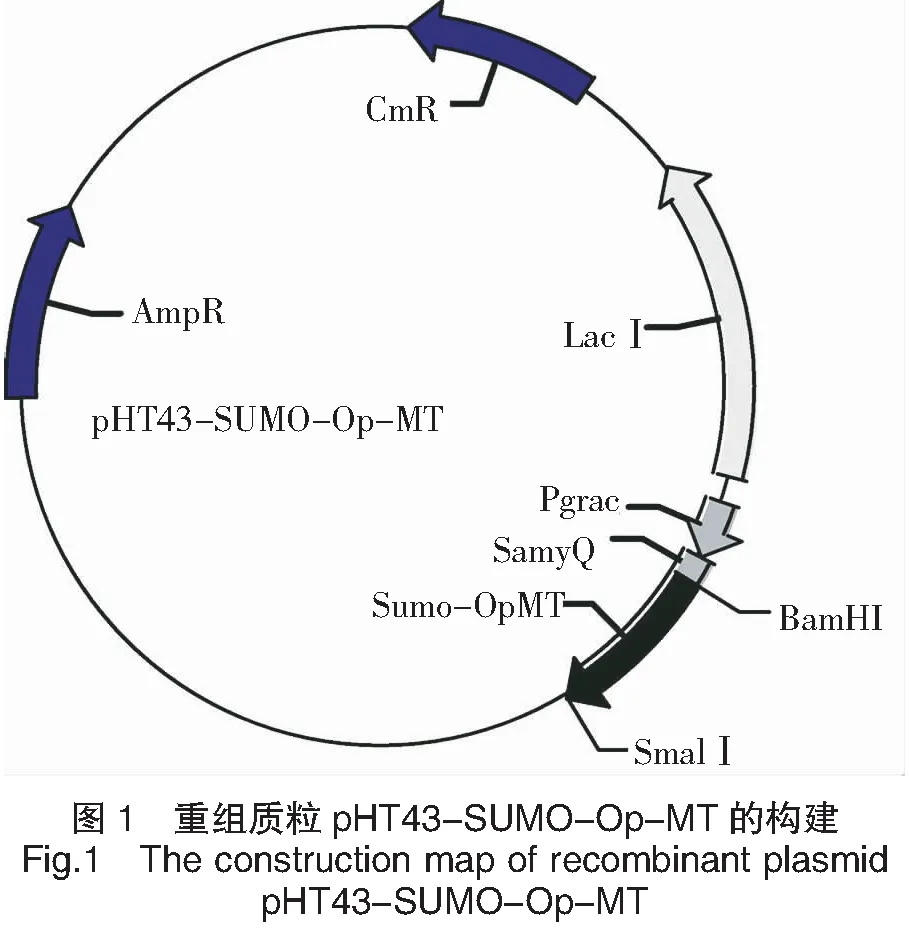
滤食性的底栖双壳类海洋动物对重金属有较强的生物累积能力,海洋贝类MT对重金属具有高敏感的应激效应[17-22],且相对于陆地源MT,海洋源MT具有独特的化学结构和特殊的生物活性。本研究旨在解决制约MT产业发展原料来源瓶颈,应用基因重组技术,将褶牡蛎(Ostreaplicatula)金属硫蛋白基因全长序列Op-MT,插入到表达载体pHT43-SUMO的相应位点,并转入八种蛋白酶缺失的枯草芽孢杆菌WB800N,拟构建安全高效分泌表达的重组枯草芽孢杆菌MT基因工程菌。以期能获得具高安全性、高产量和高活性的高纯目标蛋白,使海洋源MT具有极大地应用于实际工业生产潜能,为天然高效重金属生物解毒剂的成功开发和推广提供理论依据。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和培养基
枯草芽孢杆菌B.subtilisWB800N为厦门大学某博士惠赠,E.coliDH-5α购自宝生物工程(大连)有限公司;质粒载体pMD19-Tvector购自宝生物工程(大连)有限公司,枯草芽孢杆菌表达载体pHT43为本实验室保藏。E.coliDH-5α和枯草芽孢杆菌生长和发酵培养基为LB培养基。
1.1.2 主要试剂
TaqDNA聚合酶、PCR反应试剂、限制性内切酶SacII/BamHI/SmaI、T4 DNA连接酶、质粒提取和胶回收试剂盒购自宝生物工程(大连)有限公司,胰蛋白胨、酵母浸提粉(英国OXOID 公司产品)购自厦门绿茵公司,氨苄青霉素、氯霉素、新霉素为Solarbo公司产品。PCR引物及DNA测序均由上海生物工程技术有限公司完成。氯化镉(CdCl2)购自厦门绿茵试剂有限公司。其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 褶牡蛎金属硫蛋白基因的克隆以及分泌表达载体的构建
运用TRIzol试剂盒提取褶牡蛎内脏团总RNA,采用TaKaRa Prime-Script TM RT Reagent Kit with gDNA Eraser试剂盒(TaKaRa,Japan)进行反转录。根据GeneBank褶牡蛎金属硫蛋白基因序列Op-MT(登录号:KP875559)设计引物(表1,F1/R1),PCR扩增Op-MT基因序列。PCR产物经过回收、连接至克隆载体pMD-19,并转化到E.coliDH-5α中,送至上海生物工程技术进行序列测定。用BamHI/SmaI酶切质粒pMD-19-Op-MT和pHT43-SUMO表达载体,各自胶回收后用T4 DNA连接酶并转化到E.coliDH-5α细胞,在含有100 μg/mL氨苄青霉素(Amp)LB平板上筛选阳性转化子并加以验证。
1.2.2 重组工程菌构建和筛选
以枯草芽孢杆菌B.subtilisWB800N为表达宿主,用电转法转化分泌表达载体pHT43-SUMO,在含有10 μg/mL氯霉素和50 μg/mL新霉素的LB平板上筛选。得到阳性转化子菌株,命名为B.subtilisWB800N/pHT43-SUMO-Op-MT(图1)。
将B.subtilisWB800N/pHT43-SUMO-Op-MT接种到LB液体培养基(10 μg/mL氯霉素和50 μg/mL新霉素)中,37℃培养过夜,收集菌液并提取总DNA,以F2/R2(表1)为引物进行PCR鉴定。
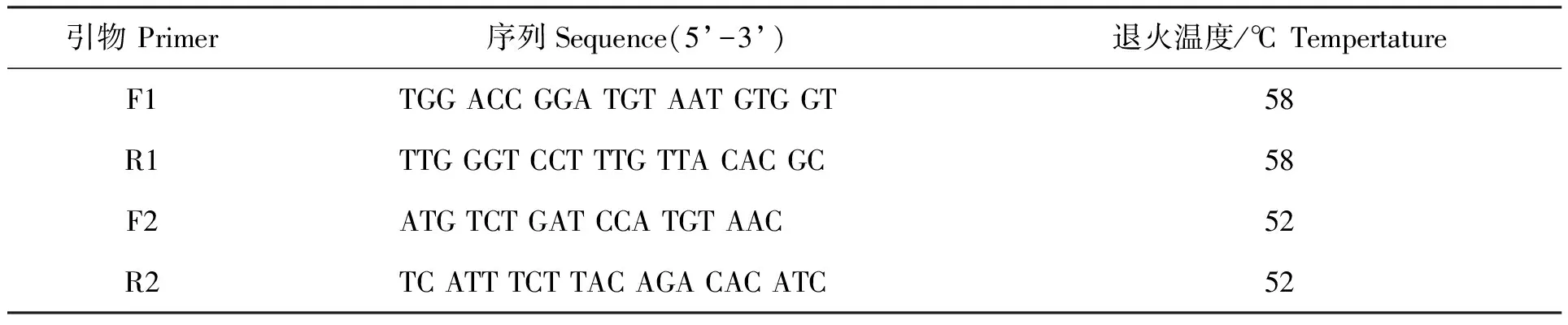
表1 褶牡蛎金属硫蛋白cDNA克隆测序及PCR中所用引物
1.2.3 融合蛋白诱导表达和分离纯化
100 mL WB800N/pHT43-SUMO-Op-MT菌液扩大诱导培养,培养条件:37℃,4 h,1 mmol/L IPTG,220 r/min振荡培养至OD600为0.8~1.0。2、4 h分别离心收集发酵液上清,进行SDS-PAGE凝胶电泳定性,分离胶12%,浓缩胶5%。另一组空白B.subtilisWB800N作为对照。电泳结束后凝胶染色4~6 h,将脱色后的凝胶保存于去离子水中,用Bio-Rad凝胶成像系统拍照。
对发酵液进行His-tag标签亲和纯化。首先,用3个柱体积的TBS(pH 8.0)缓冲液平衡镍柱。然后,将上清液上样,流速约为1 mL/min。上样完毕后,再用3个柱体积的TBS(含50 mmol/L 咪唑,pH 8.0)进行洗涤;随后,用洗脱缓冲液(含300 mmol/L 咪唑,pH 8.0)洗脱目的蛋白,收集各个洗脱峰进行12%的SDS-PAGE凝胶电泳检测。最后利用Bradford method定量目的蛋白。
1.2.4 融合蛋白的 Western blotting鉴定
将重组工程菌诱导表达48 h后的发酵液和空白对照组(B.subtilisWB800N)的发酵液,经丙酮沉淀后进行SDS-PAGE凝胶电泳,转膜(湿转:300 mA,1 h),用5%脱脂奶粉4℃封闭过夜,加入用 TBST(Tris 缓冲盐-吐温溶液,含10 mmol/L pH 7.6 Tris-HCl、150 mmol/L NaCl、0.05% 土温-20)1∶10 000 稀释的 His 一抗,37℃ 孵育1 h,TBST 洗膜3次,每次15 min ;加入用 TBST 1∶20 000 稀释的His 二抗,37℃ 孵育1 h,TBST 洗膜3次,每次15 min;HRP-DAB 底物显色试剂盒显色,用 Bio-Rad 凝胶成像系统拍照。
1.2.5 褶牡蛎金属硫蛋白HPLC检测
将取出的菌液7 000 r/min 10min收集菌液,于80℃下水浴5 min,12 000 rpm/min 离心10 min,后取上清。
MT含量测定:取MT上清液20 μL,依次加入20%(W/V)TCEP溶液3 μL、5 mg/mL的SBD-F溶液10 μL及反应缓冲液(1 mol/L硼酸、30 mmol/L EDTA、0.8 mol/L KOH,pH 10.5)75 μL,震荡混匀,于50℃下水浴反应30 min,反应完成后加入HCl(4 mol/L)10 μL终止反应,然后用20 mmol/L定容缓冲液(pH 7.5)定容至1 mL,旋涡震荡混匀,过0.22 μm水系膜后上HPLC进行MT含量测定。采用HPLC方法测定其中-SH含量以进行MT间接定量[23]。
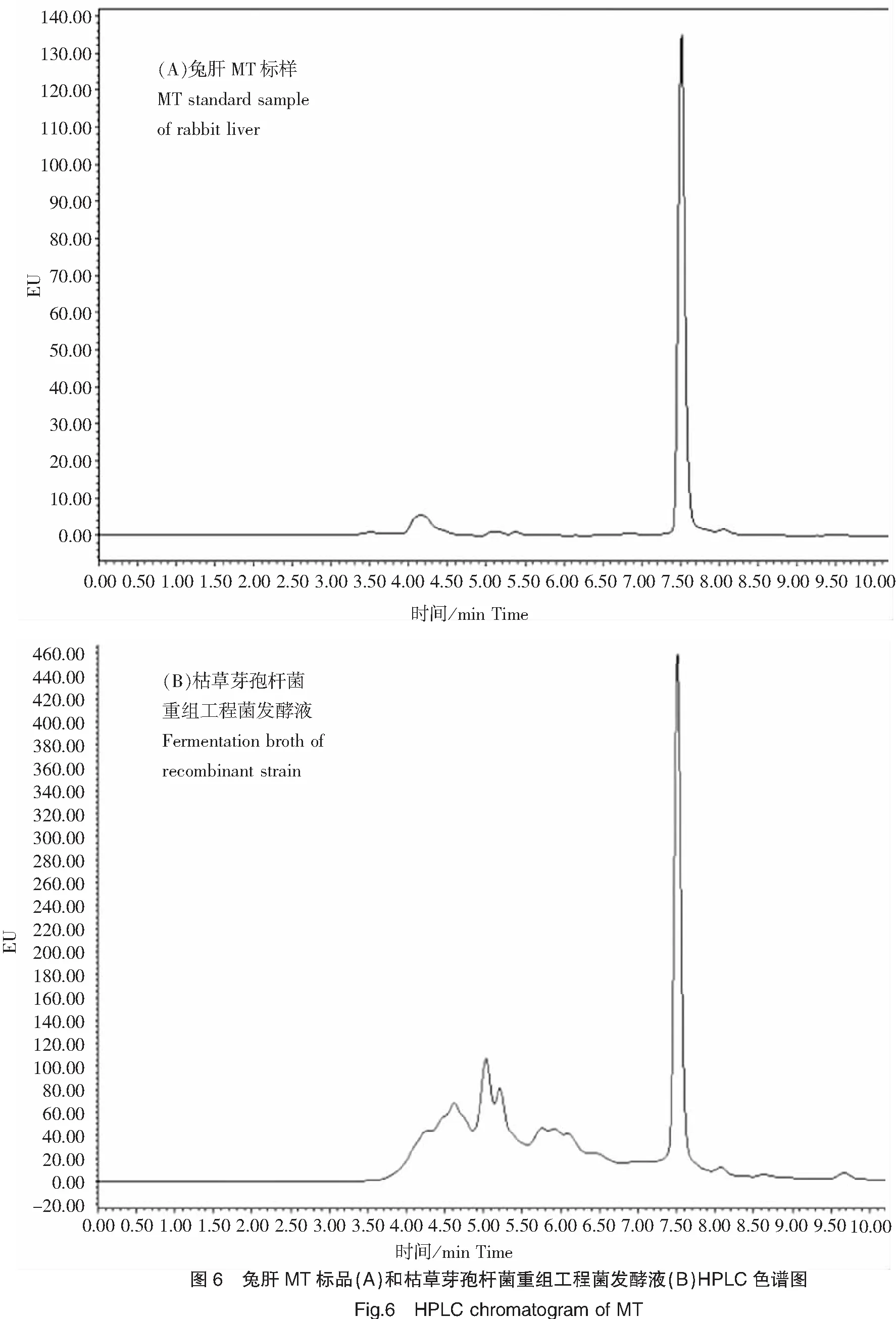
色谱条件:流动相为乙腈∶磷酸缓冲液(25 mmol/L,pH=7.5)∶甲醇=18∶80∶2,色谱柱:ODS-BP(填料:Sinochrom,4.6 mm×250 mm,5 μm)C18柱;进样量:40 μL;洗脱时间:20 min;流速:0.5 mL/min;柱温:25℃;激发波长380 nm,发射波长510 nm。图6(A)为色谱条件下得到的兔肝MT标样色谱图,MT保留时间为7.3~7.7 min。
1.2.6 融合蛋白活性检测
配置50、100、200、500、700 μmol/L的CdCl2工作液各100 μl,分别将其涂布于LB固体培养基平板上,待其完全吸收后,取100 μL OD600为4.0的枯草芽孢杆菌重组Op-MT工程菌均匀涂布于上述平板上,同时以枯草芽孢杆菌WB800N菌株为对照组,37℃倒置培养12~16 h观察菌落生长情况。
2 结果与分析
2.1 PCR扩增Op-MT及分泌表达载体的构建
以褶牡蛎内脏团总RNA反转录得到的DNA为模板,PCR扩增得到目的基因Op-MT与预计大小相符(约为324 bp),见图2。用BamHI/SmaI分别双酶切此PCR产物和分泌表达载体pHT43后用连接酶连接,构建重组质粒pHT43-SUMO-Op-MT。该质粒的酶切验证见图2。酶切片段大小约为660 bp,与预期相符,此片段为目的基因SUMO-Op-MT。
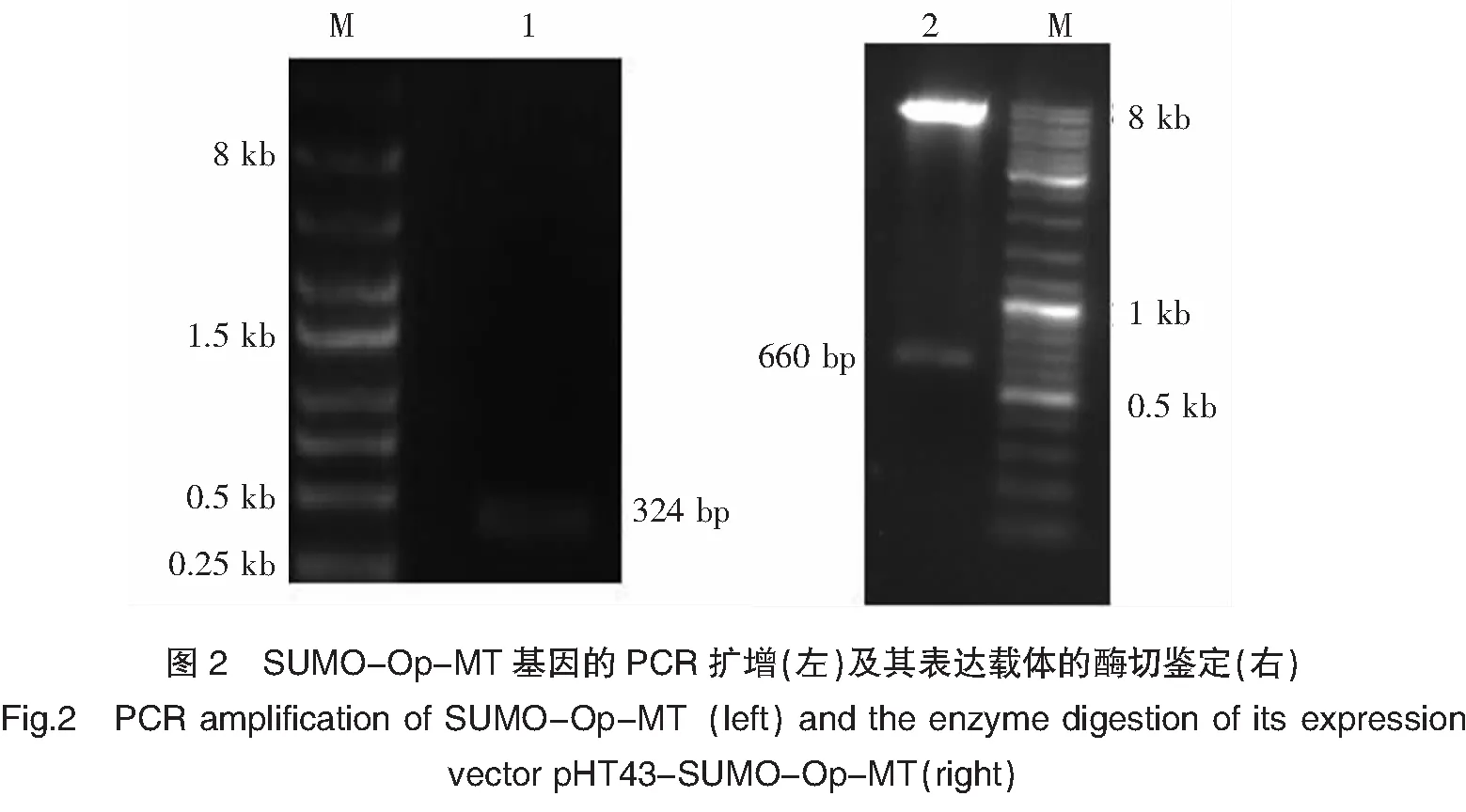
注:左为PCR扩增SUMO-Op-MT基因;M:DNA Marker;1:SUMO-Op-MT扩增产物。右为SUMO-Op-MT表达载体的酶切图;M:DNA Marker;2:表达质粒双酶切。
Notes:Amplification of SUMO-Op-MT gene by PCR(left);M:DNA Marker;1:Gene of SUMO-Op-MT.Restrictive enzyme digestion of SUMO-Op-MT(right);M:DNA Marker;2:Restrictive enzyme digestion of SUMO-Op-MT.
2.2 高效分泌表达 Op-MT 重组工程菌筛选
将重组质粒 pHT43-SUMO-Op-MT 运用化学转化法转化宿主枯草芽孢杆菌B.subtilisWB800N,经过氯霉素和新霉素抗性筛选、PCR鉴定,得到一株高效表达Op-MT的枯草杆菌工程菌B.subtilisWB800N/pHT43-SUMO-Op-MT,见图3。
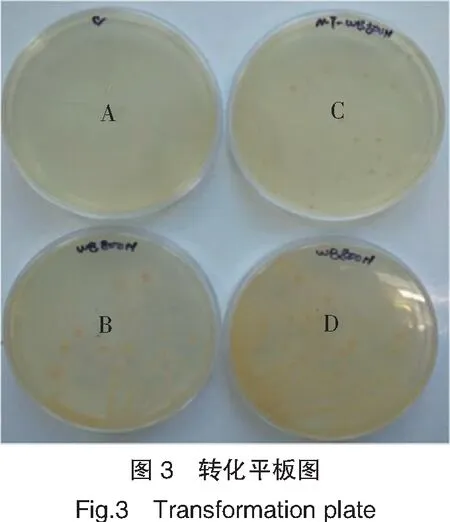
注:A:阴性对照;B:枯草芽孢杆菌WB800N对照;C:重组WB800N-MT枯草芽孢杆菌工程菌;D:枯草芽孢杆菌WB800N对照。
Notes:A:Negative control;B:Control of WB800N bacteria;C:Recombinant bacteria of WB800N-MT;D:Control of WB800N bacteria.
2.3 重组蛋白的诱导表达、分离纯化和Western blotting 鉴定
100 mL WB800N/ pHT43-SUMO-Op-MT菌液扩大诱导培养,培养条件:37℃,4 h,1 mmol/L IPTG。2、4 h分别离心(12 000 r/min,4℃,30 min)收集发酵液上清,进行SDS-PAGE 电泳分析。以未转入表达载体的枯草芽孢杆菌培养液为空白对照(图 4)。分析图4发现在 23 kD(其中Op-MT编码蛋白大小为10.5 kD)位置出现了一条明显的特异性条带,且融合蛋白为可溶形式表达。
利用 His-tag 标签亲和纯化 SUMO-Op-MT 融合蛋白,并用含 500 mmol/L 咪唑、pH 8.0 TBS 洗脱液进行洗脱。收集洗脱峰并进行12% SDS-PAGE 凝胶电泳分析。结果显示,洗脱液中含有分子量约为 23 kD 的目的条带(图 4)。Bradford method 分析结果表明,蛋白纯度在 95% 以上(图 4)(目的蛋白得率0.436 mg/mL)。然后将纯化后的目的蛋白进行 Western blotting 鉴定,结果显示融合蛋白能与 His-Tag 单克隆抗体产生阳性反应(图 5),且与SDS-PAGE 中 SUMO-Op-MT 融合蛋白的位置相符,说明融合蛋白在宿主菌中得到了表达。
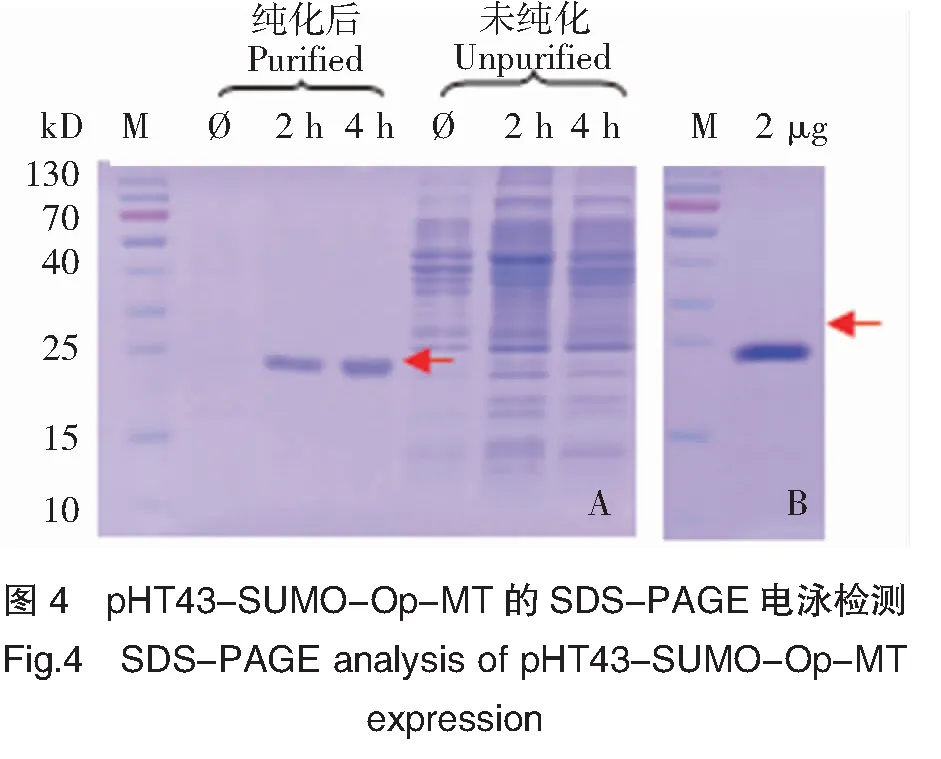
注:M:虹彩蛋白 Marker;Ø:未转化(阴性对照);红色箭头为目的蛋白。
Notes:M:Protein Marker;Ø:Non-transfector(negative control);Red arrowhead:Target protein.
2.4 重组枯草芽孢杆菌发酵液中Op-MT的HPLC检测
以兔肝MT为标样,兔肝MT标品(0.1 mg/mL)和枯草芽孢杆菌重组工程菌发酵液HPLC结果见图6。兔肝MT目的峰的保留时间为7.3~7.7 min。结果显示,枯草芽孢杆菌重组工程菌发酵液在7.7 min有峰出现,说明枯草芽孢杆菌重组工程菌发酵液中含有目的蛋白,枯草芽孢杆菌重组工程菌成功表达了目的蛋白Op-MT,表达量为0.13 mg/mL。
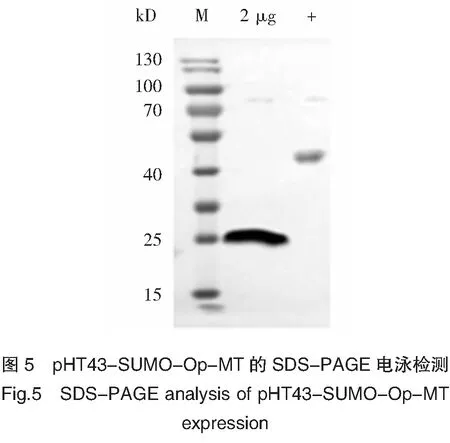
注:M:蛋白 Marker;+.阳性对照。
Notes:M:Protein Marker;+:Positive control.
2.5 褶牡蛎金属硫蛋白的活性检测
将含有SUMO-Op-MT质粒的重组枯草芽孢杆菌工程菌和不含SUMO-Op-MT质粒的空载体枯草芽孢杆菌空载体分别涂布于含有CdCl2的培养基上,37℃培养12~16 h后发现(图7),在浓度为50 μmol/L的CdCl2平板上,空载体的菌落少于含有MT的重组工程菌;当CdCl2浓度达到100 μmol/L时,MT重组工程菌生长较差,而空载体平板上未能检测到菌落;说明含有SUMO-Op-MT的重组枯草芽孢杆菌工程菌对重金属镉耐受能力增强。但是当CdCl2浓度达到200 μmol/L及以上时,两种菌落都未能被检测到,说明在高浓度CdCl2胁迫下金属硫蛋白活性受到了抑制。

3 讨论
目前,国内对MT的基因工程方面研究大多集中在大肠杆菌表达系统和微生物MT解毒,对MT工业化应用关注较少,具有工业化生产价值的基因工程菌株报道更是极少。近年来,国内外学者针对MT大肠杆菌表达系统研究做了大量工作,取得了较大进展,但E.coli直接表达MT,其表达量极低,通常需使用同位素标记才能检测到[24-26],或因形成大量无生物活性的包涵体,而复性效果不明显[27-30]。本课题组前期研究也证实尽管大肠杆菌(E.coli)直接表达MT也能高效表达,但是表达的蛋白仍以包涵体的形式存在。
枯草芽孢杆菌作为宿主菌,具有表达和分泌活性蛋白、直接将表达产物分泌到培养基中、不分泌内毒素、其发酵产物可直接用于食品生产中等优点,具有良好的工业应用前景。随着研究的不断深入及对芽孢杆菌的多种特性的揭示,芽孢杆菌的研究已在多种领域开展[31],并利用枯草芽孢杆菌实现了某些外源基因的表达[32-35],且所表达的蛋白保留原有的生物学活性[36],但尚未见利用枯草芽孢杆菌实现海洋源MT的报道。本研究运用八种蛋白酶缺陷的枯草芽孢杆菌WB800N作为宿主,实现SUMO(Small ubiquitin-related modifier)与海洋源MT在枯草芽孢杆菌WB800N中融合表达,得到可溶性目的蛋白,成功实现了海洋源金属硫蛋白在枯草芽孢杆菌中的分泌表达,并获得具有活性的海洋源金属硫蛋白,为解决制约MT产业发展原料来源瓶颈、开发天然高效海洋源重金属生物解毒剂提供理论依据,也为实现海洋源MT的工业化生产奠定了基础。
参考文献:
[1]Amiard J C,Amiard-Triquet C,Barka S,et al.Metallothioneins in aquatic invertebrates:their role in metal detoxification and their use as biomarkers[J].Aquatic Toxicology,2006,76(2):160-202.
[2]Babula P,Masarik M,Adam V,et al.Mammalian metallothioneins:properties and functions[J].Metallomics,2012,4(8):739-750.
[3]Vasák M.Advances in metallothionein structure and functions[J].Journal of Trace Elements in Medicine & Biology Organ of the Society for Minerals & Trace Elements,2005,19(1):13-17.
[4]付亮剑.兔肝脏中的宝——金属硫蛋白.中国畜牧业 [J].2007,(6):85-85.
[5]党蕊叶,齐凡,赵淑琳,等.兔肝金属硫蛋白提取工艺研究[J].西北农业学报,2012,21(6):22-25.
[6]彭新君,徐丽霞,刘平安,等.家兔肝脏中锌-金属硫蛋白提取工艺的优化[J].药物生物技术,2004,11(2):99-103.
[7]徐丽霞.兔肝锌金属硫蛋白(MT)的诱导方法和制备工艺研究[D].长沙:湖南中医学院,2002.
[8]Hong S H,Toyama M,Maret W,et al.High yield expression and single step purification of human thionein/metallothionein[J].Protein Expression & Purification,2001,21(1):243-250.
[9]Yang F,Zhou M,He Z,et al.High-yield expression inEscherichiacoliof soluble human MT2A with native functions[J].Protein Expression & Purification,2007,53(1):186-194.
[10]Chang S.Engineering for protein secretion in gram-positive bacteria[J].Methods in Enzymology,1987,153:507-516.
[11]Doi R H,Wong S L,Kawamura F.Potential use ofbacillussubtilisfor secretion and production of foreign proteins[J].Trends in Biotechnology,1986,4(9):232-235.
[12]Kunst F,Ogasawara N,Moszer I,et al.The complete genome sequence of the Gram-positive bacterium Bacillus subtilis[J].Nature,1997,390(6657):249-256.
[13]Ogasawara N.Systematic function analysis ofBacillussubtilisgenes[J].Research in Microbiology,2000,151(2):129-134.
[14]Tjalsma H,Bolhuis A,Jongbloed J D H,et al.Signal peptide-dependent protein transport inBacillussubtilis:a genome-based survey of the secretome[J].Microbiology & Molecular Biology Reviews,2000,64(3):515-547.
[15]Tjalsma H,Noback M A,Bron S,et al.Bacillussubtiliscontains four closely related type I signal peptidases with overlapping substrate specificities.Constitutive and temporally controlled expression of different sip genes[J].Journal of Biological Chemistry,1997,272(41):25983-25992.
[16]Van Dijl J M,Braun P G,Robinson C,et al.Functional genomic analysis of theBacillussubtilisTat pathway for protein secretion[J].Journal of biotechnology,2002,98(2-3):243-254.
[17]苏文,吴惠丰,廖春阳,等.锌铅暴露条件下菲律宾蛤仔消化腺和鳃内金属和金属硫蛋白的变化[J].中国科学院大学学报,2010,27(4):456-462.
[18]刘维青.海湾扇贝金属硫蛋白 cDNA 序列克隆及其在镉和鳗弧菌诱导下的表达研究[D].青岛:中国海洋大学,2005.
[19]李春娣,颜文,龙爱民,等.Cu暴露条件下翡翠贻贝(Pernaviridis)消化腺内金属和类金属硫蛋白的变化[J].环境科学,2007,28(8):1788-1795.
[20]Roesijadi G.Metallothionein induction as a measure of response to metal exposure in aquatic animals [J].Environmental Health Perspectives,1994,102(Suppl 12):91-95.
[21]Bebianno M J,Serafim M A.Comparison of metallothionein induction in response to cadmium in the gills of the bivalve molluscsMytilusgalloprovincialisandRuditapesdecussatus[J].Science of the Total Environment,1998,214(2):83-88.
[22]Damiens G,Mouneyrac C,Quiniou F,et al.Metal bioaccumulation and metallothionein concentrations in larvae ofCrassostreagigas[J].Environmental Pollution,2006,140(3):492-499
[23]Ndayibagira A,Sunahara G I,Robidoux P Y.Rapid isocratic HPLC quantification of metallothionein-like proteins as biomarkers for cadmium exposure in the earthwormEiseniaandrei[J].Soil Biology & Biochemistry,2007,39(1):194-201.
[24 ]Vasák M.Advances in metallothionein structure and functions [J].Journal of Trace Elements in Medicine & Biology Organ of the Society for Minerals & Trace Elements,2005,19(1):13-17.
[25]Theocharis S E,Margeli A P,Koutselinis A.Metallothionein:a multifunctional protein from toxicity to cancer [J].International Journal of Biological Markers,2003,18(3):162-169.
[26]Butt T R,Jonnalagadda S,Monia B P,et al.Ubiquitin Fusion Augments the Yield of Cloned Gene Products inEscherichiacoli[J].Proceedings of the National Academy of Sciences of the United States of America,1989,86(8):2540-2544.
[27]邓小亮.蟹多拷贝串联重组金属硫蛋白基因的原核表达载体构建及表达[D].广州:广州医学院,2010.
[28]He Y,Ma W,Li Y,et al.Expression of metallothionein of freshwater crab(Sinopotamonhenanense)inEscherichiacolienhances tolerance and accumulation of zinc,copper and cadmium[J].Ecotoxicology,2014,23(1):56-64.
[29]曹晓敏,李冰,陈祯,等.中华绒螯蟹重组金属硫蛋白的原核表达与分离纯化[J].生物医学工程学杂志,2007,24(2):409-412.
[30]Zhang F Q,Wang Y S,Sun C C,et al.A novel metallothionein gene from a mangrove plantKandeliacandel[J].Ecotoxicology,2012,21(6):1633-1641.
[31]Zhang X Z,Cui Z L,Hong Q,et al.High-level expression and secretion of methyl parathion hydrolase inBacillussubtilisWB800 [J].Applied & Environmental Microbiology,2005,71(7):4101-4103.
[32]Lam K H,Chow K C,Wong W K.Construction of an efficientBacillussubtilissystem for extracellular production of heterologous proteins [J].Journal of Biotechnology,1998,63(3):167-77.
[33]Wang G L,Yi Q,Fang H J.Transforming and secreting expression of human egf in mutant strain WYBS2001 ofBacillusand its functions [J].Acta Genetica Sinica,2003,30(2):97-102.
[34]Ye R,Kim J,Kim B,et al.High‐level secretory production of intact,biologically active staphylokinase fromBacillussubtilis[J].Biotechnology & Bioengineering,1999,62(1):87-96.
[35]Olmos-Soto J,Contreras-Flores R.Genetic system constructed to overproduce and secrete proinsulin inBacillussubtilis[J].Applied Microbiology & Biotechnology,2003,62(4):369.
[36]Emf M,Duc L H,Isticato R G,et al.Display of heterologous antigens on theBacillussubtilisspore coat using Cot C as a fusion partner [J].Vaccine,2004,22(10):1177-1187.
