塞来昔布配合放射治疗对脑部恶性胶质瘤的效果及免疫功能影响
2018-04-26寇永强乔劲鹏
寇永强,乔劲鹏
脑部恶性胶质瘤是神经外科的常见疾病,患者的病死率高、预后差,主要治疗方法为手术切除,并配合放、化疗以防止肿瘤转移及复发,以提高患者的生存率和生活质量[1-2]。由于恶性胶质瘤的生长具有浸润性,部分患者单纯手术往往无法根除,因此需配合放、化疗进行治疗,而在此过程中如何提高肿瘤对放、化疗的敏感性已成为当前研究的热点[3]。环氧化酶-2(Cyclooxygenase-2,COX-2)在胃癌、鼻咽癌、结直肠癌、乳腺癌等多种恶性肿瘤中高表达,体内外研究表明,COX-2抑制剂不仅能广泛抑制肿瘤的增殖甚至逆转其癌前病变,还能提高肿瘤放、化疗的敏感性[4]。塞来昔布是COX-2的选择性抑制剂,具有低毒、高效、耐受性良好的优点,其对于恶性肿瘤的放、化疗增敏性已被实验证实,但应用于临床治疗的研究尚处于起步阶段[5-6]。本研究观察了塞来昔布配合放射治疗应用于恶性胶质瘤的效果,现报道如下。
1 对象与方法
1.1 研究对象 选择2014年6月—2017年6月于我院治疗的恶性胶质瘤患者80例,按照随机数字表法均分为对照组和观察组,每组40例。对照组男22例,女18例,平均年龄(52.38±5.24)岁;星形细胞瘤22例,少枝胶质细胞瘤12例,混合胶质瘤6例;肿瘤位于颞叶11例,额叶10例,顶叶8例,枕叶4例,小脑6例,脑室1例。观察组男21例,女19例,平均年龄(52.29±5.28)岁;星形细胞瘤20例,少枝胶质细胞瘤13例,混合胶质瘤7例;肿瘤位于颞叶12例,额叶9例,顶叶7例,枕叶5例,小脑5例,脑室2例。2组性别(χ2=0.050)、年龄(t=0.077)、细胞类型(Z=0.212)、肿瘤位置(Z=0.698)差异无统计学意义(P>0.05)。
纳入标准:①经病理诊断为胶质瘤;②手术后需进行放疗;③无放疗禁忌证;④既往未接受过放疗和化疗;⑤卡氏评分(Karnofsky performance status,KPS)>60 分,预计生存时间>6个月;⑥知晓实验方案并签署知情同意书;⑦治疗方案经医院伦理委员会批准。排除标准:①合并严重心、肾、肝等疾病者;②既往对放疗反应不能耐受者;③对塞来昔布有禁忌证者;④妊娠或哺乳期女性;⑤转移性脑瘤者。
1.2 方法 (1)对照组。患者于术后2~6周接受三维适形放射治疗,患者取仰卧位,头部采用热塑面膜固定,行整个颅脑CT增强扫描,扫描后将图像传输至放射治疗计划系统,予以图像三维重建,并结合MRI检查结果,由放射诊断医师和放射治疗医师共同勾画肿瘤靶区、临床靶区和计划靶区。采用6MV-X线,对3~6个共面和(或)非共面野行适形照射,95%的等剂量曲线覆盖计划靶区。放射剂量为56~60 Gy,每次4~6 Gy,每周5次。(2)观察组。患者在对照组的基础上联合塞来昔布治疗,塞来昔布(0.2 g/粒;国药准字J20120063;辉瑞制药有限公司)口服,0.2 g/次,放疗第1天开始用药,每日2次。
1.3 观察指标 ①近期疗效。参照1979年WHO对于实体瘤的评价标准,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),有效=CR+PR。②免疫功能指标。抽取静脉血5 mL,离心后取血清,采用流式细胞仪检测患者的T细胞总数(CD3+)、辅助性T细胞(CD4+)、抑制性T细胞(CD8+)及 CD4+/CD8+。③基质金属蛋白酶-9(MMP-9)、转化生长因子-β(TGF-β)和血管内皮生长因子(VEGF)水平。抽取空腹外周静脉血5 mL,离心后取血清,使用酶联免疫吸附法测定血清VEGF、MMP-9水平和TGF-β水平。④生活质量。采用KPS评分评价患者的生活质量,显著改善:评分增加>20分;改善:增加10~20分;稳定:评分增加或减少<10分;下降:评分减小>10分。有效=显著改善+改善。
1.4 统计学方法 采用SPSS 21.0进行统计学分析。符合正态分布的计量资料用均数±标准差(±s)表示,2 组内比较用配对t检验,2组间比较用独立样本t检验;计数资料以例或例(%)表示,组间比较用χ2检验;等级资料采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者的近期疗效比较 在同步治疗6周后,观察组整体疗效和总有效率均优于对照组(P<0.05),见表 1。
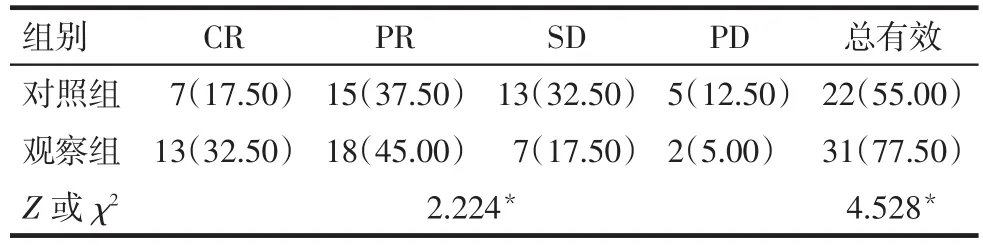
Tab.1 Comparison of the short-term clinical effect between two groups表1 2组患者的近期疗效比较 [n=40,例(%)]
2.2 2组患者的免疫功能比较 与治疗前比较,2组治疗后 CD3+、CD4+比例及 CD4+/CD8+升高,CD8+比例降低(P<0.05);治疗后,观察组免疫功能指标CD3+、CD4+比例和 CD4+/CD8+高于对照组,而 CD8+比例低于对照组(P<0.05),见表2。
2.3 2组患者的MMP-9、VEGF和TGF-β水平比较 治疗前,2组MMP-9、VEGF和TGF-β水平差异均无统计学意义。治疗后,2组患者的MMP-9、VEGF和TGF-β水平均较治疗前下降(P<0.05);治疗后观察组MMP-9、VEGF和TGF-β水平均低于对照组(P<0.05),见表3。
2.4 2组患者的生活质量比较 观察组生活质量优于对照组,改善总有效率高于对照组(P<0.05),见表4。
3 讨论
多数胶质瘤患者术后需进行放射治疗,但是患者往往有放射抗拒,且肿瘤本身对放射线的敏感性及个体其他心理因素均会影响放疗效果。COX-2抑制剂大多无直接的肿瘤杀伤作用,但其对多种恶性肿瘤的放、化疗均具有辅助增敏作用。研究显示,COX-2在多种恶性肿瘤组织中均高表达,而这也是其产生放、化疗耐受的原因之一,因此抑制COX-2的表达可以在一定程度上提高放疗的效果[7]。塞来昔布是COX-2选择性抑制剂的典型代表,体外研究证实,塞来昔布具有抑制多种肿瘤细胞生长,诱导肿瘤细胞周期阻滞等作用,对颅内肿瘤同样具有抑制效果[8]。事实上,脑胶质瘤细胞本身便具有COX-2高表达的特征。王飞等[9]采用免疫组织化学法研究不同恶性程度脑胶质瘤后证实,肿瘤组织中COX-2水平与脑胶质瘤恶性程度成正相关,与放射敏感性呈负相关。聂亮琴等[10]以不同浓度塞来昔布处理脑胶质瘤细胞和正常少突胶质细胞24 h后发现,塞来昔布对正常细胞及肿瘤细胞均具有增殖抑制作用,但塞来昔布对脑胶质瘤细胞的放射增敏作用明显高于其对正常细胞的效果。本文研究结果显示,观察组近期疗效和生活质量均优于对照组,表明恶性胶质瘤患者在放疗的同时加用塞来昔布可以提高临床疗效。李雪芹等[11]研究结果显示,塞来昔布可以有效治疗中重度癌痛,减少吗啡用量,从而改善癌症患者的生活质量,与本文研究结果相符。
Tab.2 Comparison of immunologic function between two groups表2 2组患者的免疫功能比较 (n=40,±s)

Tab.2 Comparison of immunologic function between two groups表2 2组患者的免疫功能比较 (n=40,±s)
**P<0.01
组别对照组观察组t CD4+(%)CD3+(%)治疗前53.18±3.25 53.14±3.27 0.055治疗后59.31±4.8 66.73±5.3 6.478**t t t t 6.650**13.634**治疗前33.26±2.85 33.21±2.87 0.078治疗后40.62±3.51 47.53±4.39 7.775**10.295**17.268**CD8+(%)治疗前35.27±3.62 35.23±3.65 0.049治疗后32.75±3.04 28.64±2.51 6.594**3.372**9.409**CD4+/CD8+治疗前1.02±0.13 1.03±0.11 0.371治疗后1.31±0.17 1.54±0.21 5.384**8.570**13.606**
Tab.3 Comparison of serum levels of MMP-9,TGF-β and VEGF between two groups表32组患者的MMP-9、TGF-β和VEGF水平比较 (n=40,(±s)
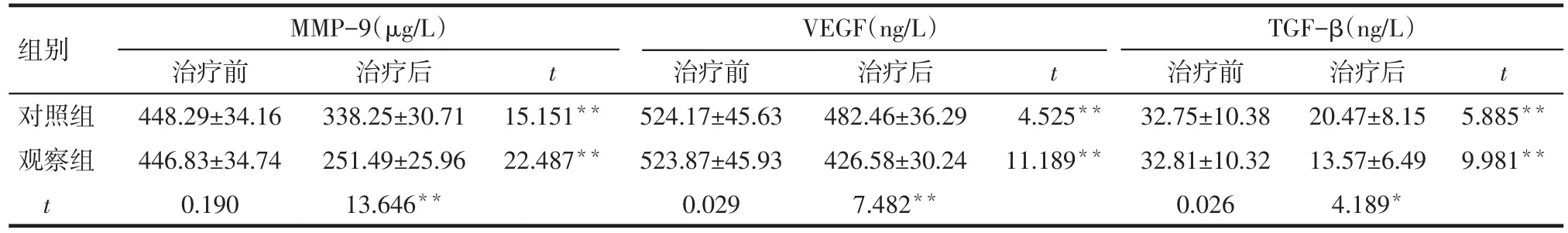
Tab.3 Comparison of serum levels of MMP-9,TGF-β and VEGF between two groups表32组患者的MMP-9、TGF-β和VEGF水平比较 (n=40,(±s)
**P<0.01
组别对照组观察组t VEGF(ng/L)MMP-9(µg/L)治疗前448.29±34.16 446.83±34.74 0.190治疗后338.25±30.71 251.49±25.96 13.646**t t t 15.151**22.487**治疗前524.17±45.63 523.87±45.93 0.029治疗后482.46±36.29 426.58±30.24 7.482**4.525**11.189**TGF-β(ng/L)治疗前32.75±10.38 32.81±10.32 0.026治疗后20.47±8.15 13.57±6.49 4.189*5.885**9.981**
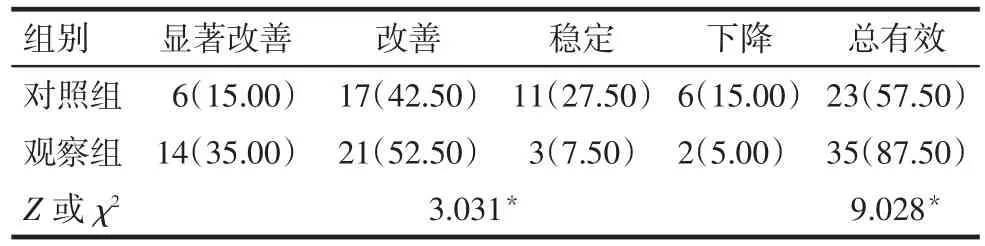
Tab.4 Comparison of quality of life between two groups of patients表4 2组患者的生活质量比较 [n=40,例(%)]
免疫功能与恶性肿瘤患者的预后息息相关,T淋巴细胞亚群是人体抗肿瘤免疫反应的重要组成部分,CD4+细胞是辅助性T细胞,可以正向调节细胞免疫,CD8+细胞为抑制性T细胞,可以负向调节细胞免疫,CD4+/CD8+可反映机体细胞的免疫功能状态。寇卫政等[12]研究显示,晚期胃癌患者采用替吉奥联合塞来昔布治疗可以明显提高其免疫功能,CD3+、CD4+细胞数量和CD4+/CD8+比例与对照组比较均明显升高。本研究结果显示,治疗前2组患者的免疫功能指标水平相近,治疗后2组患者的CD3+、CD4+和 CD4+/CD8+水平较治疗前上升,CD8+水平下降,且观察组变化更明显,表明塞来昔布对提高胶质瘤患者的免疫功能同样有效。
VEGF在肿瘤细胞血行转移和淋巴转移机制中起重要作用,主要通过提高血管通透性,刺激肿瘤组织中微血管的生长,从而促进肿瘤的进展及转移,血清VEGF水平与肿瘤浸润关系密切[13]。TGF-β信号通路的激活关系到肿瘤的发生、发展和转移过程。研究发现,肿瘤首先通过局部浸润,将肿瘤细胞渗入血管,在血管和淋巴管内循环并黏附于远处位点并外渗,最终在远处形成新的肿瘤,这一过程均受到TGF-β信号通路相关蛋白的调控[14]。MMP-9在血管形成及肿瘤侵袭中均起着促进性作用。本研究结果显示,治疗后 2组患者的 MMP-9、TGF-β和VEGF水平均较治疗前下降,观察组更明显,表明塞来昔布联合放疗可抑制胶质瘤的进展。Li等[15]研究结果显示,塞来昔布可以抑制MMP-9的分泌,抑制鼻咽癌细胞新生血管形成和细胞浸润,与本文研究结果相符。
综上所述,塞来昔布可以提高胶质瘤患者的放疗敏感性,联合放射治疗可以提高患者的临床疗效和生活质量,改善免疫功能,降低患者的MMP-9和VEGF水平,值得在临床推广应用。
[1]李春田,刘思杰,殷增进,等.伽马刀治疗脑胶质瘤术后残留60例临床疗效观察[J].临床军医杂志,2013,41(10):1095.Li CT,Liu SJ,Yin ZJ,et al.The clinical observation of 60 cases of clinical medical complex[J].Clinical Journal of Medical Officer,2013,41(10):1095.doi:10.3969/j.issn.1671-3826.2013.10.053.
[2]王文彬.化疗联合三维适形放射治疗脑瘤临床分析[J].中国实用神经疾病杂志,2016,19(5):68-70.Wang WB.Clinical analysis ofchemotherapy combined with three dimensional conformal radiotherapy for brain tumors[J].Chinese Journal of Practical Nervous Diseases,2016,19(5):68-70.doi:10.3969/j.issn.1673-5110.2016.05.041.
[3]刘志强,李玉辉,石文建,等.高压氧联合放化疗同期治疗对胶质瘤术后患者康复疗效的评估[J].河北医药,2013,35(18):2808-2809.Liu ZQ,Li YH,Shi WJ,et al.Evaluation of the rehabilitation effect of hyperbaric oxygen combined with radiotherapy and chemotherapy in the treatment of postoperative glioma patients[J].Hebei Medicine,2013,35(18):2808-2809.doi:10.3969/j.issn.1002-7386.2013.18.048.
[4]Shi D,Xiao X,Tian Y,et al.Activating enhancer-binding protein-2α induces cyclooxygenase-2 expression and promotes nasopharyngeal carcinoma growth[J].Oncotarget,2015,6(7):5005-5021.doi:10.18632/oncotarget.3215.
[5]Penas PM,Hess KR,Fich MJ,et al.Randomized phaseⅡ adjuvant factorialstudy ofdose-dense temozolomide alone and in combination with isotretinoin,celecoxib,and/or thalidomide for glioblastoma[J].Neuro Oncol,2015,17(2):266-273.doi:10.1093/neuonc/nou155.
[6]Kesari S,Schiff D,Henson JW,et al.Phase Ⅱ study of temozolomide,thalidomide,and celecoxib for newly diagnosed glioblastoma in adults[J].Neuro Oncol,2008,10(3):300-308.doi:10.1215/15228517-2008-005.
[7]李文雯,孙伟,罗敏,等.塞来昔布对鼻咽癌放射抗拒细胞株CNE-2R放射敏感性的影响[J].医药导报,2015,34(11):1439-1444.Li WW,Sun W,Luo M,et al.Effect of celecoxib on radiosensitivity of nasopharyngeal carcinoma cell line CNE-2R[J].Herald of Medicine,2015,34(11):1439-1444.doi:10.3870/j.issn.1004-0781.2015.11.006.
[8]李超,成浩,肖华光,等.塞来昔布对人鼻咽癌CNE-2细胞放疗的增敏作用[J].现代肿瘤医学,2016,24(21):3359-3363.Li C,Cheng H,Xiao HG,et al.Radiosensitization of celecoxib on human nasopharyngeal carcinoma CNE-2 cells[J].J Mod Oncol,2016,24(21):3359-3363.doi:10.3969/j.issn.1672-4992.2016.21.005.
[9]王飞,薛彦,宋浩,等.环氧合酶-2在原发及复发星形细胞瘤中的表达及意义[J].中国医师进修杂志,2014,37(8):14-16.Wang F,Xue Y,Song H,et al.Expression and significance of cyclooxygenase-2 in primary and recurrent astrocytomas[J].Chin J Postgrad Med,2014,37(8):14-16.doi:10.3760/cma.j.issn.1673-4904.2014.08.005.
[10]聂亮琴,周菊英,王利利,等.塞来昔布对正常脑胶质细胞和脑胶质瘤细胞放射增敏效应的比较及其机制[J].中华放射医学与防护杂志,2014,34(5):342-344,375.Nie LQ,Zhou JY,Wang LL,et al.The radiosensitization effect of celecoxib on normal brain glial cells and glioma cells[J].Chin J Radiol Med Prot,2014,34(5):342-344,375.doi:10.3760/cma.j.issn.0254-5098.2014.05.006.
[11]李雪芹,陈曦,龚泉,等.盐酸吗啡缓释片联合塞来昔布治疗晚期肺癌伴中重度癌痛的临床分析[J].国际肿瘤学杂志,2017,44(3):165-168.Li XQ,Chen X,Gong Q,et al.Clinical analysis of Morphine Hydrochloride Sustained-release Tablets combined with celecoxib in the treatment of advanced lung cancer with moderate or severe cancer pain[J].J Int Oncol,2017,44(3):165-168.doi:10.3760/cma.j.issn.1673-422X.2017.03.002.
[12]寇卫政,杨留中,褚秀峰,等.替吉奥联合塞来昔布治疗晚期胃癌疗效观察[J].新乡医学院学报,2015,32(4):336-339.Kou WZ,Yang LZ,Zhu XF,et al.S-1 combined with celecoxib in the treatment of advanced gastric cancer clinical observation[J].J Xinxiang Med Coll,2015,32(4):336-339.doi:10.7683/xxyxyxb.2015.04.013.
[13]谢欣怡,鲍红光,张勇.塞来昔布抑制非小细胞肺癌作用机制的研究进展[J].临床麻醉学杂志,2014,30(5):516-519.Xie XY,Bao HG,Zhang Y.Research progress in inhibition of celecoxib in non-small cell lung cancer mechanism of[J].Journal of Clinical Anesthesiology,2014,30(5):516-519.
[14]袁方,李伟,刘丙丽,等.恶性脑胶质瘤同步放化疗后血清TGF-β和GFAP浓度变化及其临床意义[J].实用癌症杂志,2017,32(5):722-724,734.Yuan F,Li W,Liu BL,et al.Changes and clinical significance of serum TGF-beta and GFAP concentrations in patients with malignant glioma after concurrent chemoradiotherapy[J].The Practical Journal of Cancer,2017,32(5):722-724,734.doi:10.3969/j.issn.1001-5930.2017.05.008.
[15]Li WW,Long GX,Liu DB,et al.Cyclooxygenase-2 inhibitors celecoxib suppresses invasion and migration of nasopharyngeal carcinoma cell lines through a decrease in matrix metallproteinase-2 and-9 activity[J].Pharmazie,2014,69(2):132-137.
