替米沙坦对高脂饲养OLETF 大鼠心肌重构及PPARγ表达的影响
2018-04-26赵紫琴郑喜兰雒瑢田凤石方涛
赵紫琴,郑喜兰,雒瑢,田凤石,方涛
近年来,随着糖尿病(diabetes mellitus,DM)的发病率逐年增高,继发于DM的心血管并发症已成为DM患者死亡的主要原因,其中,糖尿病心肌病(diabetic cardiomyopathy,DCM)是 DM 患者的主要心血管并发症之一[1]。DCM患者心肌功能障碍的机制复杂,包括心肌纤维化、代谢紊乱和胰岛素抵抗等。过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor gamma,PPARγ)是核激素受体超家族中的一员,为配体依赖性转录因子,通过调控脂肪细胞分化、脂肪细胞因子表达和糖脂代谢等过程提高机体的胰岛素敏感性。吡格列酮作为PPARγ激动剂,具有改善胰岛素抵抗,降低血糖,纠正脂代谢紊乱,减轻DM引起的心肌肥厚和心肌纤维化,改善心肌重构等优点,但也存在体质量升高,致水肿、心力衰竭等不良反应[2-3]。替米沙坦作为AngⅡ受体拮抗剂(AngiotensinⅡ receptor blockers,ARBs),被广泛用于治疗高血压、慢性心力衰竭及糖尿病肾病[4],其作为PPARγ部分激动剂,在糖尿病心肌间质重构方面发挥作用的机制研究还较少,潜在分子机制尚不清楚。本研究利用小剂量替米沙坦对长期高脂饲养的自发2型糖尿病(T2DM)OLETF(Otsuka Long-Evans Tokushima Fatty)大鼠进行早期干预,探讨其对心肌组织中PPARγ蛋白及mRNA表达的影响及其在心肌重构中的调控作用。
1 材料与方法
1.1 动物模型的建立及分组 4周龄清洁级雄性OLETF大鼠28只,性别、周龄相匹配的正常非糖尿病LETO(Long-Evans Tokushima Otsuka)大鼠12只作为对照,体质量150~180 g,均由日本大冢制药公司研究所提供。从8周龄开始,OLETF大鼠饲喂以高脂饲料,LETO大鼠喂以标准饲料并作为空白对照(LETO组)。所有大鼠自20周龄始每2周称体质量并测定血糖。22周时,将OLETF大鼠随机分为3组,并开始给予药物干预,替米沙坦干预组[5][O-T组,5 mg/(kg·d),n=10]、吡格列酮干预组[6][O-P组,10 mg/(kg·d),n=8]和无干预对照组(O-C组,等体积生理盐水,n=10),给药方法为每日1次定时灌胃。
1.2 口服葡萄糖耐量试验(OGTT) 分别于22周龄和48周龄行OGTT检测。实验前隔夜禁食16 h、不禁水,按2 g/kg予20%葡萄糖溶液灌胃,于灌胃前尾静脉取血样1 mL待检,于糖负荷后120 min剪尾取血,测定血糖。根据OLETF大鼠培育团队制订的标准[7],确定OGTT测得血糖峰值>16.8 mmol/L且糖负荷后120 min血糖>11.2 mmol/L时,诊断为T2DM,具备其中任一条件者则诊断为糖耐量异常(impaired glucose tolerance,IGT)。
1.3 高胰岛素-正糖钳夹实验 48周龄时,每组根据随机数字表抽取5只大鼠行高胰岛素-正糖钳夹实验。大鼠过夜禁食、麻醉下插管、静置并测定基础血糖值(basic blood glucose,BBG),左侧股静脉以1.67 mU/(kg·min)连续输注胰岛素,右侧股静脉输注葡萄糖且每5 min调整一次葡萄糖输注速度(glucose infusion rate,GIR)使血糖维持于(BBG±0.5)mmol/L范围内。计算60~120 min的GIR平均值得到GIR60-120。
1.4 血清炎性因子的测定 48周龄时无创尾套加压法测定各组血压,之后股动脉放血处死动物,解剖取出心脏,称质量后迅速放入液氮中冷冻,后移至-80℃冰箱保存备用。取股动脉血5 mL,分离血清,酶联免疫吸附法(ELISA)测定血清PPARγ、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6水平(相关检测试剂盒购自Santa Cruz公司);放射免疫法测定血清脂联素水平(试剂盒购自美国Linco研究所)。
1.5 Real-time PCR 检测心肌组织 PPARγ1、PPARγ2、IL-6 mRNA表达 提取大鼠心肌组织中总RNA,Real-time PCR(一步法)测定PPARγ1、PPARγ2及IL-6的mRNA表达水平,以GAPDH为内参,引物由北京奥科生物技术公司设计并合成(表1)。根据QuantiFast SYBR Green RT-PCR Master(one step)试剂盒说明书进行Real-time PCR,反应参数:50℃逆转录 10 min;95℃预变性 5 min;95℃变性 10 s,59~62℃退火30 s,72℃延长30 s,40个循环。数据处理应用相对定量法,基因表达量以2-ΔΔCt的值进行统计,将O-C组标化为“1”,作为对照。
1.6 Western blot测定大鼠心肌组织中PPARγ的蛋白表达水平 提取大鼠心肌组织蛋白,BCA法定量、十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离、转膜,4℃过夜孵育 PPARγ、脂联素、IL-6、核因子-κB(NF-κB)及 β-actin抗体(稀释度均为1∶2 000),次日洗膜后以辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶8 000)37℃孵育1 h,ECL化学发光法显色。扫描胶片,经影像分析系统处理得到相应的灰度值,PPARγ、脂联素、IL-6及NF-κB蛋白表达水平以βactin进行校正,再以O-C组大鼠的结果作为对照。
1.7 心肌组织的光镜观察 取适量左心室心肌组织(0.5 cm×0.5 cm×0.5 cm),浸泡于4%中性甲醛中固定,制成石蜡切片。经二甲苯脱蜡、梯度乙醇水化后,分别制成苏木精-伊红(H&E)染色切片、Masson染色切片以及PAS染色切片,于光学显微镜下观察心肌组织形态学改变。Masson染色心肌纤维呈红色,胶原纤维呈绿色;PAS染色细胞核染呈蓝色,糖原及其他反应物呈紫红色。
1.8 心肌超微结构的电镜观察 将左心室心肌组织切成体积<1 mm3的组织块,立即在2.5%戊二醛固定液(0.1 mol/L磷酸盐缓冲液配制)固定2 h,经清洗液冲清后,于1%锇酸固定液(0.1 mol/L磷酸盐缓冲液配制)固定2 h,梯度乙醇脱水,用618环氧树脂制成包埋块后,使用LKB-I型超薄切片机切片,超薄切片经过枸橼酸铅、醋酸铀双重染色后,在JEM-1200EX透射电子显微镜下观察、摄片。
1.9 统计学方法 所有数据处理采用SPSS 13.0统计软件包。符合正态分布的计量资料以均数±标准差(±s)表示,各组间比较采用单因素方差分析,方差齐者两两比较使用LSD-t法,方差不齐者使用Dunnett’s T3法,双侧检验水准α=0.05。

Tab.1 Real-time PCR primer sequences表1 Real-time PCR中的引物序列
2 结果
2.1 T2DM及IGT发病情况 22周龄时,各组大鼠均未发生T2DM及IGT。48周龄时O-C组7只发展为 T2DM,2只 IGT;O-T组 1只 DM,3只 IGT;其他2组未见DM和IGT。高胰岛素-正糖钳夹实验结果显示,4组间GIR60-120水平比较差异有统计学意义(n=5,F=8.136,P<0.01)。LETO 组、O-P 组、O-T组GIR60-120[分别为(22.23±3.78)mg/(kg·min)、(19.58±3.62)mg/(kg·min)和(17.61±5.10)mg/(kg·min)]均高于O-C组[(9.74±3.29)mg/(kg·min)]。
2.2 HW/BW及血压变化 22周龄时,OLETF大鼠体质量均明显高于LETO组,而OLETF大鼠间体质量差异无统计学意义(P>0.05)。48周龄时,O-P组大鼠体质量(BW)和心脏质量(HW)明显高于其他3组,此时O-P组、O-T组HW/BW均明显低于O-C组(P<0.05),O-P组与O-T组 HW/BW 差异无统计学意义(P>0.05)。48周龄时,O-T组大鼠SBP、DBP较其他3组明显下降(P<0.05)。见表2。
2.3 血清炎性因子的变化 与LETO组相比,O-C组血清TNF-α及MCP-1均显著升高(P<0.05),而脂联素和PPARγ水平则显著降低(P<0.05);与OC 组相比,O-T组血清IL-6、TNF-α、MCP-1水平下降,脂联素和PPARγ水平则明显升高(P<0.05);OP及O-T组间上述指标差异均无统计学意义。见表3。
2.4 心肌组织PPARγ、IL-6 mRNA表达变化 与O-C组相比,O-P组大鼠心肌组织中PPARγ1和PPARγ2 mRNA 表达明显升高(P<0.05),但 IL-6 mRNA表达水平差异无统计学意义(P>0.05)。与O-C组相比,O-T组心肌组织中PPARγ1 mRNA的表达增高,IL-6表达下降(P<0.05),而 PPARγ2的mRNA表达水平差异无统计学意义(P>0.05)。OP及O-T组间PPARγ、IL-6 mRNA表达水平差异均无统计学意义。见表4。
2.5 心肌组织PPARγ蛋白表达变化 与LETO组相比,O-C组PPARγ、脂联素表达下降,而NF-κB及IL-6表达升高(均P<0.05)。与O-C组相比,O-P组及O-T组PPARγ、脂联素的蛋白表达均明显升高,而NF-κB及IL-6蛋白表达下降(均P<0.05)。O-T组与O-P组相比,PPARγ表达下降,脂联素表达升高,NF-κB及IL-6表达水平差异无统计学意义。见图1、表5。
2.6 光镜和电镜下心肌病理改变 光镜下观察,LETO组大鼠心肌厚度正常,心肌细胞排列整齐、致密,细胞核大小均一,肌纤维整齐,无明显断裂,细胞间质较少;O-C组大鼠心肌明显肥厚,心肌细胞增大,细胞核大小不一,可见肌纤维增粗断裂、排列紊乱,部分心肌细胞肌浆溶解。Masson染色显示,LETO组心肌细胞排列规整红染,心肌间质无明显胶原纤维增生,而O-C组心肌细胞间隙增大,心肌间质中出现大量胶原纤维。PAS染色显示O-C组心肌间质中糖原沉积;O-P组心肌肥厚,心肌纤维排列整齐,心肌细胞轻度肿胀,但无明显糖原沉积;OT组心肌纤维排列规整,无明显心肌纤维肿胀且无明显糖原沉积,见图2。
电镜下观察,LETO组大鼠心肌细胞质膜完整,肌丝排列整齐,各条带清晰可见,线粒体无肿胀,呈线状排列,而O-C组大鼠心肌组织出现严重损害,肌原纤维断裂,核周间隙扩张,糖原和脂褐素沉积,心肌线粒体出现溶解。O-P组心肌纤维排列整齐,心肌细胞轻度肿胀,肌纤维间水肿,线粒体肿胀、嵴断裂,并可见较多的脂滴沉积。O-T组大鼠心肌超微结构改变较O-C组明显减轻,大部分心肌纤维排列整齐,线粒体膜基本完整,少部分线粒体水肿,嵴断裂,无肌原纤维坏死和溶解。见图2。
Tab.2 The changes of heart weight,the ratio of HW/BW and blood pressure in four groups表2 各组大鼠心脏重量、HW/BW以及血压的变化 (±s)
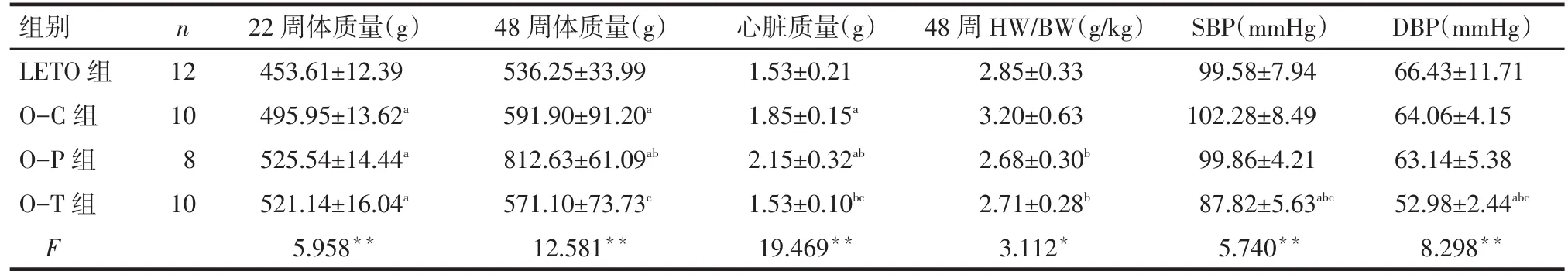
Tab.2 The changes of heart weight,the ratio of HW/BW and blood pressure in four groups表2 各组大鼠心脏重量、HW/BW以及血压的变化 (±s)
*P<0.05,**P<0.01;a与 LETO 组比较,b与 O-C 组比较,c与 O-P 组比较,P<0.05
组别LETO组O-C组O-P组O-T组F n 12 10 8 10 22周体质量(g)453.61±12.39 495.95±13.62a 525.54±14.44a 521.14±16.04a 5.958**48周体质量(g)536.25±33.99 591.90±91.20a 812.63±61.09ab 571.10±73.73c 12.581**心脏质量(g)1.53±0.21 1.85±0.15a 2.15±0.32ab 1.53±0.10bc 19.469**48周HW/BW(g/kg)2.85±0.33 3.20±0.63 2.68±0.30b 2.71±0.28b 3.112*SBP(mmHg)99.58±7.94 102.28±8.49 99.86±4.21 87.82±5.63abc 5.740**DBP(mmHg)66.43±11.71 64.06±4.15 63.14±5.38 52.98±2.44abc 8.298**
Tab.3 The changes of serum inflammatory cytokines in four groups表3 各组大鼠血清炎性因子的变化 (±s)
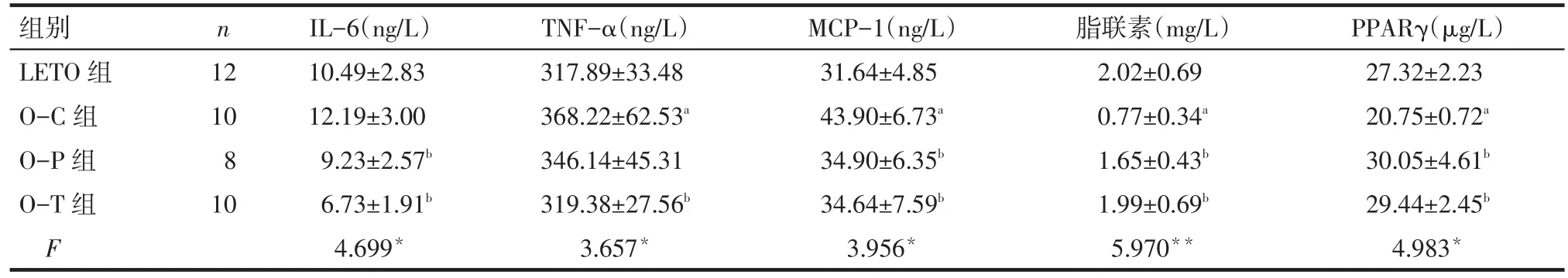
Tab.3 The changes of serum inflammatory cytokines in four groups表3 各组大鼠血清炎性因子的变化 (±s)
*P<0.05,**P<0.01;a与 LETO 组比较,b与 O-C 组比较,c与 O-P 组比较,P<0.05
组别LETO组O-C组O-P组O-T组F n 12 10 8 10 IL-6(ng/L)10.49±2.83 12.19±3.00 9.23±2.57b 6.73±1.91b 4.699*TNF-α(ng/L)317.89±33.48 368.22±62.53a 346.14±45.31 319.38±27.56b 3.657*MCP-1(ng/L)31.64±4.85 43.90±6.73a 34.90±6.35b 34.64±7.59b 3.956*脂联素(mg/L)2.02±0.69 0.77±0.34a 1.65±0.43b 1.99±0.69b 5.970**PPARγ(µg/L)27.32±2.23 20.75±0.72a 30.05±4.61b 29.44±2.45b 4.983*
3 讨论
OLETF大鼠是一种肥胖、胰岛素抵抗的自发T2DM的遗传型动物模型,其发病时间在不同研究中存在较大的变异。Kaneko等[8]发现,OLETF 大鼠长期高脂饮食更能加快T2DM的进程。本实验中,O-C组经过长期高脂饮食后,表现为高血糖症、高胰岛素血症以及轻度肥胖等特点,与文献报道一致[9]。本课题组前期研究发现,替米沙坦可明显降低脂肪组织中的炎性因子的表达,提高胰岛素敏感性,对OLETF大鼠胰岛素抵抗状态的改善更是得到了OGTT试验和高胰岛素-正糖钳夹实验的双重证实[10-11]。然而,目前针对小剂量替米沙坦干预后的OLETF大鼠心肌病理形态改变的研究较少,尤其是在糖尿病早期。本研究证实,O-C组OLETF大鼠经长期高脂饲养时极易进展为T2DM,OGTT和高胰岛素-正糖钳夹实验的结果也证实O-C组大鼠存在胰岛素抵抗。而在其22周龄未发生糖尿病时分别给予小剂量的替米沙坦和吡格列酮干预后,T2DM发病情况有所改善。与此同时,与O-C组相比,O-T组大鼠心脏质量、HW/BW、SBP、DBP显著降低,提示替米沙坦可以有效逆转心肌肥厚,这可能与其降低血压减轻心脏室壁所受到的压力有关。
Tab.4 The changes of PPARγ1,PPARγ2 and IL-6 mRNA expression levels in myocardial tissues of four groups表4 各组大鼠心肌PPARγ1、PPARγ2及IL-6 mRNA的表达变化 (±s)
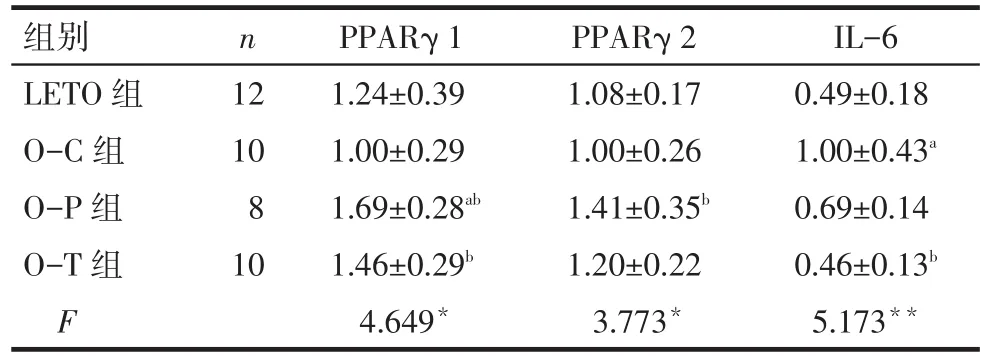
Tab.4 The changes of PPARγ1,PPARγ2 and IL-6 mRNA expression levels in myocardial tissues of four groups表4 各组大鼠心肌PPARγ1、PPARγ2及IL-6 mRNA的表达变化 (±s)
*P<0.05,**P<0.01;a与 LETO 组比较,b与 O-C 组比较,c与 O-P组比较,P<0.05
组别LETO组O-C组O-P组O-T组F n 12 10 8 10 PPARγ 1 1.24±0.39 1.00±0.29 1.69±0.28ab 1.46±0.29b 4.649*PPARγ 2 1.08±0.17 1.00±0.26 1.41±0.35b 1.20±0.22 3.773*IL-6 0.49±0.18 1.00±0.43a 0.69±0.14 0.46±0.13b 5.173**
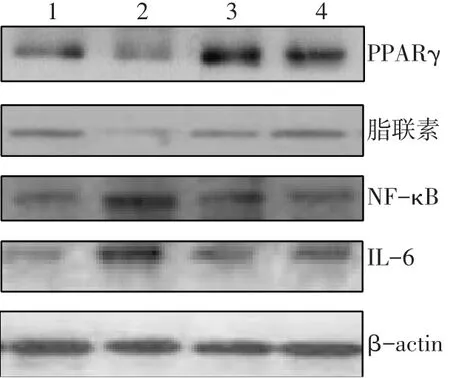
Fig.1 The protein expression levels of PPARγ,adiponectin,NF-κB and IL-6 in myocardial tissues in four groups图1 各组大鼠心肌PPARγ、脂联素、NF-κB及IL-6蛋白表达变化
Tab.5 The protein expression levels of PPARγ,adiponectin,NF-κB and IL-6 in myocardial tissues in four groups表5 各组大鼠心肌PPARγ、脂联素、NF-κB及IL-6蛋白表达变化 (±s)
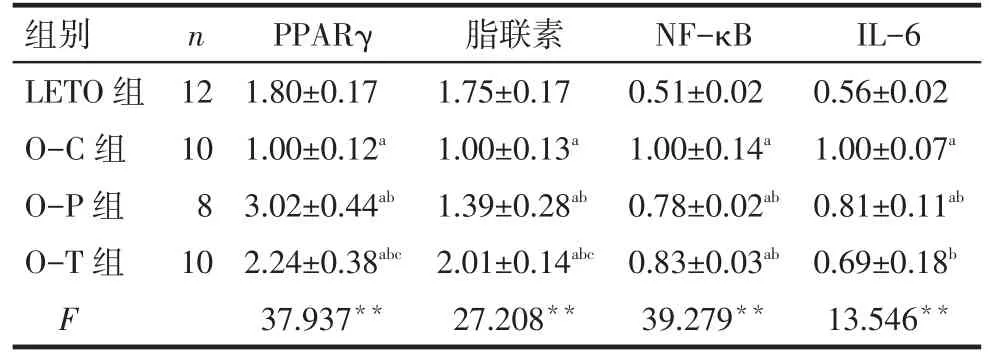
Tab.5 The protein expression levels of PPARγ,adiponectin,NF-κB and IL-6 in myocardial tissues in four groups表5 各组大鼠心肌PPARγ、脂联素、NF-κB及IL-6蛋白表达变化 (±s)
**P<0.01;a与 LETO 组相比,b与 O-C 组相比,c与 O-P 组相比,P<0.05
组别LETO组O-C组O-P组O-T组F n 12 10 8 10 PPARγ 1.80±0.17 1.00±0.12a 3.02±0.44ab 2.24±0.38abc 37.937**脂联素1.75±0.17 1.00±0.13a 1.39±0.28ab 2.01±0.14abc 27.208**NF-κB 0.51±0.02 1.00±0.14a 0.78±0.02ab 0.83±0.03ab 39.279**IL-6 0.56±0.02 1.00±0.07a 0.81±0.11ab 0.69±0.18b 13.546**
心肌间质胶原纤维沉积和心肌纤维化是糖尿病心肌病变的一种重要特征。心肌纤维化是心脏成纤维细胞活性增加,过度产生的细胞外基质(ECM)异常沉积的过程。ECM包括胶原蛋白、弹性纤维、黏多糖和糖蛋白等,ECM的过度沉积可引起心脏硬度增加,顺应性降低,影响心脏的正常舒张和收缩功能[12]。PPARγ 是一种核激素受体,可分为 γ1、γ2 和γ3三种亚型,PPARγ1是PPARγ的主要形式,其表达范围较PPARγ2广泛,PPARγ2主要在脂肪组织中表达[13]。研究发现,PPARγ在人类心室组织中也有表达,PPARγ激动剂可以参与调节脂质代谢以及改善糖尿病心肌代谢异常,减轻心肌ECM的沉积及纤维化,改善心肌肥厚,而PPARγ拮抗剂(GW9662)则可加重心肌纤维化[14]。Qi等[15]发现,PPARs激动剂通过NF-κB及活化蛋白-1(AP-1)等信号转导通路抑制细胞产生IL-6以及TNF-α等炎性因子,从而对心肌肥厚发挥负性调控作用。NF-κB是炎性因子基因表达需要的转录因子,AngⅡ可通过作用于AT1受体,启动一系列信号转导途径,最终激活NF-κB,包括炎性因子在内的许多细胞因子及细胞黏附分子表达上调,促进心脏纤维化;而炎性因子如TNF-α,IL-1β又可上调成纤维细胞上的AT1受体数量,加速 AngⅡ引起的心肌纤维化[16]。Wang 等[17]发现,心肌组织TNF-α在糖尿病时表达明显增加,TNF-α可诱导原癌基因c-myc和c-fos mRNA表达,引起心肌间质胶原纤维堆积、胶原蛋白沉着和间质纤维化,导致心肌的重构。IL-6是左室重构的重要调控信号分子,可使胶原合成与分泌增加,促进组织纤维化。本研究中,与O-C组相比,O-T组血清TNF-α、MCP-1及IL-6的表达水平显著降低。同时病理染色可见O-C组大鼠心肌纤维肿胀,排列紊乱,心肌间质中大量胶原纤维及糖原沉积,心肌糖原沉积越多,心功能下降越明显。糖原沉积在心肌内可能对心肌细胞造成损伤,从而影响心功能。Masson染色显示,O-T组大鼠心肌间质胶原沉积较O-C组明显减少,电镜下心肌纤维排列整齐,线粒体膜基本完整,线粒体损伤较O-C组明显减轻。以上结果提示,替米沙坦作为部分PPARγ激动剂上调循环及心肌组织中PPARγ的表达,减轻心肌纤维化,延缓心肌重构。
脂联素是主要由脂肪细胞分泌的一种细胞因子,具有改善胰岛素敏感性及抗炎等作用[18]。近几年的研究显示,心室肌细胞也能合成、分泌脂联素,其可通过自分泌和旁分泌方式调节心脏功能和心肌代谢,激活并上调心肌中 PPARγ 的表达[19]。Hirotsugu等[20]发现低脂联素水平是左心室肥厚的独立危险因素。Guo等[21]发现脂联素可抑制由心脏超负荷引起的心肌肥大。本研究中,经小剂量替米沙坦干预后,OLETF大鼠循环及心肌中脂联素表达水平明显上调,提示这可能是替米沙坦改善心肌重构的可能机制之一。既往吡格列酮在改善胰岛素抵抗以及降低T2DM发病率方面显现出较大的优势,然而,其也导致体质量增加及心肌内脂质沉积等不良反应[2-3]。相比之下,替米沙坦在降压、降脂、抑制炎性因子及改善心肌光镜及电镜下超微结构等多方面比吡格列酮更具优势。
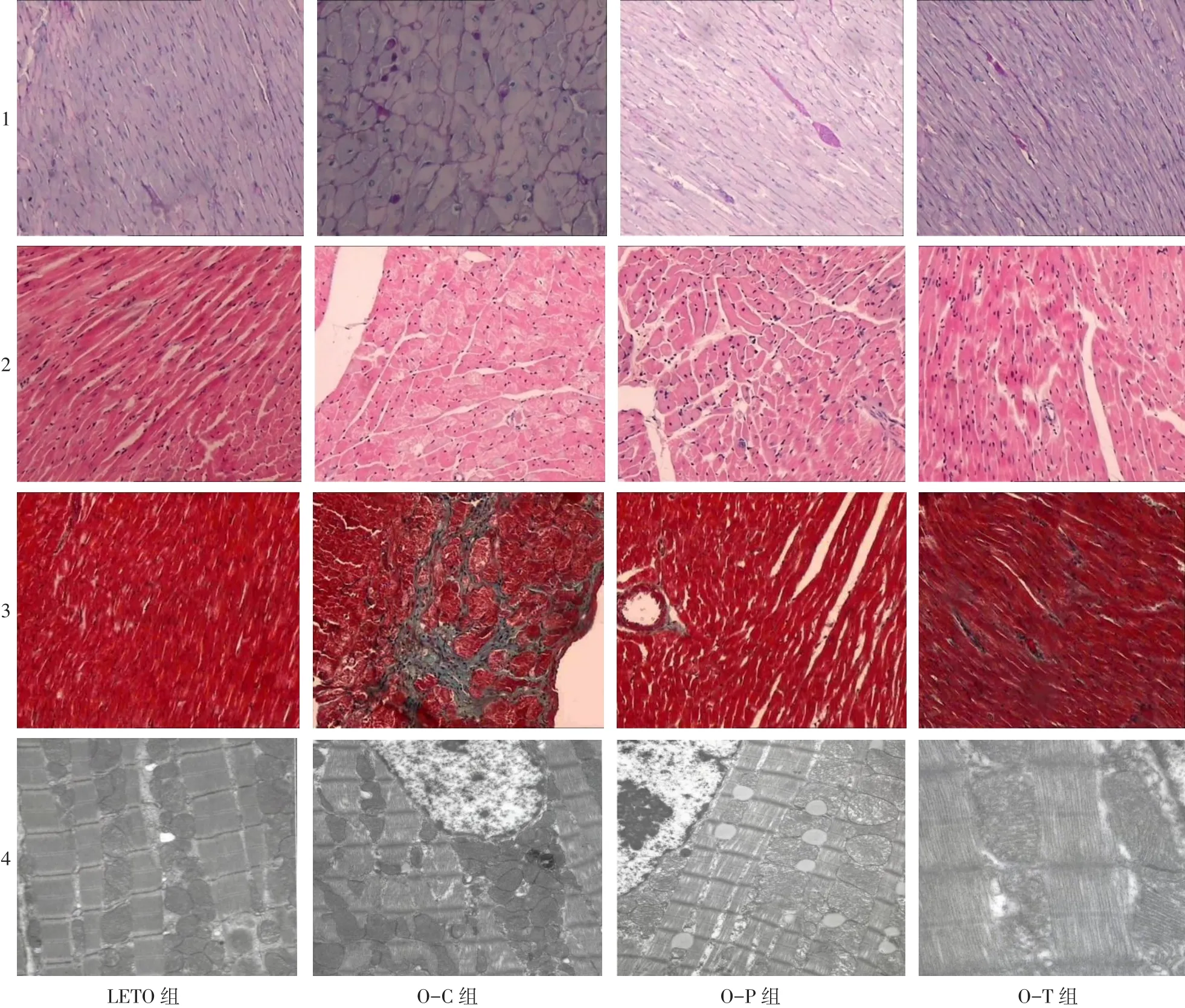
Fig.2 The pathological morphology of myocardial tissue under light microscope and electron microscope of four groups图2 各组大鼠心肌组织光镜及电镜下病理形态变化
综上,小剂量替米沙坦可部分通过上调OLETF大鼠循环及心肌组织中PPARγ的表达,通过一系列信号转导途径抑制炎性因子的表达,上调脂联素的表达,减轻心肌纤维化,延缓心肌重构。
[1]Haffner SM,Lehto S,Rönnemaa T,et al.Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction[J].N Engl J Med,1998,339(4):229-234.doi:10.1056/NEJM199807233390404.
[2]Staels B.Fluid retention mediated by renal PPAR gamma[J].Cell Metab,2005,2(2):77-78.doi:10.1016/j.cmet.2005.08.001.
[3]Rangwala SM,LazarMA.Peroxisome proliferator-activated receptor gamma in diabetes and metabolism[J].Trends Pharmacol Sci,2004,25(6):331-336.doi:10.1016/j.tips.2004.03.012.
[4]Grassi G,Quarti-Trevano F,Mancia G.Cardioprotective effects of telmisartan in uncomplicated and complicated hypertension[J].J Renin Angiotensin Aldosterone Syst,2008,9(2):66-74.doi:10.3317/jraas.2008.017.
[5]Mori Y,Itoh Y,Tajima N.Angiotensin Ⅱ receptor blockers downsize adipocytes in spontaneously type 2 diabetic rats with visceral fat obesity[J].Am J Hypertens,2007,20(4):431-436.doi:10.1016/j.amjhyper.2006.09.016.
[6]Choi SH,Zhao ZS,Lee YJ,et al.The different mechanisms of insulin sensitizers to prevent type 2 diabetes in OLETF rats[J].Diabetes Metab Res Rev,2007,23(5):411-418.doi:10.1002/dmrr.756.
[7]Kawano K,Hirashima T,Mori S,et al.Spontaneous long-term hyperglycemic rat with diabetic complications.Otsuka Long-Evans Tokushima Fatty(OLETF)strain[J].Diabetes,1992,41(11):1422-1428.
[8]Kaneko T,Wang PY,Wang Y,et al.The long-term effect of lowcarbohydrate/high-fat diet on the development of diabetes mellitus in spontaneously diabetic rats[J].Diabetes Metab,2000,26(6):459-464.
[9]Man ZW,Zhu M,Noma Y,et al.Impaired β-cell function and deposition of fat droplets in the pancreas as a consequence of hypertriglyceridemia in OLETF rat,a model of spontaneous NIDDM[J].Diabetes,1997,46(11):1718-1734.
[10]雒瑢,赵紫琴,田凤石,等.替米沙坦上调内脏脂肪组织的脂联素表达并改善胰岛素抵抗[J].中华糖尿病杂志,2013,5(7):416-424.Luo R,Zhao ZQ,Tian FS et al.Telmisartan upregulates the expression of adiponectin in visceral fat and decreases insulin resistance[J].Chinese Journal of Diabetes Mellitus,2013,5(7):416-424.doi:10.3760/cma.j.issn.1674-5809.2013.07.008.
[11]Zhao ZQ,Luo R,Li LY,et al.Angiotensin Ⅱ receptor blocker telmisartan prevents new-onset diabetes in pre-diabetes OLETF rats on a high-fat diet:evidence of anti-diabetes action[J].Can J Diabetes,2013,37(3):156-168.doi:10.1016/j.jcjd.2013.03.024.
[12]Cox TR,Erler JT.Remodeling and homeostasis of the extracellular matrix:implications for fibrotic diseases and cancer[J].Dis Model Mech,2011,4(2):165-178.doi:10.1242/dmm.004077.
[13]赵紫琴,雒瑢,田凤石,等.替米沙坦对OLETF大鼠皮下和内脏脂肪组织PPARγ表达的影响[J].国际内分泌学杂志,2014,34(6):365-370.Zhao ZQ,Luo R,Tian FS,et al.Effects of telmisartan on expression of PPARγ in subcutaneous and visceral adiposetissuein OLETF rats[J].InternationalJournalof Endocrinology and Metabolism,2014,34(6):365-370.doi:10.3760/cma.j.issn.1673-4157.2014.06.002.
[14]Meng Z,Yu XH,Chen J,et al.Curcumin attenuates cardiac fibrosis in spontaneously hypertensive rats through PPAR-γ activation[J].Acta Pharmacol Sin,2014,35(10):1247-1256.doi:10.1038/aps.2014.63.
[15]Qi HP,Wang Y,Zhang QH,et al.Activation of peroxisome proliferator-activated receptor γ(PPARγ)through NF- κB/Brg1 and TGF-β1 pathways attenuates cardiac remodeling in pressureoverloaded rat hearts[J].Cell Physiol Biochem,2015,35(3):899-912.doi:10.1159/000369747.
[16]Gurantz D,Cowling RT,Varki N,et al.IL-1 beta and TNF-alpha upregulate angiotensin Ⅱ type 1(AT1)receptors on cardiac fibroblasts and are associated with increased AT1 density in the post-MI heart[J].J Mol Cell Cardiol,2005,38(3):505-515.doi:10.1016/j.yjmcc.2004.12.015.
[17]Wang L,Zhao Y,Liu Y,et al.IFN-γ and TNF-α synergistically induce mesenchymal stem cell impairment and tumorigenesis via NFκB signaling[J].Stem Cells,2013,31(7):1383-1395.doi:10.1002/stem.1388.
[18]Brochu-Gaudreau K,Rehfeldt C,Blouin R,et al.Adiponectin action from head to toe[J].Endocrine,2010,37(1):11-32.doi:10.1007/s12020-009-9278-8.
[19]Ding G,Qin Q,He N,et al.Adiponectin and its receptors are expressed in adult ventricular cardiomyocytes and upregulated by activation of peroxisome proliferator-activated receptor-gamma[J].J Mol Cell Cardiol,2007,43(1):73-84.doi:10.1016/j.yjmcc.2007.04.014.
[20]Hirotsugu M,Hiroshi Y,Koji T,et al.Adiponectin level and left ventricular hypertrophy in Japanese Men[J].Hypertension,2007,49(6):1448-1454.doi:10.1161/HYPERTENSIONAHA.106.079509.
[21]Guo BY,Li YJ,Han R,et al.Telmisartan attenuates isoproterenolinduced cardiac remodeling in rats via regulation of cardiac adiponectin expression[J].Acta Pharmacol Sin,2011,32(4):449-455.doi:10.1038/aps.2010.231.
