山药提取物联合替加氟对结肠癌HT-29细胞株体内外杀伤作用的研究
2018-04-26孙雯雯宋林李宏峰范玉强
孙雯雯,宋林,李宏峰,范玉强
替加氟为氟尿嘧啶的衍生物,目前是治疗恶性消化道肿瘤的常用化疗药物,但会对消化系统和血液系统等产生一系列的不良反应[1]。山药能增加T淋巴细胞的活性,增强机体免疫力,抑制肿瘤细胞增殖,山药提取物中山药多糖具有较好地诱导肝癌、胃癌、结肠癌等肿瘤细胞凋亡、抑制血管新生、抑制肿瘤细胞的侵袭与转移、逆转耐药性、增强机体免疫力等多种抗癌作用[2-4]。本研究旨在探讨山药提取物与替加氟联合使用对结肠癌的体内外杀伤效果。
1 材料与方法
1.1 材料 结肠癌HT-29细胞(美国ATCC®HTB-38TM)由天津市肿瘤医院惠赠;DMEM培养基购自美国Gibco公司;0.25%胰酶消化液购自索莱宝公司;CD133磁珠抗体购自德国Miltenyi公司;MTT试剂盒购自瑞士Roche公司;一抗兔抗血管内皮生长因子(VEGF)抗体,山羊抗兔二抗购自美国Santa Cruz公司;山药饮片购自宛西制药厂,生药用8倍量的水提取3次,每次2 h,合并滤液,先经70℃旋蒸浓缩,后转移至蒸发皿中于70℃真空至干,提取率为2.78%,提取物主要成分是多糖,多糖含量为(324.90±0.82)mg/g;替加氟购自辰欣药业股份有限公司。实验动物:SPF级BALB/c nude小鼠购自维通利华公司,动物合格证号为11400500018046,雌性,3~4周龄,40只,体质量 16~18 g,饲养于 IVC 系统内。
1.2 主要仪器 CO2培养箱、生物安全柜(Thermo公司,美国);显微镜(Olympus公司,日本);流式细胞仪(BD公司,美国);离心机(Eppendorf公司,德国);磁珠分选器(Miltenyi公司,德国);IVC系统主机(苏州市苏杭科技器材有限公司,中国)。
1.3 细胞毒实验 取对数生长期HT-29细胞,用含10%胎牛血清的RPMI 1640培养液制成5×104个/mL单细胞悬液,接种于96孔培养板中,每孔加入180µL。培养24 h后,加入受试药物。实验共分4组:(1)空白对照组,加入等体积含二甲基亚砜(DMSO)的生理盐水。(2)山药提取物组,调节终质量浓度为125 mg/L。(3)替加氟组,调节终质量浓度为36 mg/L。(4)联合治疗组,调节山药提取物终质量浓度为125 mg/L,并且替加氟终质量浓度为36 mg/L。将平板在37℃、5%CO2的温箱中孵育36 h,去除培养液。每孔加入含0.5 g/L MTT的PBS液100µL,37℃温育36 h。弃去上清液,每孔加入100µL DMSO,置于全自动酶标仪490 nm处测定光密度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组OD/对照组OD)×100%,实验重复5次。
1.4 流式细胞仪检测干细胞比例 取对数生长期HT-29细胞,用0.25%胰酶/0.2%EDTA消化液消化,观察细胞变圆、连接消失后,用完全培养基终止消化。将细胞悬液吸入10 mL离心管,400×g,离心 5 min,弃去培养液,用 80µL缓冲液(0.5%BSA,2 mmol/L EDTA,0.01 mmol/L PBS)洗涤,重悬。加入20µL FC受体阻断剂,加入鼠抗人CD133单抗,再加入上述4组药物,同时在对照细胞中添加相应的同型对照小鼠IgG2a-PE 10µL,4℃避光放置 30 min,PBS洗 2次,除去未结合一抗,400×g,离心5 min,除去上清液,各管加入500µL PBS重悬;标记好的细胞悬液经200目筛网滤过,用流式细胞仪检测CD133+细胞(HT-29细胞的干细胞)的比例。
1.5 建立结肠癌荷瘤裸鼠模型 BALB/c裸鼠40只适应性饲养1周,将0.2 mL细胞浓度为5×105/mL HT-29细胞溶于1 mL无血清培养基与matrigel基底膜1∶1混合液中,用微量注射器,接种于BALB/c裸鼠右侧腋下,观察裸鼠成瘤情况,接种部位出现质地较硬的肿瘤结节等指征认定为成瘤。
1.6 荷瘤裸鼠的治疗 将上述荷瘤裸鼠完全随机分为4组,每组10只。(1)空白对照组,尾静脉注射生理盐水,每天1次,每次 0.2 mL。(2)山药提取物组,按《中国药典》规定,小鼠日服剂量是每千克体质量4.5 g(生药量),提取物提取率为2.78%,故小鼠给药剂量为125 mg/kg,每天1次灌胃0.2 mL。(3)替加氟组,尾静脉注射替加氟化疗药物,剂量为36 mg/kg,连续5 d给药。(4)联合治疗组(山药联合替加氟组),尾静脉注射替加氟化疗药物,剂量为36 mg/kg,连续5 d给药;同时按上述山药提取物组每天1次灌胃0.2 mL配制的溶液。自给药日起,每天观察各组小鼠的生存状况及死亡情况,给药6周后处死荷瘤鼠,取瘤组织称质量。计算抑瘤率。抑瘤率=(1-给药组瘤质量/对照组瘤质量)×100%
1.7 VEGF的检测 给药6周后处死4组裸鼠,分离皮下移植瘤组织,先放置在液氮中,然后保存在-80℃的冰箱保存。将移植瘤组织切片,脱水,抗原修复(包括热修复、胰酶修复等),抑制内源性过氧化物酶,一抗用兔抗VEGF抗体封闭,孵育切片30 min,二抗用山羊抗兔抗体孵育切片30 min,然后用DAB工作液显色,用苏木素复染后,盐酸乙醇分化,再用氨水返蓝。自来水冲洗切片、切片脱水、透明、封片,用光学显微镜进行检测。
VEGF读片标准为+/-:每个高倍视野下,<2%的癌细胞细胞浆呈棕黄色染色者;+:每个高倍视野下,2%~9%的癌细胞细胞浆呈棕黄色染色者;++:每个高倍视野下,10%~49%的癌细胞细胞浆呈棕黄色染色者;+++:每个高倍视野下,50%~79%的癌细胞细胞浆呈棕黄色染色者;++++:每个高倍视野下,≥80%的癌细胞细胞浆呈棕黄色染色者。
1.8 统计学方法 采用SPSS 18.0进行统计处理,计量数据用均数±标准差(±s)表示,采用2×2析因设计的方法分析独立效应和组间交互效应,P<0.05为差异有统计学意义。
2 结果
2.1 山药提取物联合替加氟对结肠癌HT-29细胞形态的影响 药物与细胞共孵育72 h后,倒置显微镜下可见,对照组HT-29细胞生长旺盛,折光率较高,胞体大,形态成梭形或多边形,胞质均匀透明,核仁清楚,生长良好。3个给药组细胞增殖减慢,细胞逐渐变小、变圆,折光率减弱,核浓缩,部分脱落漂浮,裂解,见图1。
2.2 山药提取物联合替加氟对结肠癌HT-29细胞增殖抑制及结肠癌干细胞(CD133+)表达的影响 3个给药组对结肠癌HT-29细胞增殖能力的抑制作用明显高于空白对照组(P<0.05);联合治疗组对结肠癌HT-29细胞增殖能力的抑制作用明显高于山药提取物组和替加氟组(P<0.05);山药提取物组与替加氟组间差异无统计学意义。与空白对照组相比,3个给药组细胞中CD133+细胞比例明显下降(P<0.05);联合治疗组较山药提取物组、替加氟组明显下降(P<0.05);山药提取物组与替加氟组差异无统计学意义。见表1。
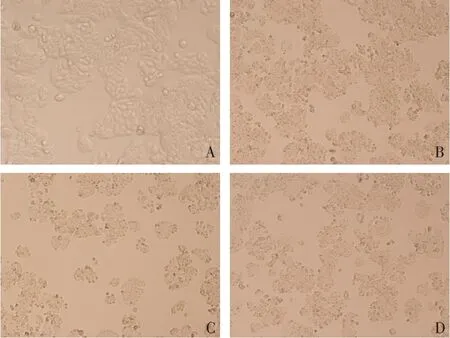
Fig.1 Effects of yam extract with tegafur on the morphology of colon cancer HT-29 cells(×400)图1 山药提取物联合替加氟对结肠癌HT-29细胞形态的影响(×400)
Tab.1 Effects of yam extract combined with tegafur on the proliferation and proportion of CD133+of colon cancer cell HT-29表1 山药提取物联合替加氟对结肠癌HT-29细胞增殖抑制及CD133+比例的影响 (n=5,±s)
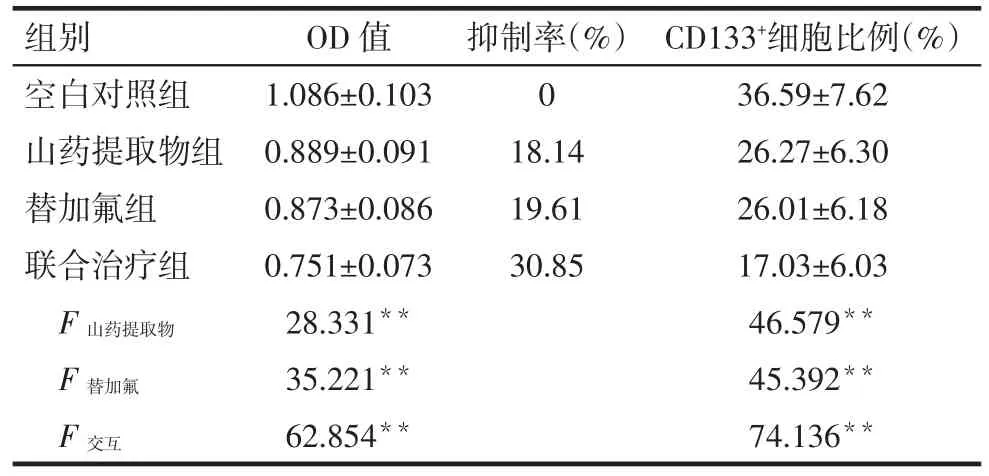
Tab.1 Effects of yam extract combined with tegafur on the proliferation and proportion of CD133+of colon cancer cell HT-29表1 山药提取物联合替加氟对结肠癌HT-29细胞增殖抑制及CD133+比例的影响 (n=5,±s)
**P<0.01;表 2 同
组别空白对照组山药提取物组替加氟组联合治疗组抑制率(%)0 18.14 19.61 30.85 F 山药提取物F 替加氟F交互OD值1.086±0.103 0.889±0.091 0.873±0.086 0.751±0.073 28.331**35.221**62.854**CD133+细胞比例(%)36.59±7.62 26.27±6.30 26.01±6.18 17.03±6.03 46.579**45.392**74.136**
2.3 山药提取物联合替加氟对荷瘤裸鼠生存状况的影响 治疗期间,山药提取物组和联合治疗组荷瘤裸鼠始终活动自如,进食进水正常,情绪平稳。空白对照组在治疗第3周开始出现活动受阻的现象。替加氟组在注射化疗药物后,荷瘤裸鼠活动减弱,进水进食减少,精神萎靡,出现弓背现象,在治疗第2周出现濒死状态。
2.4 山药提取物联合替加氟对荷瘤裸鼠的抑瘤作用 治疗后,3个给药组荷瘤裸鼠的瘤体质量明显低于空白对照组(P<0.05),联合治疗组荷瘤裸鼠的瘤体质量明显低于山药提取物组和替加氟组(P<0.05);山药提取物组与替加氟组差异无统计学意义,见表 2,图 2。
Tab.2 Changes of tumor body mass and inhibitory rates after treatment in four groups表2 各治疗组对荷瘤瘤体质量的抑制作用(n=10,±s)
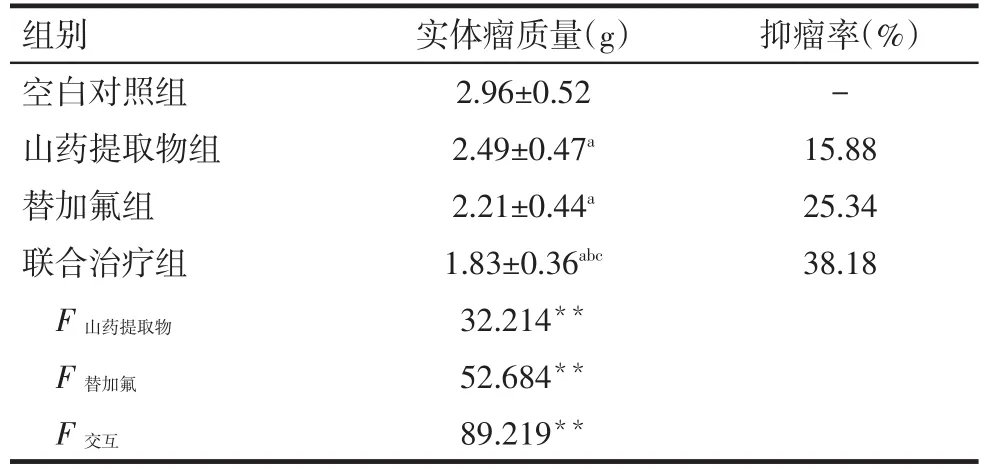
Tab.2 Changes of tumor body mass and inhibitory rates after treatment in four groups表2 各治疗组对荷瘤瘤体质量的抑制作用(n=10,±s)
**P<0.01
组别空白对照组山药提取物组替加氟组联合治疗组抑瘤率(%)-15.88 25.34 38.18 F 山药提取物F 替加氟F交互实体瘤质量(g)2.96±0.52 2.49±0.47a 2.21±0.44a 1.83±0.36abc 32.214**52.684**89.219**

Fig.2 Final tumor volumes after immunotherapy图2 治疗结束各组瘤体积大小
2.5 山药提取物联合替加氟对瘤体VEGF阳性表达率的影响 VEGF表达于细胞膜或胞浆,光镜下观察结果,胞浆出现棕褐色或棕黄色颗粒,染色强度高于背景者为蛋白表达阳性的细胞,强阳性(+++)表达为清晰的棕褐色颗粒。治疗后,空白对照组、山药提取物组、替加氟组、联合治疗组瘤体VEGF阳性的表达率分别80%、60%、50%、30%,见图3。
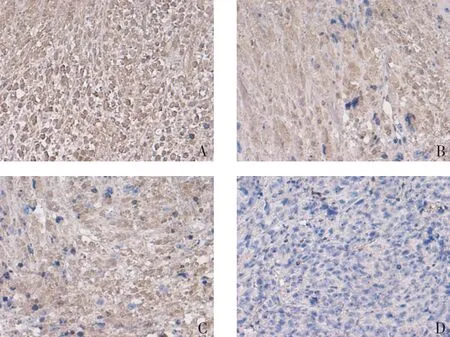
Fig.3 Pictures showing immunohistochemical staining of VEGF in tumor under the optical microscope(×200)图3 瘤体标本VEGF免疫组化染色光学显微镜下观察(×200)
3 讨论
结肠癌是常见的恶性消化道肿瘤,中医认为,结肠癌是由于湿、瘀、热、毒等因素致脏腑功能紊乱、气血阴阳失调而引起的。CD133为五次跨膜糖蛋白家族的一员,开始被认为是人造血干细胞的选择标志,近年来的研究表明CD133可以作为鉴定及分离结肠癌肿瘤干细胞的标志[5-6]。
长期以来氟尿嘧啶始终是治疗恶性消化道肿瘤的首选药物,替加氟为氟尿嘧啶的衍生物,在体内逐渐转变为氟尿嘧啶而起作用。其抗癌作用方式是以RNA为靶向的细胞毒性作用。有报道替加氟会对消化系统和血液系统产生一系列的不良反应,如胃肠道反应恶心呕吐、骨髓抑制、白细胞降低、血小板减少等[1]。本研究发现,在体外实验中替加氟可以使结肠癌HT-29细胞逐渐变小,核浓缩,部分脱落漂浮,进而抑制了HT-29细胞的增殖,降低肿瘤干细胞的比例。替加氟对荷瘤裸鼠具有一定的抑瘤作用,抑瘤率达25.34%,但裸鼠出现了活动减少,进水进食减少,精神萎靡等现象,说明化疗药在杀伤肿瘤细胞的同时,对机体的不良反应较大。
中药应用于临床抗癌治疗历史悠久。中药具有多靶点、不易产生耐药性、不良反应小、多效应、安全性高等优点[7]。作为药食同源的山药具有较好的抗癌作用[2],《本草纲目》谓其益肾气,健脾胃,止泄痢,化痰涎,润皮毛。现代研究发现,山药可诱导黑色素瘤、肺癌、食管癌、肝癌、胃癌等多种肿瘤细胞凋亡[3-4]。其活性成分包括薯蓣皂苷、尿囊素、山药多糖[8]、山药黏液蛋白[9]、黄酮、微量元素等。山药多糖具有潜在的免疫调节作用,可体外刺激刀豆蛋白诱发的T淋巴细胞增生,提升血清中IgG的浓度,进而促进淋巴细胞的增殖[2]。赵国华等[3]用不同剂量的山药多糖RDPS-Ⅰ喂养荷瘤鼠,当剂量达50 mg/kg时,对Lewis肺癌有抑制效果;当剂量达150 mg/kg时,对Lewis肺癌和B16黑色素瘤均有抑制效果。山药可通过抑制MAPK、Akt、NF-κB等途径抑制黏附分子的表达[10]。本实验室发现山药提取物作用于结肠癌HT-29细胞72 h后可使HT-29细胞逐渐变小,核浓缩,部分脱落漂浮,细胞增殖能力减弱,肿瘤干细胞的比例明显降低;体内动物实验显示,山药提取物对荷瘤裸鼠具有一定的抑瘤效果,治疗期间荷瘤裸鼠始终活动自如、进食进水正常,提示山药提取物在抑瘤的同时不良反应小。山药提取物联合替加氟,在体外的肿瘤细胞增殖抑制实验和体内抑瘤实验中均好于单独使用山药提取物组或替加氟组,表明山药提取物和替加氟之间具有协同作用。
VEGF是肿瘤血管形成[11]、刺激肿瘤细胞进行血液转移[12]中最重要的生长因子,其在恶性肿瘤的发生、发展及预后中具有重要作用,VEGF表达程度反映肿瘤血管内皮细胞增殖、迁移和血管构建水平,直接反映了肿瘤生长的速度和转移的倾向。因此,抑制VEGF的产生、阻止其发挥作用是抗肿瘤血管生成进而达到有效治疗肿瘤的关键[13-15]。本研究通过免疫组化法观察到联合治疗组VEGF的阳性表达率明显低于单独使用山药提取物组和替加氟组,结果表明山药提取物联合替加氟通过抑制肿瘤血管生成达到抑制肿瘤的效果,体内、体外实验结果一致。
据报道,山药及其主要成分薯蓣皂苷元可通过调节脂蛋白脂质酶表达,降低血清中三酰甘油水平,同时通过调节氧化应激、凋亡等,发挥预防氧化偶氮甲烷/葡聚糖硫酸钠诱导的小鼠结肠癌的发生[16]。以上结果均证明山药具有较好的抗肿瘤活性,且在联合化疗药应用方面具有较好的前景。
[1]钟润娴,单钰齐,朱结桃,等.抗肿瘤药物不良反应调查与分析[J].北方药学,2015,12(10):144-145.Zhong RX,Shan YQ,Zhu JT,et al.Investigation and analysis of antitumor drug adverse reaction[J].Journal of North Pharmacy,2015,12(10):144-145.
[2]Liu Y,Li H,Fan Y,Man S,et al.Antioxidant and antitumor activities of the extracts from Chinese Yam(dioscorea opposite hhunb)flesh and peel and the effective compounds[J].J Food Sci,2016,81(6):H1553-1564.doi:10.1111/1750-3841.13322.
[3]赵国华,李志孝,陈宗道.山药多糖RDPS-I的结构分析及抗肿瘤活性[J].药学学报,2003,38(1):37-41.Zhao GH,Li ZX,Chen ZD.The structure of yam polysaccharide RDPS-i analysis and antitumor activity[J].Acta Pharmaceutica Sinica,2003,38(1):37-41.doi:10.16438/j.0513-4870.2003.01.009.
[4]石亿心,于莲,翟美芳,等.纳米山药多糖对4种肿瘤细胞的作用[J].中国现代应用药学,2016,33(8):967-971.Shi YX,Yu L,Zhai MF,et al.Effect of nano Chinese Yam polysaccharide on 4 kinds of tumor cells[J].Chinese Journal of Modern Applied Pharmacy,2016,33(8):967-971.doi:10.13748/j.cnki.issn1007-7693.2016.08.001.
[5]孙雯雯,崔晓旭,窦金霞,等.CD133作为结肠癌HT-29细胞系干细胞特异性生物标志的研究[J].中国慢性病预防与控制,2016,24(1):51-53.Sun WW,Cui XX,Dou JX,et al.Research of CD133 as colon cancer stem cell of specific biomarkers of HT-29 cell line[J].Chinese Journal of Prevention and Control of Chronic Non-Communicable Diseases,2016,24(1):51-53.doi:10.16386/j.cjpccd.issn.1004-6194.2016.01.015.
[6]Riether C,Schurch C,Ochsenbein AF.From"magic bullets"to specific cancer immunotherapy[J].Swiss Med Wkly,2013,143:w13734.
[7]李秀才.中药抗肿瘤血管生成的研究进展[J].现代肿瘤医学,2014,22(8):1993-1996.Li XC.Research progress in anti-tumor angiogenesis of Chinese medicine[J].Modern Oncology,2014,22(8):1993-1996.doi:10.3969/j.issn.1672-4992.2014.08.77.
[8]Yang W,Wang Y,Li X,et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J].Carbohydrate Polym,2015,117:1021-1027.
[9]牛春城,覃瑞,郭小华.山药粘蛋白的快速分离及其抗肿瘤活性的研究[J].轻工科技,2014,(7):34-35.Niu CC,Tan R,Guo XH.The rapid separation of yam mucin and its antitumor activity[J].Light Industry Science and Technology,2014,(7):34-35.
[10]Choi KW,Um SH,Kwak JH,et al.Suppression of adhesion molecule expression by phenanthrene-containing extract of bulbils of Chinese Yam in vascular smooth muscle cells through inhibition of MAPK,Akt and NF-κB[J].Food Chem Toxicol,2012,50(8):2792-2804.doi:10.1016/j.fct.2012.05.005.
[11]Hernandez SL,Banerjee D,Garcia A,et al.Notch and VEGF pathways play distinctbutcomplementary roles in tumor angiogenesis[J].Vascular Cell,2013,5(1):17.
[12]杨军,王连新,季骊,等.VEGF及DLL4在肝细胞癌中的表达及临床意义[J].实用临床医学杂志,2014,18(9):34-37.Yang J,Wang LX,Ji L,et al.Expression and clinical significance of VEGF and DLL4 in hepatocellular[J].Journal of Clinical Medicine in Practice,2014,18(9):34-37.doi:10.7619/jcmp.201409009.
[13]王斌,刘瑶,邹飞,等.TRPC通道在缺氧胶质瘤细胞VEGF表达中的作用[J].中华神经医学杂志,2013,12(2):109-113.Wang B,Liu Y,Zou F,et al.Effect of canonical transient receptor potential channels on hypoxia-induced VEGF expression in glioblastoma cells[J].Chin J Neuromed,2013,12(2):109-113.doi:10.3760/cma.j.issn.1671-8925.2013.02.001.
[14]Lu G,Dong Y,Zhang Q,et al.Predictive value of vascular endothelial growth factor polymorphisms on the risk of renal cell carcinomas:a case-control study[J].Tumor Biol,2015,36(11):8645-8652.doi:10.1007/s13277-015-3431-1.
[15]Beuselinck B,Jean-Baptiste J,Couchy G,et al.RANK/OPG ratio of expression in primary clear-cell renal cell carcinoma is associated with bone metastasis and prognosis in patients treated with anti-VEGFR-TKIs[J].Br J Cancer,2015,113(9):1313-1322.doi:10.1038/bjc.2015.352.
[16]Miyoshi N,Nagasawa T,Mabuchi R,et al.Chemoprevention of azoxymethane/dextran sodium sulfate-induced mouse colon carcinogenesis by freeze-dried yam sanyaku and its constituent diosgenin[J].Cancer Prev Res(Phila),2011,4(6):924-934.doi:10.1158/1940-6207.CAPR-10-0279.
