5-氮杂-2′-脱氧胞苷对人乳腺癌细胞Hs578T 增殖和PRDM10基因甲基化的影响
2018-04-26张晓宇白杰康晓宁靳丽君王鹏刘伟王遵义
张晓宇,白杰,康晓宁,靳丽君,王鹏,刘伟,王遵义△
乳腺癌是一种发病率和死亡率均很高的恶性肿瘤,据世界卫生组织预测,到2025年将超过1 900万例的癌症被确诊为乳腺癌[1]。肿瘤细胞呈现出的无序、无限制恶性增殖,以及肺、脑及骨等全身重要脏器的转移,都将直接威胁人类的生命健康。通常认为乳腺癌是乳腺上皮细胞在多种致癌因子作用下发生了基因突变,致使细胞增殖失控。约5%~10%的乳腺癌患者有家族聚集的特点[2-3]。80%~85%具有易感基因突变的女性罹患乳腺癌的风险远远高于不具有易感基因突变的女性[4-5]。
PRDM 蛋白(PR domain zinc finger protein)是一个氨基端含有保守的PR同源区(简称PR区)的锌指蛋白家族[6-7]。PRDM是Ca2+依赖磷脂结合蛋白,在机体的许多生理及病理过程中起重要作用,可调控细胞完整性、细胞分化、生长及凋亡,还可抑制肿瘤细胞的生长等。PRDM与肿瘤关系密切,其基因启动子甲基化与肿瘤的发生发展密切相关。目前PRDM家族基因的研究主要集中于肺癌、前列腺癌、肾癌和淋巴瘤,涉及乳腺癌的研究较少。经甲基转移酶抑制剂等处理后,因基因启动子区发生甲基化而失活的基因可以恢复mRNA的转录而重新表达。5-氮杂-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)是一种最常用的DNA甲基转移酶抑制剂,其作用机制是通过与DNA甲基转移酶共价结合,降低DNA甲基转移酶的生物活性,从而降低甲基化水平。本研究采用不同浓度5-Aza-CdR处理乳腺癌细胞Hs578T,探究PRDM10基因甲基化对乳腺癌细胞Hs578T增殖的影响。
1 材料与方法
1.1 实验材料
1.1.1 细胞培养 人乳腺癌细胞系Hs578T购于中国科学院上海细胞库,由河北省沧州市中心医院中心实验室保存。Hs578T使用含有10%灭活胎牛血清的RPMI 1640培养液(美国Gibco公司),放置于37℃、5%CO2、95%空气湿度培养箱中培养。细胞单层贴壁生长,取对数期生长细胞用于实验。
1.1.2 主要试剂与仪器 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)溶液、二甲基亚砜(Dimethylsulfoxide,DMSO)、5-Aza-CdR、Trizol均购自美国 Sigma公司。PRDM10抗体和羊抗兔IgG购自Affinity公司。BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司。Mini BEST Universal Genomic DNA Extraction Kit Ver 5.0试剂盒购自日本TaKaRa公司,EZ-DNA Methylation-Gold KitTMDNA甲基化修饰试剂盒购自美国Zymo公司,Access RT-PCR system试剂盒购自美国Promega公司,ECL化学发光试剂盒购自上海静融生物科技有限公司。ELX800自动酶标仪购自美国Bio-Tek公司,紫外凝胶成像系统购自美国Bio-Rad公司,HIPAS-1000型图像分析系统购自武汉华海公司,全自动多功能酶标仪购自美国Thermo公司。
1.2 方法
1.2.1 MTT比色法测定5-Aza-cdR对Hs578T增殖的影响 Hs578T细胞消化计数后,将2 000个细胞接种在96孔板的每个孔内,加入100µL含血清培养基,37℃恒温培养,共接种4块板。24 h细胞完全贴壁,分别用0(对照组)、1、3和5µmol/L 5-Aza-CdR处理细胞,调整每孔终体积为200µL,每个浓度设置5个复孔。分别于处理24、48、72和96 h后测量细胞量,每孔加入5 g/L的MTT溶液继续培养4 h。吸净培养基,每孔加入150µL DMSO,在摇床上轻柔摇匀,孵育1 h。待MTT结晶充分溶解,在ELX800自动酶标仪上读取每个孔的光密度(OD)值(570 nm)。每个实验重复3次。
1.2.2 MSP检测PRDM10基因启动子甲基化状态 采用甲基化特异性PCR法(Methylation-specific PCR,MSP)检测5-Aza-CdR对人乳腺癌细胞Hs578T中PRDM10基因启动子甲基化状态的影响。分别收集0(对照组)、1、3和5µmol/L 5-Aza-CdR处理72 h的人乳腺癌细胞Hs578T,每个浓度设置5个复孔。采用Mini BEST Universal Genomic DNA Extraction Kit Ver 5.0试剂盒提取基因组DNA。1.5%琼脂糖凝胶电泳检测DNA完整性后,采用EZ-DNA Methylation-Gold KitTMDNA甲基化修饰试剂盒进行DNA甲基化修饰。扩增引物采用MethyPrimer软件(http://www.urogene.org/cgibin/methprimer/methprimer.cgi)设计,委托上海生工生物工程技术服务有限公司合成。PRDM10甲基化(PRDM10-M)的引物序列:上游 5′-TGGTTTTTTTGTAGATTGAATAAGC-3′,下游 5′-TAAACTCTATAAACCCCATACCGTA-3′,扩增片段120 bp。PRDM10未甲基化(PRDM10-UM)的引物序列:上游 5′-TGGTTTTTTTGTAGATTGAATAAGC-3′,下游 5′-TAAACTCTATAAACCCCATACCGTA-3′,扩增片段 118 bp。反应体系 50µL,包括去离子水 16µL、2×Taq Master Mix 25µL、DNA模板3µL、浓度为10µmol/L的上、下游引物各3µL。PCR反应条件:94℃预变性5 min;94℃变性30 s,63℃退火30 s,72℃延伸60 s,共 35个循环,72℃延伸 5 min。1.5%琼脂糖凝胶电泳,紫外凝胶成像系统扫描采集图像,对扩增产物条带进行OD值半定量测量。实验重复3次。
1.2.3 RT-PCR检测PRDM10的mRNA表达水平 将1×105个细胞接种至6孔板中,贴壁后分别用0(对照组)、1、3和5µmol/L 5-Aza-CdR处理细胞72 h,每个浓度设置5个复孔,用Trizol提取细胞总RNA,并反转录成cDNA。扩增引物分别利用 Primer 3软件(http://primer3.ut.ee/)设计,委托上海生工生物工程技术服务有限公司合成。PRDM10基因的引物序列:上游 5′-TGGCCCTGCTATGAATGTAAC-3′,下游5′-GGGATTGGGATAGTGGTCTGT-3′,扩增片段 323 bp。参照Access RT-PCR system试剂盒说明书进行反转录和PCR扩增,50µL反应体系添加0.1µg模板,上、下游引物的终浓度分别为1µmol/L。PCR反应条件:94℃预变性5 min;94℃变性 30 s,57℃退火60 s,72℃延伸 60 s,共 35个循环,72℃延伸3 min。1.5%琼脂糖凝胶电泳,紫外凝胶成像系统扫描采集图像,对扩增产物条带进行OD值半定量测量。实验重复3次。
1.2.4 Western blot检测PRDM10的蛋白表达水平 将1×105个细胞接种至6孔板,贴壁后分别用0(对照组)、1、3和5µmol/L 5-Aza-CdR处理细胞72 h,每个浓度设置5个复孔。处理结束后收集并裂解细胞,BCA蛋白浓度测定试剂盒检测总蛋白量。样本经10%SDS-聚丙烯酰胺凝胶电泳(100 V恒压)分离,然后按照凝胶面积以0.65 mA/cm2恒流电转移1.5 h将蛋白自凝胶转印至PVDF膜。PVDF膜经5%脱脂奶粉室温封闭2 h后,加入1∶1 000稀释的兔抗人PRDM10抗体,4℃孵育过夜,TBST漂洗后用1∶2 000稀释的辣根过氧化物酶标记的羊抗兔IgG二抗孵育1.5 h,漂洗后用ECL化学发光试剂盒增强发光,X线胶片显影。利用HIPAS-1000型图像分析系统对X线胶片上的条带进行OD值测量。以β-actin蛋白作为内参。实验重复3次。
1.3 统计学方法 采用SPSS 17.0软件包对数据进行分析。计量资料以均数±标准差(±s)表示。处理前后两样本均数比较采用配对t检验,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;不同时点多组间比较采用重复测量设计的方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 5-Aza-CdR对人乳腺癌细胞Hs578T增殖的影响 (1)组间比较。24 h时,0、1、3、5 µmol/L 5-Aza-CdR组Hs578T的OD值差异无统计学意义(P>0.05);48 h时,3、5µmol/L组 OD 值低于 0µmol/L组(P<0.05);72 h和 96 h时,1、3、5µmol/L 组均低于 0µmol/L,5µmol/L 组低于 1µmol/L(P<0.05)。(2)组内比较。0µmol/L组OD值随时间逐渐增高,组间多重比较差异均有统计学意义;1µmol/L组OD值 48、72、96 h 均高于 24 h,96 h 高于 48 h(P<0.05);3 µmol/L 组 OD 值 48、72、96 h 均高于 24 h,同时 96 h高于 48 h(P<0.05);5µmol/L组 OD 值不同时点间差异无统计学意义。组间和处理时间之间存在交互效应(P<0.05),见表1。
Tab.1 Comparison of the cell growth after treatment with different concentrations of 5-Aza-CdR表1 不同浓度5-Aza-CdR处理细胞后细胞生长情况比较(n=5,±s)
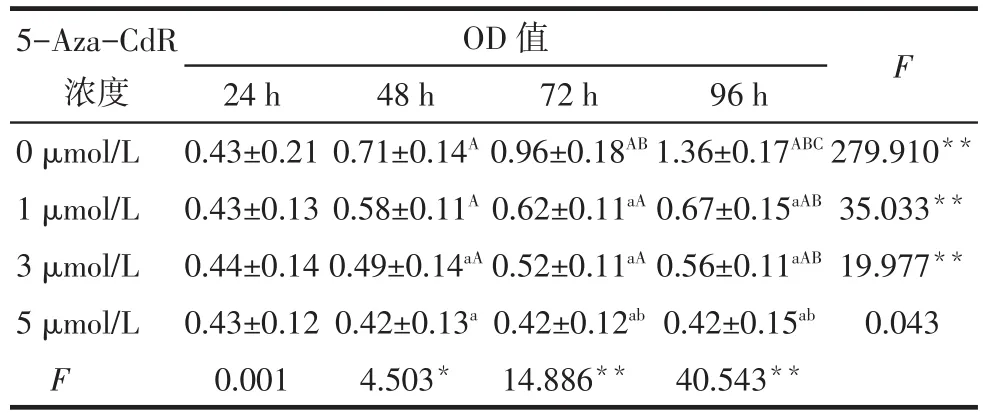
Tab.1 Comparison of the cell growth after treatment with different concentrations of 5-Aza-CdR表1 不同浓度5-Aza-CdR处理细胞后细胞生长情况比较(n=5,±s)
*P<0.05,**P<0.01;F 组间=10.087,F 时间 =165.117,F 交互=73.334,均 P<0.05;组间比较:a与 0µmol/L 比较,b与 1µmol/L 比较,c与 3µmol/L 比较,P<0.05;组内比较:A与 24 h 比较,B与 48 h 比较,C与72 h比较,P<0.05
5-Aza-CdR浓度0µmol/L 1µmol/L 3µmol/L 5µmol/L F OD值24 h 0.43±0.21 0.43±0.13 0.44±0.14 0.43±0.12 0.001 48 h 0.71±0.14A 0.58±0.11A 0.49±0.14aA 0.42±0.13a 4.503*72 h 0.96±0.18AB 0.62±0.11aA 0.52±0.11aA 0.42±0.12ab 14.886**96 h 1.36±0.17ABC 0.67±0.15aAB 0.56±0.11aAB 0.42±0.15ab 40.543**F 279.910**35.033**19.977**0.043
2.2 5-Aza-CdR对人乳腺癌细胞Hs578T中PRDM10基因甲基化的影响 (1)组间比较。处理前,0、1、3、5µmol/L 组 OD 值各组间差异均无统计学意义。处理后,0~5µmol/L组OD值逐渐降低,3µmol/L与5µmol/L组间比较差异无统计学意义,其余各组间多重比较差异均有统计学意义(P<0.05)。(2)组内比较。1、3、5µmol/L 组处理后显著低于处理前(P<0.05)见表 2、图 1。
2.3 5-Aza-CdR对人乳腺癌细胞Hs578TPRDM10表达的影响 RT-PCR和Western blot结果均显示,不同浓度5-Aza-CdR处理细胞后,0~5µmol/L组人乳腺癌细胞Hs578TPRDM10mRNA和蛋白表达水平均逐渐升高,且组间多重比较差异均有统计学意义(P<0.05),见表 3、图 2。
3 讨论
DNA甲基化和组蛋白甲基化在乳腺癌的发生发展过程中发挥了重要作用。有研究证实BRCA1基因启动子甲基化能够引起基因沉默,进而增加机体对铂类药物的敏感性[8]。在乳腺癌组织中p16甲基化能够引起基因沉默和蛋白表达降低[9]。有多种抑癌基因被证实在乳腺癌组织中发生不同程度的甲基化,例如GSTP1、PTEN、MGMT、RARβ2、p16INK4A和CCND2等[10-13]。Goebel等[14]采用甲基化和未甲基化的CpG处理人类乳腺癌细胞系BT-20和Hs578T,然后筛选差异表达基因,发现CHAC1mRNA表达升高可能是预测乳腺癌复发风险升高的一个独立指标。以上研究说明基因甲基化在乳腺癌的发生、发展、治疗和预后评价中具有重要意义,这也是笔者研究PRDM10基因在乳腺癌中作用的理论基础。DNA甲基化可引起基因组中相应区域染色质结构变化,染色质高度螺旋化,凝缩成团,失去转录活性[15]。基因组中60%~90%的CpG都被甲基化,未甲基化的CpG成簇地组成CpG岛,位于结构基因启动子的核心序列和转录起始点。有研究表明,肿瘤抑制基因BRCA1的启动子区域的CpG岛被过度甲基化时,可以导致抑癌基因的转录沉默,进而影响BRCA1参与散发性乳腺癌的发生发展过程[16]。上述研究初步探讨了基因甲基化和去甲基化在癌症中的作用机制,为笔者通过去甲基化处理PRDM10基因进而研究去甲基化试剂对乳腺癌增殖影响的相关机制提供了参考。去甲基化试剂5-Aza-CdR通过与DNA甲基转移酶结合,降低DNA活性,使不同的抑癌基因得以开放,进而抑制肿瘤的发展[17]。本研究用不同浓度的5-Aza-CdR处理乳腺癌细胞Hs578T,进而研究5-Aza-CdR对Hs578T的增殖以及PRDM10基因甲基化的影响。
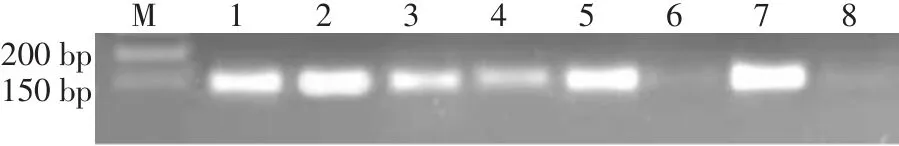
Fig.1 The methylation levels of PRDM10 gene in Hs578T before and after treated with different concentrations of 5-Aza-CdR图1 不同浓度5-Aza-CdR处理前后Hs578T中PRDM10基因甲基化水平
Tab.2 Comparsion of the methylation levels of PRDM10 before and after treatment with different concentrations of 5-Aza-CdR表2 不同浓度5-Aza-CdR处理细胞前后PRDM10的甲基化水平比较 (n=5,±s)
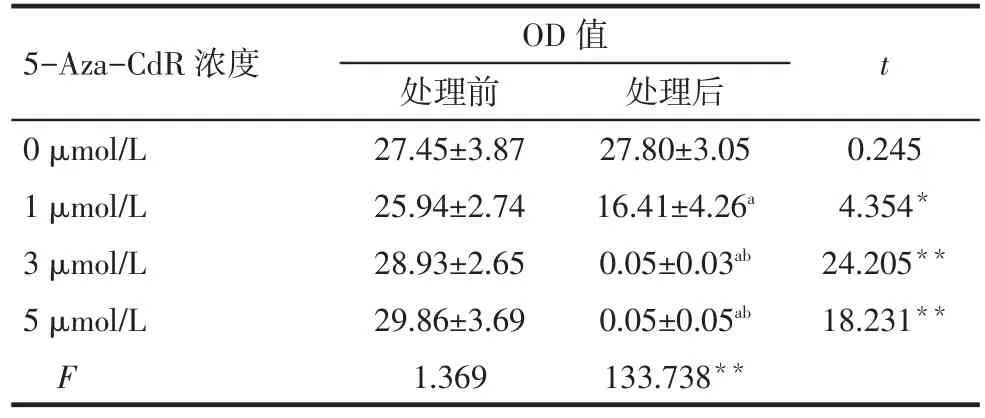
Tab.2 Comparsion of the methylation levels of PRDM10 before and after treatment with different concentrations of 5-Aza-CdR表2 不同浓度5-Aza-CdR处理细胞前后PRDM10的甲基化水平比较 (n=5,±s)
*P<0.05,**P<0.01;a与 0 µmol/L 比较,b与 1 µmol/L 比较,P<0.05
5-Aza-CdR浓度0µmol/L 1µmol/L 3µmol/L 5µmol/L F OD值处理前27.45±3.87 25.94±2.74 28.93±2.65 29.86±3.69 1.369处理后27.80±3.05 16.41±4.26a 0.05±0.03ab 0.05±0.05ab 133.738**t 0.245 4.354*24.205**18.231**

Tab.3 Comparsion of the mRNA and protein levels of PRDM10 after treatment with different concentrations of 5-Aza-CdR表3 不同浓度5-Aza-CdR处理细胞后PRDM10的mRNA和蛋白表达水平比较 (n=5)
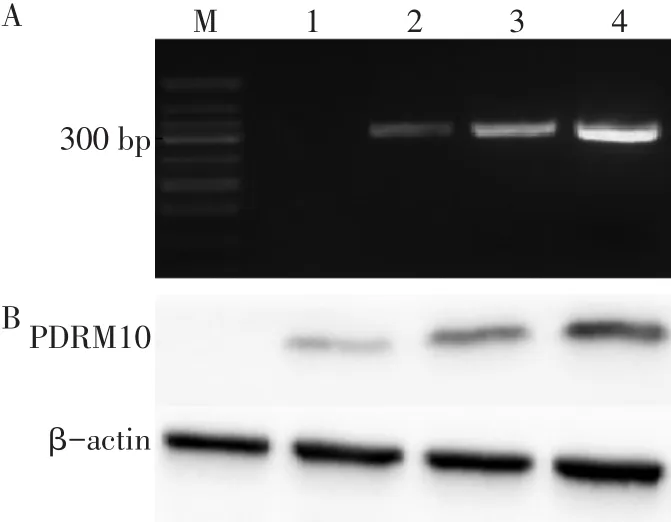
Fig.2 The mRNA and protein levels of PRDM10 gene in Hs578 after treatment with different concentrations of 5-Aza-CdR图2 不同浓度5-Aza-CdR处理72 h后PRDM10 mRNA和蛋白的表达水平
PRDM10是PRDM家族的一员,在关节滑膜组织中表达,与关节病的发病有关,可作为炎性关节炎和类风湿性关节炎的标志物[18]。多形性未分化肉瘤中反复出现PRDM10基因融合,对其临床分型具有重要作用[19]。目前尚少见PRDM10基因在其他乳腺癌细胞和乳腺组织中表达的报道。笔者前期研究发现,PRDM10的甲基化状态与乳腺癌细胞增殖功能密切相关[20],笔者进一步研究了去甲基化试剂对乳腺癌细胞增殖功能以及PRDM10的甲基化状态影响,发现PRDM10基因在乳腺癌细胞Hs578T中不表达,这可能是相关研究较少的原因之一。本研究通过甲基化水平的检测发现,PRDM10基因在Hs578T中处于完全甲基化,并且3µmol/L的5-Aza-CdR能够使PRDM10基因甲基化状态完全逆转。MTT实验结果显示,去甲基化试剂5-Aza-CdR能够明显地抑制Hs578T细胞的生长,提示去甲基化药物具有临床开发潜力。此外,MTT实验还显示,5-Aza-CdR的浓度越高、处理时间越长,对Hs578T细胞增殖的作用越显著。但是如果浓度过低或者处理时间不够长这种抑制作用不显著。
综上所述,5-Aza-CdR抑制人乳腺癌细胞Hs578T的增殖,可能与该细胞中PRDM10基因的去甲基化有关。
[1]Fotedar V,Seam RK,Gupta MK,et al.Knowledge of risk factors and early detection methods and practices towards breast cancer among nurses in Indira Gandhi Medical College,Shimla,Himachal Pradesh,India[J].Asian Pac J Cancer Prev,2013,14(1):117-120.doi:10.7314/APJCP.2013.14.1.117.
[2]Pathmanathan N,Bilous AM.HER2 testing in breast cancer:an overview of current techniques and recent developments[J].Pathology,2012,44 (7) :587-595.doi:10.1097/PAT.0b013e328359cf9a.
[3]孙轩,殷实,曹旭晨.腋窝逆行淋巴示踪术预防乳腺癌相关水肿的临床可行性分析[J].天津医药,2017,45(1):64-68.Sun X,Yin S,Cao XC.Clinical feasibility of axillary reverse mapping for preventing breast cancer related lymphedema[J].Tianjin Med J,2017,45(1):64-68.doi:10.11958/20161457.
[4]Hulka BS,Moorman PG.Breast cancer:hormones and other risk factors[J].Maturitas,2001,38(1):103-116.doi:10.1016/S0378-5122(00)00196-1.
[5]Park A.Breast-cancer basics.Diagnosis and treatment keep changing.Here’s what you need to know now[J].Time,2007,170(16):46-47.
[6]Wu H,Min J,Lunin VV,et al.Structural biology of human H3K9 methyltransferases[J].PLoS One,2010,5(1):e8570.doi:10.1371/journal.pone.0008570.
[7]Fumasoni I,Meani N,Rambaldi D,et al.Family expansion and gene rearrangements contributed to the functional specialization of PRDM genes in vertebrates[J].BMC Evol Biol,2007,7(1):187.doi:10.1186/1471-2148-7-187.
[8]Stefansson OA,Alberto V,August V,et al.BRCA1 epigenetic inactivation predicts sensitivity to platinum-based chemotherapy in breast and ovarian cancer[J].Epigenetics,2012,7(11):1225-1229.doi:10.4161/epi.22561.
[9]Lee JJ,Ko E,Cho J,et al.Methylation and immunoexpression of p16INK4a tumor suppressor gene in primary breast cancer tissue and their quantitative p16INK4a hypermethylation in plasma by real-time PCR[J].Korean J Pathol,2012,46(6):554-561.doi:10.4132/KoreanJPathol.2012.46.6.554.
[10]Baldwin RL,Nemeth E,Hang T,et al.BRCA1 promoter region hypermethylation in ovarian carcinoma:a population-based study[J].Cancer Res,2000,60(19):5329-5333.
[11]Rhodes A,Cusack RJ,Newman PJ,et al.A randomised,controlled trial of the pulmonary artery catheter in critically ill patients[J].Intensive Care Med,2002,28(3):256-264.doi:10.1007/s00134-002-1206-9.
[12]Harvey S,Harrison DA,Singer M.Assessment of the clinical effectiveness of pulmonary artery catheters in management of patients in intensive Care(PAC-Man):a randomised controlled trial[J].Lancet,2005,14(12):472-477.doi:10.1016/S0140-6736(05)67061-4.
[13]Sandham JD,Douglas R,Hull D.A randomized,controlled trial of the use of pulmonary-artery catheters in high-risk surgical patients[J].N Engl J Med,2003,348(1):5-14.doi:10.1056/NEJMoa021108.
[14]Goebel G,Berger R,Strasak AM,et al.Elevated mRNA expression of CHAC1 splicing variants is associated with poor outcome for breast and ovarian cancer patients[J].Br J Cancer,2012,106(1):189-198.doi:10.1038/bjc.2011.510.
[15]江莉,覃莉,李慕军.人类胚胎发育、精子发生与DNA甲基化关系的研究进展[J].医学综述,2013,19(2):197-199.Jiang L,Qin L,Li MJ.Advances in the relationship between human embryo development,spermatogenesis and DNA methylation[J].Medical Review,2013,19(2):197-199.doi:10.3969/j.issn.1006-2084.2013.02.002.
[16]任婕,魏敏杰,金锋,等.散发性乳腺癌组织中BRCA1基因启动子甲基化与蛋白表达的相关性[J].中华肿瘤防治杂志,2007,14(3):161-164.Ren J,Wei MJ,Jin F,et al.Correlation between methylation of BRCA1 gene promoter and protein expression in sporadic breast cancer[J].Chinese Journal of Cancer Prevention and Treatment,2007,14(3):161-164.doi:10.3969/j.issn.1673-5269.2007.03.001.
[17]Hirasawa Y,Arai M,Imazeki F,et al.Methylation status of genes upregulated by demethylating agent 5-aza-2′-deoxycytidine in hepatocellular carcinoma[J].Oncology,2006,71(1/2):77.doi:10.1159/000100475.
[18]Park JA,Kim TH,Lee B,et al.Expression of PRDM10 in arthritic synovial derived tissues[J].Genes Genom,2013,35(6):685-691.doi:10.1007/s13258-013-0119-z.
[19]Hofvander J,Tayebwa J,Nilsson J,et al.Recurrent PRDM10 Gene Fusions in Undifferentiated Pleomorphic Sarcoma[J].Clin Cancer Res,2015,21(4):864-869.doi:10.1158/1078-0432.CCR-14-2399.
[20]张晓宇,康晓宁,刘伟,等.FOS样抗原1对乳腺癌细胞MDAMB-231增殖、侵袭和PRDM10基因甲基化的影响[J].天津医药,2017,45(12):1237-1241.Zhang XY,Kang XN,Liu W,et al.Effects of FOSL1 on cell proliferation,cell invasiveness and the methylation of PRDM10 gene in breast cancer cell line MDA-MB-231[J].Tianjin Med J,2017,45(12):1237-1241.doi:10.11958/20170819.
