干扰SET8抑制血管平滑肌细胞转分化的研究
2018-04-26张东雪高少辉李同妙周薇
张东雪,高少辉,李同妙,周薇
血管钙化是导致心血管疾病(cardiovascular disease,CVD)发病率与死亡率升高的关键环节和独立危险因素[1]。血管钙化不是一个被动的过程,而是由细胞介导的高度可调的过程[2],其重要机制是血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的成骨样表型转化。赖氨酸甲基转移酶SET8是现今发现唯一能够特异性单甲基化组蛋白H4赖氨酸第 20位赖氨酸(histone H4 lysine 20,H4K20)的甲基转移酶,参与调控细胞增殖、凋亡、细胞转移与分化等[3]。SET8 还可甲基化 TWIST、Wnt、P53等非组蛋白[4],并通过调节转录过程影响相应基因的表达,进而调节细胞的转移与分化等。也有研究表明活化的Wnt信号通路可通过上调RUNX2的表达进而促进血管钙化[5]。但SET8在VSMCs转分化中的作用尚少见相关研究。为此,本研究以大鼠VSMCs为模型,观察SET8对大鼠VSMCs向成骨样细胞分化的影响。
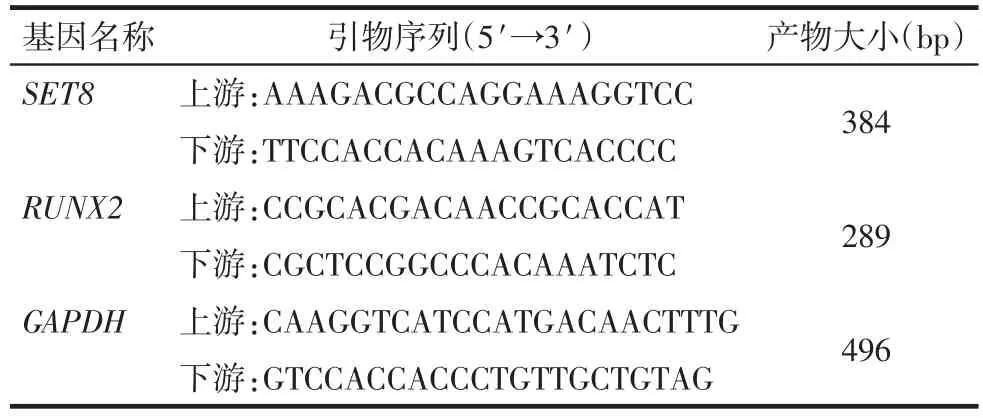
Tab.1 Primer sequence of each purpose gene表1 各目的基因引物序列
1 材料与方法
1.1 实验动物 由河北医科大学动物实验中心提供的清洁级健康雄性SD大鼠8只(合格证编号:1305090),均为4周龄,体质量 80~120 g,平均体质量(95.7±6.5)g。
1.2 实验试剂及仪器 胎牛血清(fetal bovineserum,FBS)和DMEM(dulbecco’s modified eagle’s medium)培养基由美国GIBCO公司提供,SET8-短发夹RNA(shRNA)质粒及空质粒(NS-shRNA,广州复能基因有限公司),LipofectamineTM2000(美国Invitrogen公司),BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司),碱性磷酸酶(ALP)活性试剂盒(中国Njjcbio公司),反转录聚合酶链反应(RT-PCR)试剂盒(美国Thermo公司),PCR引物(上海捷瑞生物工程有限公司),RUNX2抗体和SET8抗体(英国Abcam公司),GAPDH抗体(美国Bioworld公司)。细胞培养箱(美国Sheldon公司),RT-PCR仪(美国Abi公司),倒置相差荧光显微镜(日本OLYMPUS公司),酶标仪(美国Biotek公司),凝胶成像系统(美国Proteinsimple公司),蛋白电泳仪(美国BIO-RAD公司)。
1.3 实验模型的制备与分组 采用组织块贴壁法培养原代大鼠胸主动脉VSMCs,具体操作为:采用2%戊巴比妥钠进行麻醉,75%乙醇浸泡,于生物安全柜中分离出胸主动脉,剥除内外膜,将中膜剪成1 mm×1 mm×1 mm的小块,均匀铺满瓶底,加入2 mL含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2培养箱中培养,48 h后更换新鲜培养基。之后每隔2 d换液,细胞融合80%~90%时进行传代。细胞传代培养至第3~4代时用于细胞实验。将细胞接种于适宜孔板中,融合率达80%时给予转染干预。转染方法为:参照脂质体LipofectamineTM2000说明书进行转染,在倒置荧光显微镜下观察细胞内绿色荧光蛋白表达。实验分组为:(1)正常对照组:未转染组。(2)空质粒组:NS-shRNA质粒浓度为2µg/L、Lipo2000 为 4 µL/孔,转染 VSMCs。(3)SET8-shRNA 组:SET8-shRNA 质粒浓度为 2µg/L、Lipo2000为 4µL/孔,转染VSMCs。
1.4 RT-PCR测定VSMCs内SET8、RUNX2 mRNA的表达水平 采用RNA提取试剂提取转染后3组的mRNA并逆转录为cDNA。测定各组SET8与RUNX2的mRNA表达。实验重复3次。以各组cDNA为模板,GAPDH作为内参照。PCR引物由Primer 5.0软件设计,见表1。反应条件:GAPDH条件为95℃变性30 s,58℃退火30 s,72℃延伸40 s,循环28次,继续72℃延伸10 min。RUNX2条件为95℃变性 30 s,55℃退火 40 s,72℃延伸 40 s,循环 30次,继续72℃延伸10 min。SET8条件为95℃变性30 s,50℃退火40 s,72℃延伸40 s,循环38次,继续72℃延伸10 min。产物经质量浓度为2%的琼脂糖凝胶电泳后,采集图像进行分析。
1.5 蛋白免疫印迹(Western blot)法检测VSMCs内SET8、RUNX2蛋白的表达 采用蛋白提取试剂提取转染后3组的细胞总蛋白。应用BCA法测定蛋白浓度,煮沸变性后按每
孔总蛋白50µg加样,采用10%SDS-聚丙烯酰胺凝胶电泳进行分离,电泳条件为95 V电泳1.5 h。之后用干转仪进行转膜,转膜时间为0.5 h。后放入5%的脱脂奶粉中于37℃恒温箱中封闭2 h。一抗4℃孵育过夜,一抗稀释比例分别为(GAPDH 1∶10 000,RUNX2 1∶500,SET8 1∶500)。次日洗膜,放入鼠二抗中(二抗稀释比例为1∶10 000),室温摇床孵育1 h,ECL显色并应用凝胶成像系统采集图像进行分析。实验重复3次。
1.6 ALP活性测定 细胞转染干预7 d后弃上清液,用PBS缓冲液洗2次,加适量质量浓度1%的TritonX⁃100溶液,4℃冰箱静置24 h,反复吹打细胞使其充分裂解,离心后弃沉淀物取上清液,按照ALP活性试剂盒说明书进行操作,应用酶联免疫吸附法于酶标仪520 nm波长处测定ALP的吸光度值,同时提取胞质蛋白,应用BCA法测定蛋白质的含量,用以校正ALP的活性(U/mg)。实验均重复3次。
1.7 统计学方法 采用SPSS 22.0软件进行统计学处理。正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 SET8-shRNA对VSMCs SET8 mRNA和蛋白表达的影响 SET8-shRNA转染VSMCs 48 h后,荧光显微镜下观察转染效率为50%。RT-PCR和Western blot结果显示,SET8-shRNA组VSMCs细胞中SET8 mRNA和蛋白的表达水平均低于正常对照组和空质粒组(均P<0.05),正常对照组与空质粒组比较差异无统计学意义,见图1。
2.2 SET8-shRNA对VSMCs RUNX2 mRNA和蛋白表达的影响 RT-PCR和Western blot结果显示,SET8-shRNA组RUNX2 mRNA和蛋白的相对表达量均低于正常对照组和空质粒组(均P<0.05),正常对照组与空质粒组比较差异无统计学意义,见图2。
2.3 SET8-shRNA对VSMCs ALP活性的影响 与正常对照组和空质粒组比较,SET8-shRNA组ALP活性显著降低(均P<0.05),正常对照组与空质粒组比较差异无统计学意义,见图3。
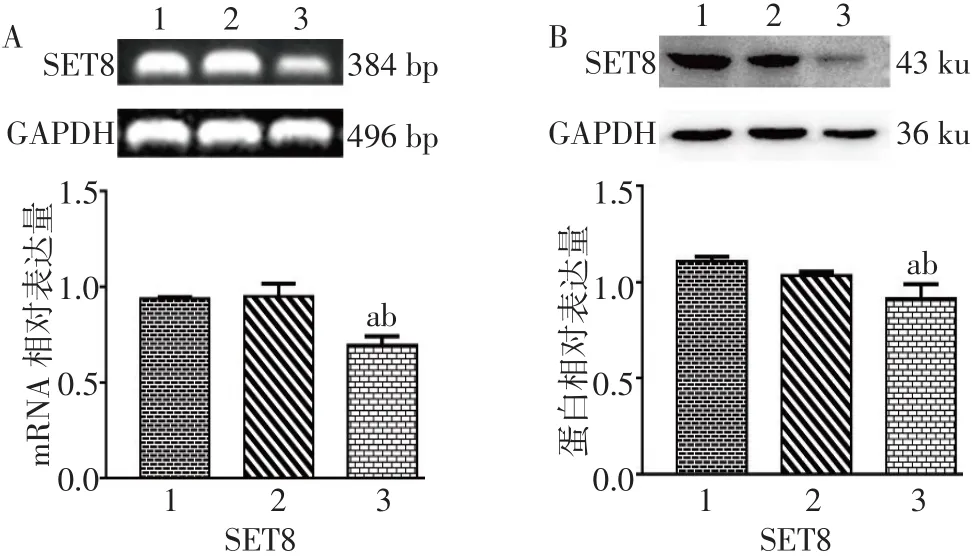
Fig.1 The influence of SET8-shRNA on VSMCs of SET8 expression图1 SET8-shRNA对VSMCs SET8表达的影响
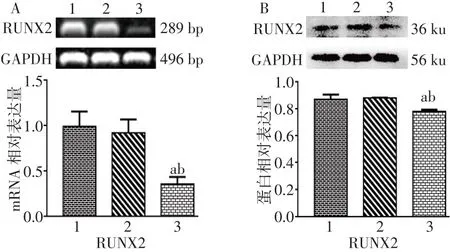
Fig.2 The influence of SET8-shRNA of RUNX2expression on the VSMCs图2SET8-shRNA对VSMCs RUNX2表达的影响
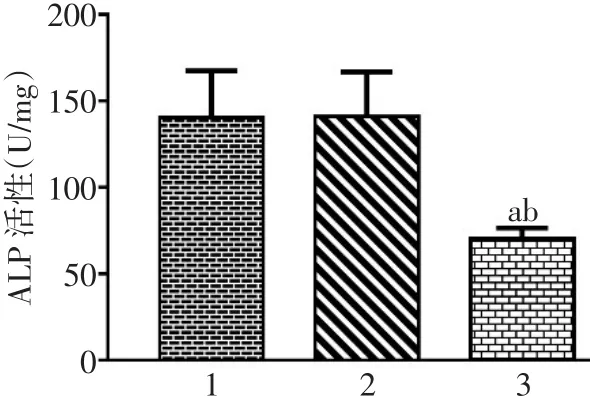
Fig.3 The changes of alkaline phosphatase activity in VSMCs图3 VSMCs各组ALP活性的变化
3 讨论
血管钙化在心血管疾病患者中普遍存在,主要表现在中膜钙化,且与心血管事件的发生密切相关,而VSMCs是血管中膜的主要组成成分,是血管中膜发生钙化的结构基础[6-7]。VSMCs向成骨样转化是血管钙化的重要机制之一[8]。Quarles[2]研究发现,中膜钙化是一个主动的、受细胞和基因调控的、似成骨形成的过程,其特性为成骨样分化。因此,抑制VSMCs的转分化是减少血管钙化的关键。SET8在肿瘤中发现具有促进上皮细胞间充质转分化的作用[9]。鉴于此,本研究通过干扰大鼠VSMCs SET8的基因表达,发现SET8可明显抑制大鼠VSMCs RUNX2 mRNA和蛋白的表达,提示SET8可能参与了大鼠VSMCs向成骨样细胞转分化的过程。
Linscott等[10]研究发现 SET8 能够特异性单甲基化组蛋白H4K20,能招募特异的调节蛋白,在细胞内具有调控组蛋白修饰、调节染色质结构和基因转录、调控细胞周期等作用,其主要参与细胞增殖、细胞转移分化等多种细胞生理功能。RUNX2是转录因子runt家族成员之一,是调控间充质干细胞向成骨、软骨转化所必需的核心转录因子,在细胞的表型转化中发挥重要作用[11]。有研究表明SET8作为共刺激因子参与了Wnt调控靶蛋白RUNX2表达的作用,进而调节VSMCs的表型转化[12-14]。为了证实SET8是否与VSMCs的表型转化直接相关,本研究通过对 VSMCs进行转染空质粒(NS-shRNA)和SET8-shRNA质粒,结果显示正常对照组与空质粒组比较RUNX2表达水平无明显变化,说明VSMCs转染质粒对RUNX2表达无明显影响。而SET8-shRNA组RUNX2表达水平均显著低于正常对照组和空质粒组,提示干扰SET8基因表达可抑制VSMCs向成骨、成软骨细胞表型转化。ALP活性与成骨细胞的活性及成骨作用有关,也是VSMCs表型转化的早期指标[15]。本研究结果显示,与正常对照组和空质粒组比较,SET8-shRNA组ALP活性显著降低,正常对照组与空质粒组无明显差异,进一步提示干扰SET8基因表达可抑制VSMCs向成骨、成软骨细胞表型转化。
综上所述,SET8-shRNA可有效抑制VSMCs中SET8的表达。干扰SET8基因表达可有效降低大鼠VSMCs RUNX2表达水平以及ALP活性,进而抑制其表型转化。本研究仅在细胞实验中发现了干扰SET8可抑制VSMCs向成骨、成软骨细胞表型转化的现象,其影响VSMCs表型转化的具体机制仍需进一步研究验证。
[1]Lanzer P,Boehm M,Sorribas V,et al.Medial vascular calcification revisited:review and perspectives[J].Eur Heart J,2014,35(23):1515-1525.doi:10.1093/eurheartj/ehu163.
[2]Quarles LD.Reducing cardiovascular mortality in chronic kidney disease:something borrowed,something new[J].J Clin Invest,2013,123(2):542-543.doi:10.1172/JCI67203.
[3]徐金升,王静,张俊霞,等.赖氨酸甲基转移酶SET8基因沉默通过Wnt信号通路抑制肾透明细胞癌786-O细胞增殖转移[J].中华实验外科杂志,2016,33(6):1684-1685.Xu JS,Wang J,Zhang JX,et al.Lysine methyltransferase SET8 silencing inhibits cell growth and migration of renal cell carcinoma through Wnt signaling pathway[J].Chin J Exp Surg,2016,33(6):1684-1685.doi:10.3760/cma.j.issn.1001-9030.2016.06.082.
[4]刘奔,张熙凝,陈可欣.组蛋白赖氨酸甲基转移酶SET8对蛋白的甲基化修饰及与肿瘤相关性的研究进展[J].中国肿瘤临床,2015,42(15):765-769.Liu B,Zhang XN,Chen KX.Research progress on histone lysine methyltransferase SET8 in methylation modification and association with tumor[J].Chin J Clin Oncol,2015,42(15):765-769.doi:10.3969/j.issn.1000-8179.20150553.
[5]Herencia C,Rodriguez-Ortiz ME,Muñoz-Castañeda JR,et al.AngiotensinⅡprevents calcification in vascular smooth muscle cells by enhancing magnesium influx[J].Eur J Clin Invest,2015,45(11):1129-1144.doi:10.1111/eci.12517.
[6]Bai Y,Zhang J,Xu J,et al.Alteration of type I collagen in theradial artery of patients with end-stage renal disease[J].Am J Med Sci, 2015, 349 (4) : 292-297.doi: 10.1097/MAJ.0000000000000408.
[7]Nitta K,Ogawa T.Vascular calcification in end-stage renal disease patients[J].Contrib Nephro,2015,185:156-167.doi:10.1159/000380980.
[8]Moe OW,Kuro OM.Fibroblast growth factor 23 and uremic vascular calcification:is it time to escalate from biomarker status to pathogenic agent[J].Kidney Int,2014,85(5):1022-1023.doi:10.1038/ki.2013.471.
[9]Yang F,Sun L,Li Q,et al.SET8 promotes epithelial-mesenchymal transition and confers TWIST dual transcriptional activities[J].EMBO J,2012,31(1):110-123.doi:10.1038/emboj.2011.364.
[10]Linscott J,Kapilashrami K,Wang Z,et al.Kinetic isotope effects reveal early transition state of protein lysine methyltransferase SET8[J].Proc Natl Acad Sci U S A,2016,113(52):E8369-E8378.doi:10.1073/pnas.1609032114.
[11]Zhou Y,Wang JY,Fang H,et al.Overexpression of clq/tumor necrosis factor-related protein-3 promotes phosphate-induced vascular smooth muscle cell ealcifieation bothin vivoandin vitro[J].Arterioscler Thromb Vasc Biol,2014,34(5):1002-1010.
[12]徐金升,王静,张俊霞,等.SET8在肾透明细胞癌中的表达及其对786-0细胞增殖迁移能力的影响[J].中华泌尿外科杂志,2016,37(11):860-865.Xu JS,Wang J,Zhang JX,et al.Expression of SET in renal cell carcinoma and the effects of SET8 silencing on proliferation and migration of 786-0 cells[J].Chin J Urol,2016,37(11):860-865.doi:10.3760/cma.j.issn.1000-6702.2016.11.018.
[13]Hou L,Li Q,Yu Y,et al.SET8 induces epithelial-mesenchymal transition and enhances prostate cancercellmetastasis by cooperating with ZEB1[J].Mol Med Rep,2016,13(2):1681-1688.doi:10.3892/mmr.2015.4733.
[14]Chen T,Mao H,Chen C,et al.The role and mechanism of α-Klotho in the calcification of rat aortic vascular smooth muscle cells[J].Biomed Res Int,2015,2015:194362.doi:10.1155/2015/194362.
[15]Lee GH,Kim HR,Chae HJ.BI⁃1 enhances Fas⁃induced cell death through a Na+/H+ ⁃associated mechanism[J].BMB Rep,2014,47(7):393⁃398.doi:10.5483/BMBRep.2014.47.7.194.
