滤泡辅助性T细胞与特发性视神经炎和视神经脊髓炎谱系疾病关系的研究
2018-04-26吴茜杨彬彬王佳伟
吴茜 杨彬彬 王佳伟
特发性视神经炎(optic neuritis,ON)是青壮年人最易罹患的致盲性视神经疾病,与免疫介导的炎性脱髓鞘有关。视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disordes,NMOSD)是以视神经、脊髓及延髓极后区等受累为主要表现的中枢神经系统炎性脱髓鞘疾病,是中青年人群中非外伤性致残的主要疾病。2004年Lennon等[1]在视神经脊髓炎(NMO)患者血清中发现了一种特异性抗体,并证实该抗体的靶抗原为位于星形胶质细胞足突上的水通道蛋白-4(aquaporin-4,AQP4),此发现确定了NMO是不同于多发性硬化(MS)的独立疾病。NMO患者约70%血中可检测到AQP4抗体,提示NMO是一种B细胞免疫为主的抗体介导的免疫性疾病。但仍有部分NMOSD患者AQP4抗体阴性,其与抗体阳性患者在临床表现和预后不同,提示可能两者存在不同的免疫机制。
滤泡辅助性T细胞(T follicular helper,Tfh)是辅助性T细胞(Th,其标志为CD4+)的特殊亚型,负责辅助B细胞迁移、增殖、分化为浆细胞并产生高亲和力抗体的T细胞,Tfh主要功能是激活B淋巴细胞,刺激其产生抗体,诱导体液免疫反应。研究表明,CD4和趋化因子受体5(CXCR5)双阳性(CD4+CXCR5+)T细胞,CD4、CXCR5和程序性死亡因子-1(PD-1)三阳性(CD4+CXCR5+-PD-1+)T细胞在自身免疫性疾病患者的血液中表达增高与抗体的产生相关,因此, CD4+CXCR5+、CD4+CXCR5+PD-1+T细胞被认为是Tfh细胞最常用的标志物[2],因此本研究通过测定CD4+CXCR5+、CD4+CXCR5+PD-1+T细胞对Tfh细胞进行研究。
现有研究认为Tfh与体液免疫反应有关,但Tfh是否参与了ON和NMOSD的体液免疫机制尚不十分清楚,迄今尚未见对比研究特发性ON和NMOSD患者外周血和脑脊液Tfh的表达变化的报道。本文对比研究了ON和NMOSD的Tfh变化,以探讨Tfh是否参与了ON和NMOSD的体液免疫过程及其临床意义。
1 对象和方法
1.1观察对象选择2015-03—2017-05在作者科室住院的急性ON患者41例,其中男20例、女21例,年龄14~63岁,平均年龄(39.07±14.32)岁,病程0.13~156个月,病程中位数0.7个月上、下四分位数分别为0.32、6.0,个月。在作者科室住院的NMOSD急性期患者55例,其中男9例、女46例,年龄18~73岁,平均年龄(40.51±14.45)岁,病程0.23~180个月,病程中位数0.7个月,上、下四分位数分别为0.7、36个月。ON的诊断符合下列标准:急性发病的单眼或双眼ON,无其他中枢神经系统病变,血清AQP4抗体阴性,不符合NMOSD和MS的诊断,除外系统性免疫疾病、感染及其他原因的视神经病变。NMOSD的诊断依据国际视神经脊髓炎诊断小组(IPND)2015年初颁布的NMOSD诊断标准[3],并排除MS、播散性脑脊髓炎及其他疾病。所有患者在入院前1个月内未使用糖皮质激素和免疫抑制剂。另选健康志愿者26名作为健康对照组,其中包括作者科室的医护人员、研究生和作者医院的健康查体者,男10名、女16名,年龄16~75岁,平均年龄(36.77±14.86)岁,入选时身体健康、无发热、无感染(查体化验血常规及其感染指标正常),既往无免疫性疾病病史。健康对照组年龄与两患者组差异无统计学意义。
本研究项目经院伦理委员会批准通过。
1.2方法入院后NMOSD组和ON组患者均经甲基泼尼龙冲击治疗(静脉滴注1000 mg×3 d,500 mg×3 d,序贯减量至口服维持量)。所有患者均行脑和脊髓MRI检查,详细记录病史和临床表现。
1.2.1神经功能评分:在入院和出院时分别进行扩展的神经功能障碍评分(expended disability status scale, EDSS)[4],因本研究患者以视神经病变为主,单用EDSS可能有偏倚,同时进行视觉功能评分(visual outcome scale,VOS)[5]。
1.2.2Tfh细胞和 AQP4抗体检测:入院急性期患者均在应用甲基泼尼松龙治疗前抽血2 mL,分别加入EDTA抗凝管和未抗凝血管,每管1 mL,用ELISA法检测AQP4抗体,采用流式细胞术检测Tfh。对17例患者(ON组8例、NMOSD组9例)行腰穿查脑脊液,用流式细胞术测定脑脊液中Tfh。
ELISA试剂盒购自英国阿尔斯公司,用酶标仪(Thermo Fisher Scientific)检测,严格按照说明书操作,以说明书规定的≥3 u/mL为抗体阳性。流式细胞术检测血Tfh:(1)Tfh细胞及其同型对照管:Tfh细胞管中加入5 μL Anti-human CD4 PE-Vio770、5 μL Anti-human CXCR5-FITC、5 μL Anti-Human PD-1-PE;同型对照管中加入5 μL Anti-human CD4 PE-Vio770、5 μL REA Contorl-FITC、5 μL Mouse IgG2b-PE(试剂购于德国美天旎生物公司,Miltenyi Biotec)。(2)各管均加入100 μL的抗凝血,充分混匀,室温避光孵育15 min;(3)各管均加入溶血素工作液1 mL,涡旋振荡器上充分混匀,避光静置10 min,至试管内液体变透亮;(4)各管1500 r/min离心5 min,弃上清液;(5)各管均加入PBS溶液 1 mL洗涤,涡旋振荡器上充分混匀,1500 r/min离心5 min,弃去上清;(6)各管均加入300 μL PBS溶液,重悬细胞,通过流式细胞仪(美国BD 公司,Becton Dicknson and Company)进行检测分析。流式细胞术检测脑脊液Tfh:(1)抗体试剂同型对照同血Tfh检测,取脑脊液2 mL,1500 r/m离心5 min;(2)弃上清液,剩余底部细胞加入10%小牛血清孵育15 min;(3)加入溶血素工作液500 μL,涡旋振荡器上充分混匀,避光静置5 min;(4)各管1500 r/m离心5 min,弃上清液;(5)各管均加入PBS溶液 1 mL洗涤,涡旋振荡器上充分混匀,1500 r/min离心5 min,弃去上清;(6)各管均加入300 μL PBS溶液,重悬细胞,上流式细胞仪进行检测分析。
本研究中,比较Tfh细胞在两种疾病的表达变化情况,以CD4+细胞设门,流式细胞仪自动检测血和脑脊液中CD4+CXCR5+T细胞数和CD4+-CXCR5+PD-1+T细胞数分别占CD4+T细胞数的百分比(以下简称“比例”),即CD4+CXCR5+T细胞数或CD4+CXCR5+PD-1+T细胞数÷CD4+T细胞数×100%。上述比例高代表Tfh细胞数高。
比较ON组和NMOSD组性别比例、病程、年复发率、CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例和AQP4抗体水平,两组患者甲基泼尼松龙治疗前后EDSS和VOS功能评分,以及患者组与健康对照组CD4+CXCR5+和CD4+CXCR5+-PD-1+T细胞比例;并分析患者血和脑脊液CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例的相关性,分析两患者组Tfh表达与病程、年复发率、EDSS及VOS评分的相关性,患者AQP4抗体水平与CD4+CXCR5+、CD4+CXCR5+PD-1+T细胞比例、病程和EDSS评分的相关性。
1.3统计学处理采用SPSS 19.0软件进行分析。在描述病程时采用中位数及范围表示,因统计分析时应与其他指标一致,在结果中和其他数据一样采用均数±标准差表示。三组间及两组间比较采用单因素方差分析,组间两两比较采用单因素方差分析Scheffe检验法;两组患者甲基泼尼松龙治疗前后EDSS及VOS评分的自身比较采用配对t检验;两组数据相关分析,如血Tfh表达和脑脊液Tfh表达相关分析、AQP4抗体水平与Tfh表达相关分析等采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1各组外周血Tfh比例具体结果见表1。ON组和NMOSD组外周血CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例均高于健康对照组(均P<0.01),ON组和NMOSD组比较差异无统计学意义(均P>0.05)。
2.2ON组和NMOSD组CD4+CXCR5+、CD4+CXCR5+PD-1+T细胞比例、AQP4抗体及临床相关因素比较NMOSD组血清AQP4抗体水平和EDSS评分均显著高于ON组,病程长于ON组,两组患者外周血和脑脊液CD4+CXCR5+T细胞、CD4+CXCR5+PD-1+T细胞比例、年均复发次数和VOS评分比较差异均无统计学意义(均P>0.05,表2、3)。NMOSD组和组患者甲基泼尼松龙治疗后EDSS和VOS评分均显著低于治疗前评分(均P<0.01,表3)。
2.3两组组患者相关临床指标的相关分析
2.3.1ON组Tfh表达及相关临床指标的相关分析:ON组外周血及脑脊液中CD4+CXCR5+与CD4+CXCR5+PD-1+T细胞两种不同细胞比例均呈正相关(分别r=0.822、P=0.000,r=0.714、P=0.047);脑脊液CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例分别与外周血中同种细胞比例无相关性(分别r=0.321、P=0.482,r=0.571、P=0.180)。
患者EDSS评分与VOS评分呈显著正相关(r=0.614,P=0.000)。外周血和脑脊液CD4+CXCR5+及CD4+CXCR5+PD-1+T细胞比例与EDSS评分、VOS评分均无相关性(表4)。
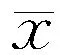
表1 各组外周血CD4+CXCR5+、CD4+-CXCR5+PD-1+ T细胞比例比较 (±s,%)
注:ON为视神经炎,NMOSD为视神经脊髓炎谱系疾病,表2、3同;与健康对照组比较,*P<0.01
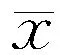
表2 ON组和NMOSD组CD4+-CXCR5+和CD4+-CXCR5+-PD-1+T细胞比例及临床相关指标比较(±s)
注:AQP4抗体≥3 u/mL为阳性
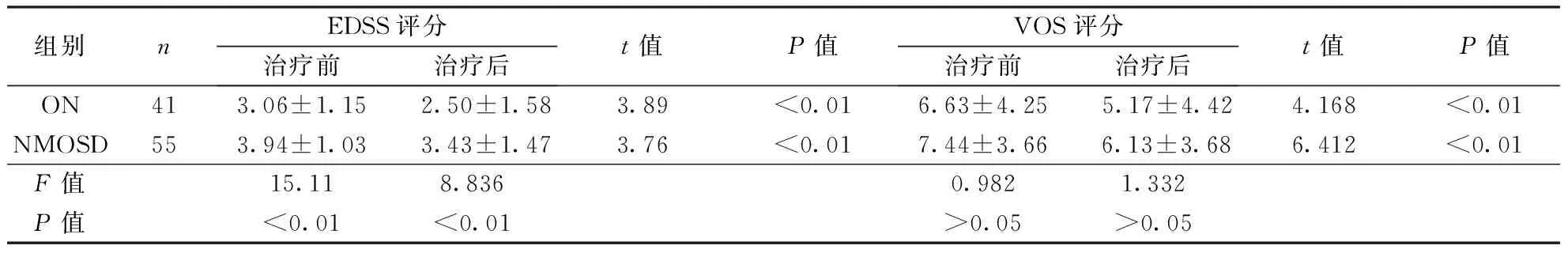
表3 ON组和NMOSD组甲基泼尼松龙治疗前后功能评分比较
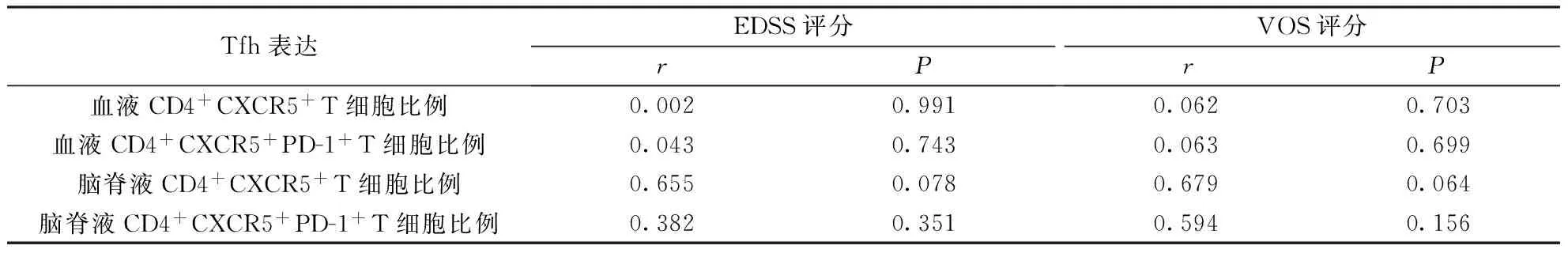
表4 ON患者外周血和脑脊液Tfh表达与EDSS评分、VOS评分的相关性
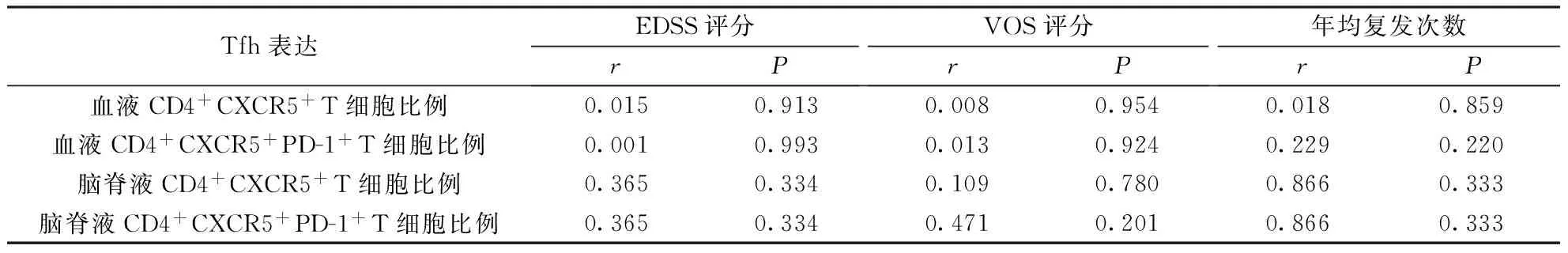
表5 NMOSD患者外周血和脑脊液Tfh表达与各临床指标的相关性
2.3.2NMOSD组 Tfh表达及相关临床指标的相关分析:外周血及脑脊液中CD4+CXCR5+与CD4+CXCR5+PD-1+T细胞两种不同细胞比例均呈正相关(分别r=0.826、P=0.000,r=0.917、P=0.001);脑脊液CD4+CXCR5+T细胞比例与外周血中该细胞比例呈正相关(r=0.717、P=0.030),脑脊液CD4+CXCR5+PD-1+T细胞比例与外周血中该细胞比例无相关性(r=0.583、P=0.099)。
患者EDSS评分与VOS评分呈显著正相关(r=0.327,P=0.016)。NMOSD患者血清AQP4抗体水平与病程和EDSS评分均显著正相关(r=0.418、P=0.000,r=0.351、P=0.001)。患者外周血和脑脊液CD4+CXCR5+PD-1+T细胞与血CD4+CXCR5+PD-1+T细胞比例与EDSS评分、VOS评分、年均复发次数均无相关性(表5)。
3 讨论
本研究表明 ON组外周血CD4+CXCR5+PD-1+T细胞与血CD4+CXCR5+PD-1+T细胞比例均显著高于健康对照组,由于CD4+CXCR5+PD-1+T细胞和CD4+CXCR5+PD-1+T细胞是Tfh的主要生物标志,提示Tfh可能参与了特发性ON的体液免疫过程。本研究发现特发性ON患者外周血CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例较健康人增高,Tfh的主要功能为激活B淋巴细胞,刺激其产生抗体,诱导体液免疫反应[6],故提示ON患者Tfh异常增高可能与其发病有关,Tfh可能是特发性ON潜在的体液免疫指标。此外,测定ON患者血CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例,可能对鉴别免疫介导的特发性ON与其他病因的ON有一定临床参考意义。
近年来研究表明,Tfh激活参与了一些自身免疫性疾病的免疫病理过程,有报道MS患者外周血诱导性共刺激因子阳性(ICOS+)Tfh 和CD4+CXCR5+T 细胞比例较健康对照显著增高,MS患者外周血 CXCR3+Th1-like T细胞比例减少,而CCR6+Th17-like Tfh比例增高[7]。有报道重症肌无力患者外周血Tfh表达增高,并与MG评分相关[8]。迄今, NMO患者外周血Tfh表达增高的报道较为罕见,有报道NMO患者外周血CD4+CXCR5+PD-1+T细胞比例较MS和健康对照组增高,提示Tfh细胞增多与NMO有关[9]。
本研究表明NMOSD患者外周血CD4+CXCR5+和CD4+CXCR5+PD-1+T细胞比例较健康对照组增高,并且NMOSD脑脊液CD4+CXCR5+T细胞比例与外周血中该细胞比例呈显著正相关,提示NMOSD患者存在Tfh参与的体液免疫功能异常,推测患者外周血Tfh激活,可能透过患者的血脑屏障进入中枢神经系统,激活B淋巴细胞产生抗体,攻击视神经和脑脊髓等中枢神经组织,参与NMOSD患者的体液免疫过程,Tfh还可能是NMOSD的潜在的体液免疫标志物。
研究表明,AQP4抗体依赖性细胞介导的细胞毒性(antibody-dependent cellmediated cytotoxicity,ADCC)和AQP4抗体介导的补体依赖性细胞毒性(CDC)作用,在NMOSD病变产生中起重要作用[10]。本研究NMOSD患者组血清AQP4抗体水平与病程和EDSS评分呈显著正相关,进一步证实AQP4抗体在NMOSD发病中的作用,AQP4抗体对患者的病情和预后判断可能有一定参考意义,对NMOSD患者的免疫抑制治疗有一定指导作用。本研究中Tfh细胞与AQP4抗体无相关性,ON和NMOSD患者Tfh与抗体的关系可能尚需进一步研究。
本研究未发现Tfh表达在ON和NMOSD患者中存在统计学差异。本组特发性NO的诊断较严格,排除了其他原因引起的急性视神经病,亦不符合NMOSD和MS的诊断标准,患者血AQP4抗体均阴性,并且年平均复发次数不少于NMOSD患者,外周血和脑脊液Tfh表达均显著增高,提示Tfh不仅参与了NMOSD的体液免疫过程,亦在ON的体液免疫机制中发挥作用,因此不能依据Tfh的变化鉴别ON和NMOSD。
本研究显示经甲基泼尼松龙冲击及序贯治疗后,ON组和NMOSD组EDSS和VOS评分均显著降低,表明甲基泼尼松龙冲击及序贯治疗不仅是急性期NMOSD的经典疗法,也是急性期ON治疗的有效方法。
综上可见,本研究显示两组患者外周血和脑脊液Tfh表达与EDSS评分、VOS评分、年均复发次数均无相关性,Tfh表达与ON和NMOSD的病情及复发关系尚不能明确。因此Tfh变化情况可能不能作为判断这两种疾病患者病情和预后的指标,Tfh在这两组疾病体液免疫中的具体作用以及与相应抗体的产生是否有关尚需进一步研究。
参考文献:
[1]Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica:distinction from multiple sclerosis[J]. Lancet, 2004, 364(9451):2106-2112.
[2] Crotty S. T follicular helper cell differentiation, function, and roles in disease [J]. Immunity, 2014, 41(4), 529-542.
[3] Wingerchuk DM, Banwell B, Bennett JL, et al. international consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology,2015, 85(2):177-189.
[4] Kurtzke JF. Rating neurology impairment in multiple sclerosis:an expanded disability status scale (EDSS)[J]. Neuology, 1983,33(11):1444-1452.
[5] Wingerchuk DM, Hogancamp WF, O’Brien PC, et al. The clinical course of neuromyelitis optica (Devic’s syndrome). [J].Neurology, 1999, 53(5):1107-1114.
[6]Breitfeld D, Ohl L, Kremmer, E, et al. Follicular B helper T cells express CXC chemokine receptor 5, localize to B cell follicles, and support immunoglobulin production[J]. J Exp Med, 2000,192(11): 1545-1552.
[7]Christensen JR, Börnsen L, Ratzer R, et al.Systemic inflammation in progressive multiple sclerosis involves follicular T-helper, Th17- and activated B-cells and correlates with progression[J]. PLoS One, 2013,8(3):e57820.
[8]Luo C, Li Y, Liu W, et al. Expansion of circulating counterparts of follicular helper T cells in patients with myasthenia gravis[J]. J Neuroimmunol, 2013, 256(1-2):55-61.
[9]Li YJ, Zhang F,Qi Y, et al. Associationof circulating follicular helper T cells with disease course of NMO spectrum disorders[J]. J Neuroimmunol, 2015,278:239-246.
[10]Ma CS, Deenick EK. Human T follicular helper (Tfh) cells and disease[J]. Immunol Cell Biol, 2014, 92(1):64-71.
