盐胁迫下产多胺细菌ccx5对大豆萌发及幼苗生长的影响
2018-04-25辛树权李文君时东方
辛树权,李文君,时东方
(1.长春师范大学生命科学学院,吉林长春130032;2.吉林出入境检验检疫局,吉林长春 130062)
全球范围约有9.32亿公顷土地遭受盐化和碱化[1-2],盐渍土壤生产的农作物产量和品质也会有所下降[3],如何改良土壤结构提高农作物的抗盐性成为当前重要的研究课题,而微生物改良土壤技术是其中之一。植物促生菌是一类益生菌类,它可以促进植物对矿质养分的吸收和利用,抵抗不良环境对植物的伤害,抑制有害微生物生长繁殖,促进植物生长发育[4]。产多胺细菌是植物促生菌的一种,它通过代谢产生外源多胺对植物生长产生影响[5]。多胺是一类低分子脂肪含氮碱并能调节植物生长的一种调节剂。多胺包括腐胺(Put)、亚精胺(Spd)、精胺(Spm)和尸胺(Cadaverine)等[6]。对植物中多胺含量的研究发现,环境胁迫可诱导植物体内大量多胺的积累,在稳定细胞膜、核酸及蛋白质等大分子物质构象、清除活性氧、调节细胞离子平衡等方面起重要作用[7];外源施加腐胺、亚精胺或精胺可显著提高盐胁迫下黄瓜叶片和根系中SOD、POD和CAT活性[8],降低O2-产生速率、H2O2和MDA含量,缓解盐胁迫对黄瓜的伤害[9-10]。
大豆是重要的粮食和油料作物,不仅是人类食用蛋白和油脂的主要来源,也是工业原料的重要来源[11]。近年来,我国科研工作者从多学科多角度探究了盐胁迫对其生长发育的影响[12-13],但大多数研究只限于单盐胁迫对植物幼苗期生理指标的影响[14-16]。本实验以大豆为实验材料,通过在盐胁迫下施用产多胺细菌ccx5,观察大豆萌发及其幼苗生长情况,为产多胺细菌增强植株抗盐性的作用提供依据。
1 材料与方法
1.1 实验材料
1.1.1 供试种子:市售大豆种子吉育47(JY47),经0.1%氯化汞消毒1min后,用蒸馏水冲净残液,25℃催芽,待种子露白,挑选发芽一致的种子按一定的距离种植到灭菌的河沙中,自然光照培养。
1.1.2 供试菌株:产多胺细菌ccx5(经16s RNA序列鉴定为巨大芽孢杆菌(megaterium),分离自吉林省农安县龙王乡西岗村的羊草根际,保存于长春师范大学微生物研究室,产多胺比例为:精胺∶亚精胺∶腐胺=0.93∶2.04∶0.50。用TBS液体培养基进行菌液培养,在28 ℃旋转摇床200 r·min-1条件下培养24 h,后用722分光光度计在无菌水中调整到菌液OD值为0.5备用。
1.2 试验方法
1.2.1 不同浓度盐胁迫下产多胺细菌ccx5对大豆种子发芽的影响实验
设计两组实验:挑选大小均匀、无破损的大豆种子备用。CK组:用不同浓度NaCl(0,30,60,90,120,150 mmol·L-1)浸泡大豆种子,每个培养皿放30个大豆种子。菌处理组:NaCl浓度与CK组一致,但大豆种子经过产多胺细菌ccx5浸泡5min捞出沥干水。每天观察两组大豆种子发芽情况,并从中选出适合的盐浓度做盐胁迫下大豆种子苗期生长实验研究。
1.2.2 盐胁迫下产多胺细菌ccx5对大豆幼苗生长的影响实验
河沙洗净并高温灭菌冷却后,装入底部具孔的塑料盆(30cm×30cm×10cm)中。挑选发芽一致的种子按一定的距离种植到消毒的净沙中(深约0.5cm),自然光照培养,每盆20株。每个塑料盆为一个处理,共4组。A组:每天用120 mmol·L-1NaCl的Hoagland营养液处理,B组:用含120 mmol·L-1NaCl的Hoagland营养液和OD值为0.5的300 mL菌液处理,C组:用Hoagland营养液和OD值为0.5的300 mL菌液处理,CK组:用Hoagland营养液处理做对照组。
1.3 测定方法
1.3.1 发芽指标的测定
以胚根突破种皮1mm左右为测量标准,从第2天开始统计种子的发芽数,共统计5天,并参考文献[17]进行种子发芽率、发芽势和发芽指数的计算。
1.3.2 生态指标
大豆植株株高和鲜重的测定:在大豆幼苗长到一定高度时,将其连根拔起并小心洗掉根上的沙子,晾干后称量大豆幼苗的株高和鲜重,每组取20株。计算4组经不同处理的大豆幼苗的差异。
1.3.3 生理指标的测定
过氧化物歧化酶(SOD)活性:称取大豆幼苗鲜叶片(去叶脉)0.5 g于预冷的研钵中,加入2 mL预冷的0.05 mol·L-1磷酸缓冲液(pH=7.8),冰浴下研磨成匀浆,加入磷酸缓冲液冲洗研钵,使最终体积为10 mL,于4 ℃下10500 r·min-1离心20 min,上清液即为SOD粗酶液[18]。
丙二醇(MDA)含量测定:分别测定上清液在450、532和600 nm处的OD值,以ΔEmm[6.45×(OD532-OD600)-0.56×OD450]计算[19]。
叶绿素含量的测定方法参考文献[20]。
1.4 数据处理
实验数据采用Spss19.0和Excel 2003进行统计学分析和图表制做。
2 结果与分析
2.1 NaCl胁迫下产多胺菌对大豆种子萌发的影响
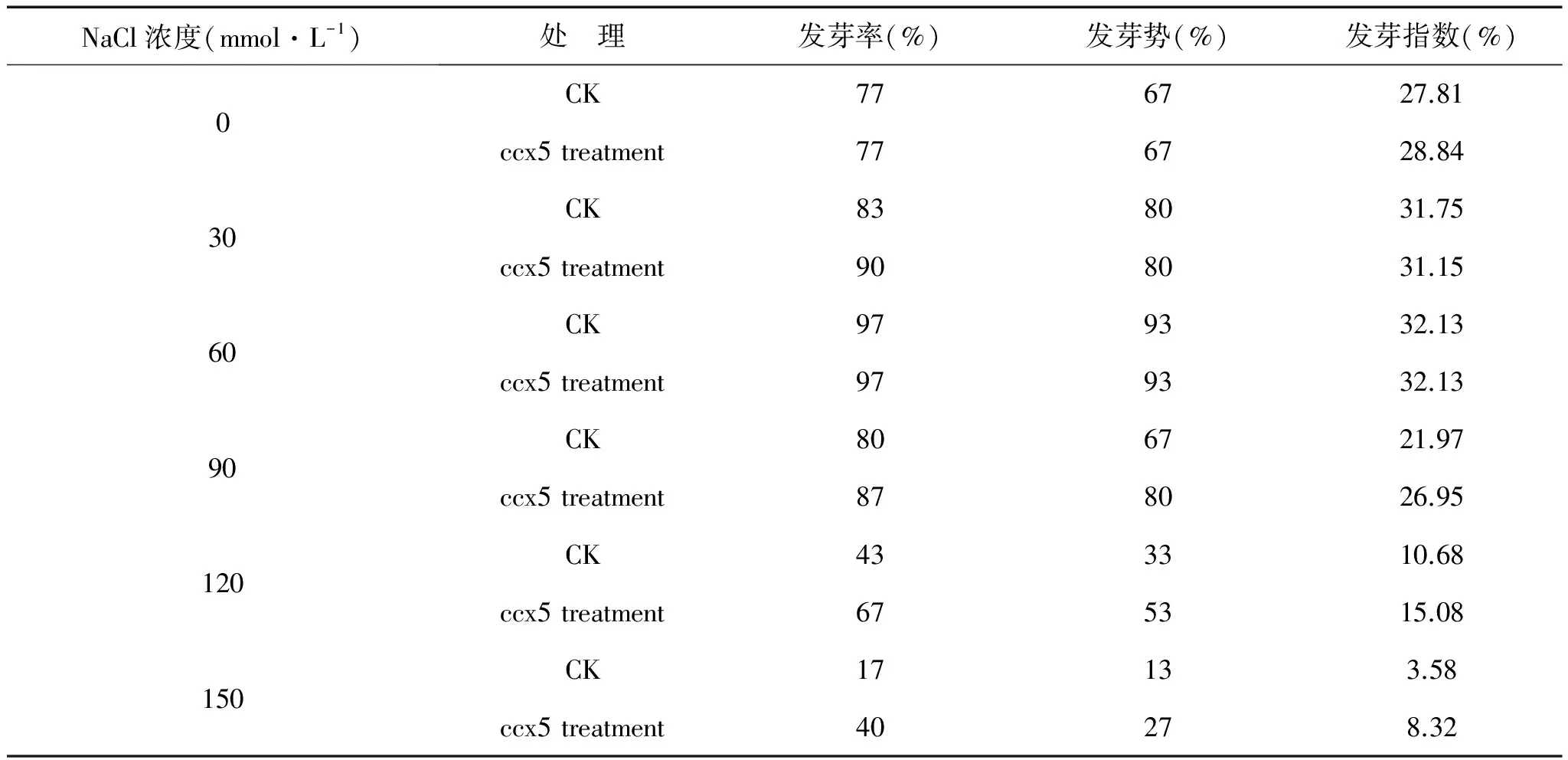
表1 不同NaCl浓度对大豆种子萌发的影响
从表1可以看出盐浓度很低时,对大豆种子的萌发影响较小,而且低盐浓度可以刺激大豆种子的萌发。60 mmol·L-1的盐浓度是种子发芽的最适浓度,但随盐浓度增加,大豆种子发芽率也下降[21]。经过产多胺细菌ccx5处理的大豆种子,低盐浓度下和无盐处理(CK组)发芽率没有差异,随着盐浓度增加,菌处理组比CK组的发芽率提高,在盐浓度为90 mmol·L-1和120 mmol·L-1时更加明显。盐胁迫下经过产多胺细菌ccx5处理过的大豆种子发芽率显著提高。从中选出盐浓度120 mmol·L-1进行盐胁迫下产多胺菌对大豆种子幼苗生长研究实验。
2.2 盐胁迫下产多胺细菌ccx5对大豆幼苗的株高和鲜重的影响
由图1和图2表明,在实验过程中,NaCl胁迫下幼苗发育受到了一定的抑制,降低了幼苗的株高和鲜重。不经产多胺细菌ccx5处理,对照组的株高和鲜重分别是盐胁迫植株株高和鲜重的1.53倍(P<0.05)和1.38倍(P<0.05)。在NaCl胁迫下,经产多胺细菌ccx5处理下的大豆幼苗的株高和鲜重分别为非菌处理下的1.31倍(P<0.05)和1.10倍(P<0.05)。在非盐胁迫下,经ccx5处理的大豆幼苗的株高和鲜重分别是对照组的1.15倍(P<0.05)和1.13倍(P<0.05)。实验表明产多胺细菌ccx5处理的大豆对盐胁迫有很强的适应性,但ccx5对非盐胁迫下植株的生长无明显促进作用。
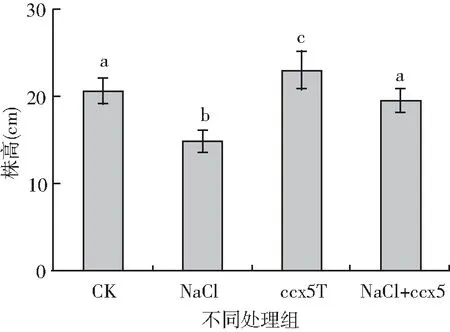
图1 不同处理大豆幼苗株高

图2 不同处理大豆幼苗冠鲜重
注:不同字母表示处理间差异显著(P<0.05),下同。
2.3 盐胁迫下产多胺细菌ccx5对大豆幼苗叶绿素含量的影响
叶绿素(chlorophyll)是一类与光合作用(photosynthesis)有关的重要色素。叶绿素从光中吸收能量,将二氧化碳转变为碳水化合物并储存起来,叶绿素越多则光合作用越强,植株生长越旺盛。图3表明,对照组幼苗叶片中叶绿素的含量是盐胁迫下未经产多胺细菌ccx5处理的2.50倍(P<0.05),在盐胁迫的作用下,经产多胺细菌ccx5处理组幼苗叶片的叶绿素含量是非菌处理组的1.84倍(P<0.05),在非盐胁迫作用下,产多胺细菌ccx5处理组幼苗叶片的叶绿素含量是对照组的1.21倍(P>0.05),显然在盐胁迫下产多胺细菌ccx5可以调节植株的生理机制,减少盐胁迫对植株光合作用的影响。说明在高盐胁迫下加入产多胺细菌ccx5缓解盐对植物中叶绿素合成的影响,降低了对植物生长的伤害。
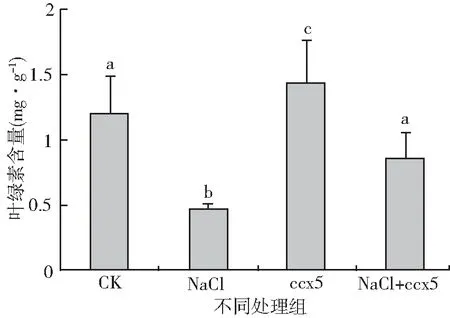
图3 不同处理大豆幼苗叶片叶绿素含量
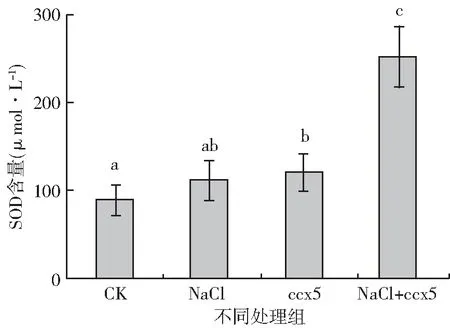
图4 不同处理大豆幼苗叶片中SOD含量
2.4 盐胁迫下产多胺细菌ccx5对大豆幼苗SOD酶活性的影响
超氧化物歧化酶(SOD)是植物体内常见的一种酶,在逆境胁迫下能有效清除代谢过程产生的活性氧,防止活性氧引起的膜脂过氧化及其它伤害过程[22],图4表明盐胁迫下ccx5处理的大豆幼苗叶片SOD活性是对照组的2.80倍(P<0.05),盐胁迫下,ccx5处理组的大豆幼苗叶片中的SOD活性是非产多胺细菌处理组的2.20倍(P<0.05),非盐胁迫下,多胺活性细菌ccx5处理组的大豆幼苗叶片的SOD活性是对照组的1.30倍(P<0.05)。表明盐胁迫下植株叶片中SOD活性明显提高,且ccx5可以提高盐胁迫下叶片中的SOD活性。
2.5 盐胁迫下产多胺细菌ccx5对大豆幼苗MDA含量的影响
MDA是植物体内自由基作用于脂质发生过氧化反应的终产物,能引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性[23]。MDA的含量可反映植物的受害程度。从图5可以看出,在没有ccx5参与下,盐胁迫使幼苗叶片中的MDA含量明显提高,是对照组的2.80倍(P<0.05)。在盐胁迫下,非产多胺细菌处理组幼苗叶片中的MDA是产多胺细菌ccx5处理组的1.53倍(P<0.05)。非盐胁迫条件下,产多胺细菌ccx5的处理与对照组无显著差异(P>0.05)。表明高盐胁迫下加入产多胺细菌ccx5降低了植物叶片MDA的含量,减少了对植物细胞的伤害,间接促进了植物的生长。
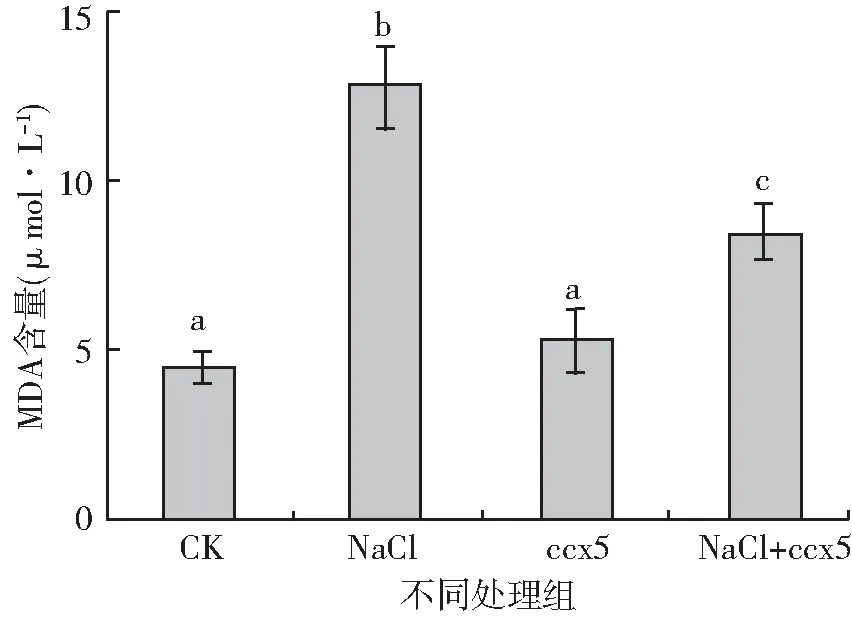
图5 不同处理大豆幼苗叶片中MDA含量
3 讨论
大豆幼苗对盐是敏感的,而盐分胁迫对大豆幼苗最普遍、最显著的效应是抑制生长[24]。幼苗被转移到盐逆境中几分钟后,生长速率即有所下降,其下降程度与根际渗透压呈正比[25]。本实验表明盐胁迫一定程度上抑制种子的发芽,影响种子的发芽率、发芽势、发芽指数等指标,影响程度与盐浓度呈正相关,轻度胁迫下有促进作用,而高浓度盐胁迫下发芽率等指标降低。低浓度的NaCl能促进大豆种子的萌发,而高浓度的NaCl则对大豆种子的萌发有显著抑制作用[26-28]。关于ACC脱氨酶细菌对植物发芽的研究报导较多[29-30],而产多胺细菌的相关研究报导较少[5]。加入了产多胺菌ccx5后大豆种子在高盐胁迫下受到的发芽抑制得到缓解,说明产多胺细菌ccx5对大豆的发芽有促进作用。
盐胁迫处理组的大豆幼苗株高和鲜重有明显的降低,说明120 mmol·L-1NaCl溶液对植株幼苗的生长发育有抑制作用。这些抑制作用通过多种形式表现出来。盐胁迫下,植物体内积累较多的活性氧,这些活性氧若不及时清除可能引起膜脂过氧化和脱酯化作用,细胞膜透性增加,细胞膜的结构和功能受到破坏[31]。SOD是植株内有效的活性氧清除剂,其活性在盐胁迫条件下均高于正常水平,它们协同作用清除体内过多的ROS,有效阻止MDA的积累,抵抗盐胁迫诱导的氧化伤害。本实验结果表明,由于植物受到盐分的胁迫,幼苗中的MDA含量明显提高,而且植物为了提高抗盐性,使其抗氧化酶活性增强。本文中盐胁迫实验大豆叶片SOD含量增加,加入产多胺菌大豆幼苗叶片SOD含量减少,从而间接地增加了大豆幼苗的抗盐性,促进大豆幼苗的生长。这与江行玉[32]等通过外源叶面喷施spm的方法抑制MDA积累的研究结果及林庆斌等[33]加入氨基酸类物质提高了水稻体内SOD含量缓解了盐害作用相似。
刁丰秋[34]等的研究表明盐胁迫下NaCl提高了叶绿素酶的活性,从而加快了叶绿素的降解,在120 mmol·L-1NaCl胁迫下,大豆幼苗叶片中的叶绿素含量有明显降低。盐胁迫使植物叶片中叶绿素含量下降[35-37],可能是由于Chl酶活性增强,促进叶绿素分解[38]或者由于在盐胁迫下,植物叶片细胞中叶绿素与叶绿体蛋白间结合变得松驰,使更多的叶绿素遭到破坏[39],叶片中的叶绿素含量降低。本研究加入了产多胺细菌ccx5后叶绿素的含量明显增加,间接提高了大豆种子的萌发及抗盐性,这与刘俊等[40]报导的多胺缓解盐对玉米盐害作用,提高了玉米叶片的光合能力相似。但加入菌后具体是对叶绿素合成过程的哪一环节产生影响还有待进一步研究。
多胺与植物的生存密切相关。环境胁迫能够诱导植物体内积累大量的多胺,多胺含量增加对稳定细胞膜、核酸及蛋白质等大分子物质有重要作用[41-42]。在本实验中,经产多胺细菌ccx5处理的大豆幼苗的鲜重、叶片叶绿素含量、SOD活性有明显的提高,但MDA的含量有所下降,表明了产多胺细菌ccx5产生的多胺可以通过增加植物体内的各种抗氧化酶的活性,降低了活性氧的含量,从而降低了氧化胁迫对植物的伤害,间接达到促进植物生长的作用。而产多胺菌对大豆生长促进的具体机理还需要进一步研究。
4 结论
在盐胁迫下,植物的生长情况和植物体内的抗氧化酶的活性有密切的关系,较高水平的抗氧化酶活性可以降低植物体内活性氧的含量,有效地阻止盐胁迫对植物的伤害,提高植物的抗盐性。多胺活性细菌可以通过产生多胺物质来参与植物体的氧化代谢,提高植物体内抗氧化酶的活性,增强植物耐盐性。
[参考文献]
[1]Huang Y, Zhang Y L. The soil degradation problem in greenhouse and control counterasures[J]. Chinese Journal of Soil Science, 2004(2):212-216.
[2]Ren gasamy P. World salinization with emphasis on Australia[J]. Journal of Experimental Botany, 2006(5):1017-1023.
[3]Chin nusany V, Jagendorf A, Zhu J K. Understanding and improving Salt tolerance in plants[J]. Crop Science,2005(2): 437-448.
[4]AA Al-Helal, MM Al-Farraj, RA El-Desoki, et al. Germination response of Cassia senna L. seeds to sodium salts and temperature[J]. Journal of the University of Kuwait, Science, 1989(2):281-287.
[5]辛树权,母若雨,时东方,等.一株产多胺菌的分离及NaCl胁迫下对黄瓜幼苗生长的影响[J].吉林农业大学学报,2017(6):675-682.
[6]许煜泉.高等植物体内的多胺类物质[J].上海农学院学报,1986(2):157-164.
[7]刘宽灿,梁秋芬,赵丽红,等.多胺在植物生长发育过程中的生理作[J].氨基酸和生物资源,2005(1):22-26.
[8]李青云,葛会波,胡淑明.NaCl胁迫下外源腐胺和钙对草莓幼苗离子吸收的影响[J].植物营养与肥料学报,2008(3):540-545.
[9]Glick B R, Jacobson C B, Schwarze M M K, et al. 1-Aminocyclopropane-1-carboxylic acid deaminase mutants of the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 do not stimulate canola root elongation[J]. Can J Microbiol, 1994(40):911-915.
[10]刘俊,吉晓佳,刘友良.检测植物组织中多胺含量的高效液相色谱法[J].植物生理学通讯,2002(6):596-598.
[11]农业部市场与经济信息司.2011年中国农产品市场分析报告[M].北京:中国农业出版社,2011.
[12]周三,赵可夫.关于野大豆盐腺问题的探讨[J].植物学报,2003(5):574-580.
[13]王洪新,胡志昂,钟敏,等.盐渍条件下野大豆群体的遗传分化和生理适应:同工酶和随机扩增多态DNA[J].植物学报,1997(1):34-42.
[14]杜莉莉,於丙军.栽培大豆和滩涂野大豆及其杂交后代耐盐性、农艺性状与籽粒品质分析[J].中国油料作物学报,2010(1):77-82.
[15]陈宣钦,刘怀攀,罗庆云.耐盐性不同的野大豆种子和幼苗对等渗水分和NaCl胁迫的响应[J].南京农业大学学报,2006(4):28-32.
[16]赵春.黄河三角洲野生大豆种子和幼苗对盐胁迫的响应[J].大豆科学,2015(1):71-74.
[17]莫金钢,马建,沈勇,等.干旱胁迫下大豆抗旱突变M18苗期生长和生理特性[J].中国油料作物学报,2014(6):770-776.
[18]Giannopolitis C N, Ries S K. Superoxide dismutases: II. Purification and quantitative relationship with water-soluble protein in seedlings[J].Plant Physiology,1977(2):315-318.
[19]Robert L. Heath, Lester Packer.Photoperoxidation in isolated chloroplasts:I.Kinetics and stoichiometry of fatty acid peroxidation[J].Archives of Biochemistry and Biophysics,1968(1):189-198.
[20]叶济宇.关于叶绿素含量测定中的Arnon计算公式[J].植物生理学通讯,1985(6):69.
[21]张古文,朱月林,杨立飞,等.NaCl胁迫对番茄嫁接苗生物量及离子含量的影响[J].西北植物学报,2006(10):2069-2074.
[22]余叔文,汤章成.植物生理与分子生物学[M].北京:科学出版社,1998.
[23]毛任钊,田魁祥,松本聪,等.盐渍土盐分指标及其与化学组成的关系[J].土壤,1997(6):326-330.
[24]刘英,张衷华,李德文,等.PEG6000对长春花幼苗期的胁迫效应和生物碱含量影响[J].华中农业大学学报,2013(5):40-44.
[25]李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008(1):258-265.
[26]赵福才,寇贺,陈为,等.不同大豆品种萌发期耐盐性的比较[J].辽宁农业职业技术学院学报,2009(3):19-20.
[27]刘太林,杨静慧,穆俊丽,等.不同大豆品种种子萌发期的耐盐性[J].大豆科学,2009(5):837-841.
[28]郝雪峰,高惠仙,燕平梅,等.盐胁迫对大豆种子萌发及生理的影响[J].湖北农业科学,2013(6):1263-1264.
[29]刘维红,闫淑珍,杨启银,等.ACC脱氨酶活性细菌的筛选及其对番初生苗生长的影响[J].江苏农业科学,2006(2):80-84.
[30]刘琛,赵宇华,傅庆林,等.ACC脱氨酶活性细菌的筛选、鉴定及其对茄子耐盐性的影响[J].浙江大学学报:农业与生命科学版,2008(2):143-148.
[31]柯德森,孙谷畴,王爱国,等.低温诱导绿豆黄化幼苗乙烯产生过程中活性氧的作用[J].植物生理与分子生物学学报,2003(3):127-132.
[32]江行玉,窦君霞,赵可夫,等.精胺对盐胁迫下玉米衰老和生长的影响[J].山东师范大学学报,1997(1):75-76.
[33]林庆斌,丁扬,王海波,等.盐胁迫下SOD模拟物对水稻幼苗生物量及SOD活性的影响[J].土壤通报,2009(5):1163-1166.
[34]刁丰秋,章文华,刘永良.盐胁迫对大麦叶片类囊体膜脂组成和功能的影响[J].植物生理学报,1997(2):105-110.
[35]吴水波,薛建辉.盐胁迫对3种白蜡幼苗生长与光合作用的影响[J].南京林业大学学报,2002(3):19-22.
[36]汪贵斌,曹福亮.盐胁迫对落羽生产生理及生长的影响[J].南京林业大学学报,2003(3):11-14.
[37]马焕成,王沙生,蒋湘宁.盐胁迫下胡杨的光合和生长响应[J].西南林学院学报,1998(1):33-41
[38]Rao GG,Rao GRI. Pigment composition and chlorophyllase activity in pigment pea and gingelley under NaCl salinity[J].Indian Journal Experimental Biology,1986(19):768-770.
[39]杨淑慎,高俊风,李学俊,等.高等植物叶片的衰老[J].西北植物学报,2001(6):1271-1277.
[40]刘俊,周一峰,章文华,等.外源多胺对盐胁迫下玉米叶绿素结合态多胺水平和光合作用的影响[J].西北植物学报,2006(2):257-258.
[41]沈惠娟,梁成喜,李梅枝.多效唑浸种提高刺槐幼苗耐盐性的研究[J].植物学报,1993(8):606-610.
[42]沈惠娟,李梅枝,梁成喜.盐胁迫下ABA对刺槐幼苗体内腐胺、脯氨酸和保护酶系统的影响[J].浙江林学院学报,1992(3):290-296.
