HBV患者血清miRNA-122、IL-12、IL-4的水平变化及其意义
2018-04-25王艳瑛鲁晓娟
王艳瑛,鲁晓娟
(驻马店市中心医院普外二科,河南 驻马店 463000)
乙型肝炎病毒(Hepatitis B virus,HBV)感染是肝脏疾病主要病因之一。HBV感染呈全球分布,与肝硬化及肝癌的关系密切,是世界范围内重要的公共健康问题,全球人口的30%有血清学证据证实现症或既往感染HBV[1]。micro RNA(miRNA)是一类内源性非编码RNA,它参与癌症发生发展过程中多个通路的调控[2]。研究表明,mi RNA-122在HBV感染中起着重要的抑制作用,它可能成为新的HBV感染诊断和预后的重要生物标记以及治疗靶点[3]。 此外,一些细胞因子(IL-2,IL-4)等在慢性乙型肝炎发病机制及治疗中的作用研究越来越受到人们的关注[4]。本研究探讨乙型肝炎病毒(HBV)感染患者血清白细胞介素-12(IL-12)、白细胞介素-4(IL-4)及miRNA-122的水平变化及其意义,报告如下:
1 资料与方法
1.1 一般资料 选取医院确诊的HBV感染患者126例(HBV组),另外选取健康体检对象40例作为对照组,收集时间2014年1月至2017年1月。HBV组,男 62例、女 64例,年龄 28~75岁,平均49.6±18.7岁,其中慢性HBV携带者39例、慢性乙型肝炎患者54例、乙型肝炎肝硬化患者33例。对照组,男22例、女18例,年龄22~79岁,平均46.7±15.9岁。两组患者的年龄、性别比较,差异无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴HBV感染的诊断及患者分组标准参考2010年《慢性乙型肝炎防治指南诊断标准》;⑵患者年龄范围19~79岁;⑶对照组来源于本院体检健康的自愿者;⑷本研究获得研究对象的知情同意。
1.2.2 排除标准 ⑴肝脏肿瘤;⑵合并其他类型肝炎病毒感染;⑶HIV感染;⑷经过抗病毒治疗。
1.3 miRNA-122检测 抽取外周静脉血2ml,置于EDTA抗凝管中,采用Trizol试剂盒(购自美国Invitrogen公司)提取血清总RNA,方法按照试剂盒说明书进行。Nanodrop2000型核酸测定仪上测定RNA浓度,选取U6作为内参基因,以cDNA为模板,采用SYBR Premix Ex Taq试剂盒(大连Takara公司)检测血清miRNA-122水平。
1.4 IL-12、IL-4 患者于早上8点空腹采血5ml,3000r/min进行离心后提取上清,将上清液在-20℃的环境中保存,IL-12、IL-4使用双抗体夹心酶联免疫吸附法检测,检测试剂盒由上海嵘崴达实业有限公司提供,酶标仪选用Synergy H1全功能酶标仪(美国伯腾仪器有限公司)。
1.5 HBeAg、HBV-DNA、ALT检测 血清ALT用日本东芝TBA-2000FR全自动生化分析仪和配套试剂进行检测,测定方法为酶速率法。HBV-DNA采用LightCycler荧光PCR检测仪,试剂盒为中山大学达安基因公司乙肝病毒(HBV)核酸扩增荧光检测试剂盒,操作按照说明书进行。采用乙型肝炎诊断试剂盒进行乙肝病毒感染标志物HBeAg检测。1.6统计学方法 统计软件采用SPSS 16.0,采用均数±标准差(x±s)进行统计描述,组间比较采用单因素方差分析法,组间两两比较采用LSD-t检验;相关性分析法采用Pearson线性相关分析法;P<0.05表示差异具有统计学意义。
2 结果
2.1 各组的血清IL-12、IL-4及miRNA-122水平比较 慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者的血清IL-12、miRNA-122水平均显著的高于对照组(P<0.05),慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者与对照组的血清IL-4水平差异均无统计学意义 (P>0.05),慢性HBV携带者的血清IL-12、miRNA-122显著高于慢性乙型肝炎患者、乙型肝炎肝硬化患者(P<0.05)(表 1)。
2.2 各组的HBeAg、HBV-DNA、ALT水平比较 慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者的HBeAg、lg HBVlog10HBV-DNA水平均显著的高于对照组(P<0.05),慢性乙型肝炎患者的HBeAg、ALT水平显著的高于慢性HBV携带者、乙型肝炎肝硬化患者(P<0.05)(表 2)。
2.3 相关性分析 HBV感染患者IL-12、miRNA-122 与 HBeAg、lg log10 HBV-DNA、ALT 呈显著的正相关性(P<0.05),IL-4 与 HBeAg、lg log10 HBVDNA、ALT 无明显的相关性(P>0.05)(表 3)。
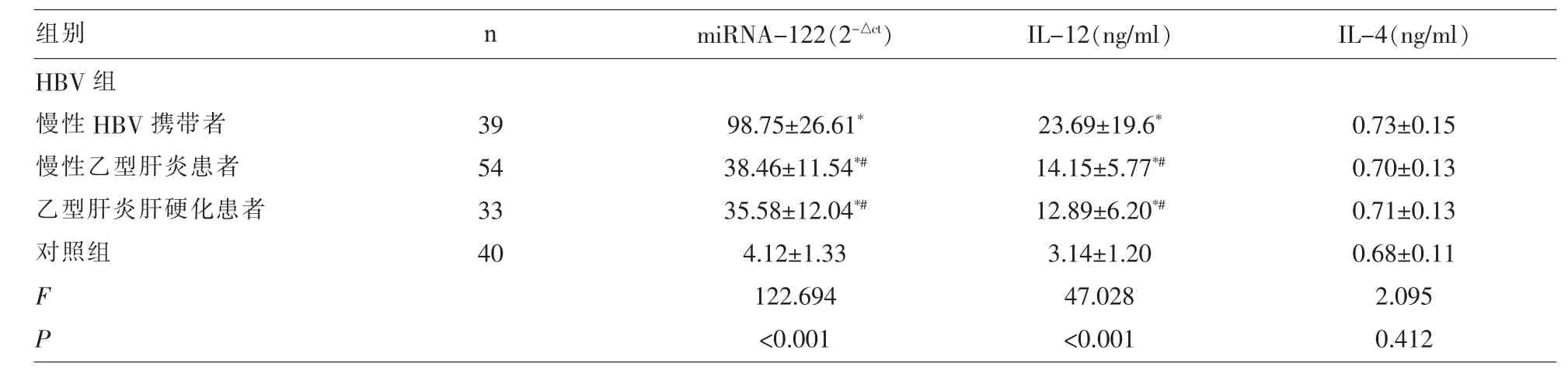
表1 各组的血清IL-12、IL-4及miRNA-122水平比较(x±s)
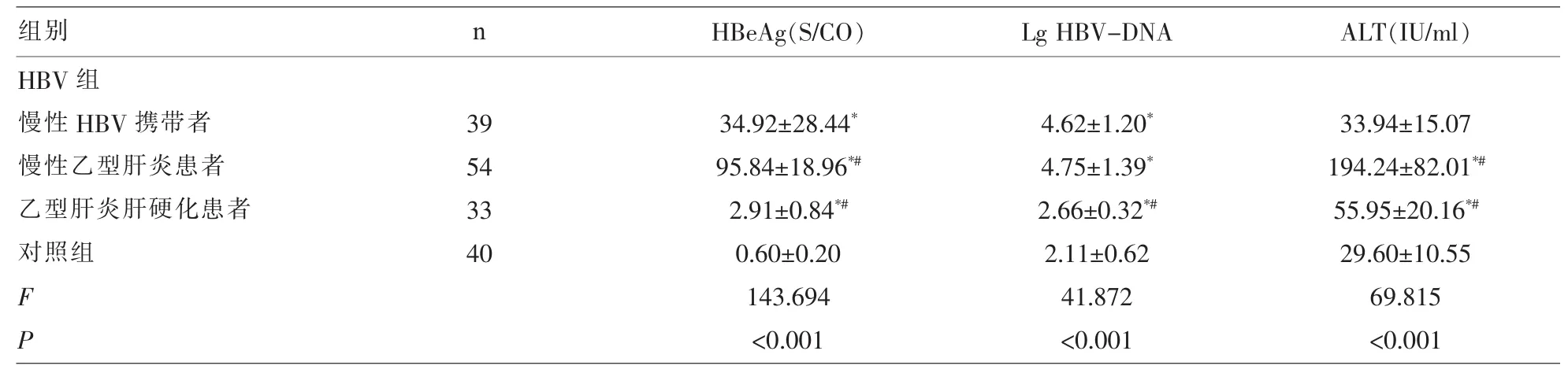
表2 各组的 HBeAg、HBV-DNA、ALT 水平比较(x±s)
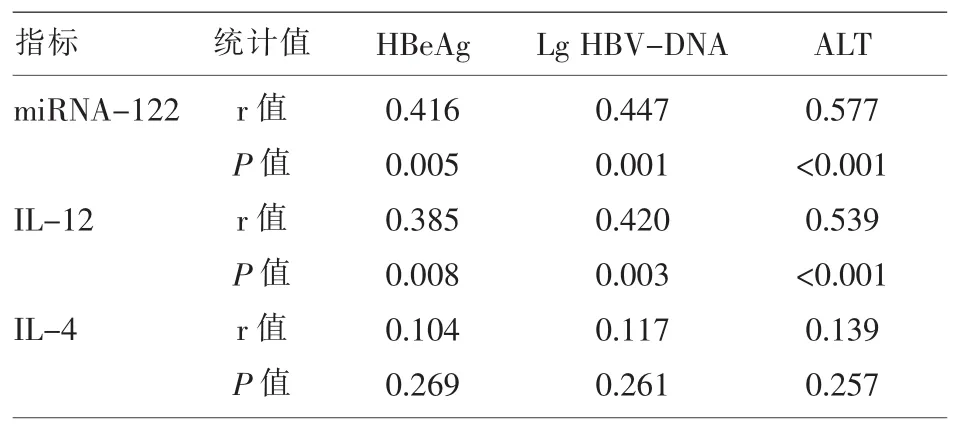
表3 相关性分析
3 讨论
乙型肝炎病毒(HBV)简称乙肝病毒,是一种DNA病毒,属于嗜肝DNA病毒科[5]。近年来,乙型肝炎病毒 (HBV)感染是一个严重的公共卫生问题,在我国尤为突出。慢性HBV感染者可以划分为慢性乙型肝炎、乙型肝炎肝硬化、慢性HBV携带者及隐匿性慢性乙型肝炎[6]。目前,我国乙型肝炎的病原学诊断主要依据血清HBV感染标记物的检测结果,主要反映人体对乙肝病毒的免疫反应状态。但这种方法的缺点是血清HBV感染标记物组合模式较多,使结果难以判定,因此寻找可靠的检测指标十分重要。
机体被HBV感染后,引起特异性免疫反应,促进疾病恢复。机体主要通过T淋巴细胞清除入侵的HBV病毒,T细胞既可以作为免疫效应细胞直接杀伤靶细胞,又可以作为免疫调节细胞调节免疫应答[7]。有研究报道称,Th1/Th2细胞的比例失调可能是HBV感染慢性化的原因之一。白细胞介素-12(interleukin-12,IL-12)是由多种免疫细胞产生并作用于多种细胞的一类细胞因子,由Th1细胞分泌。IL-12可刺激活化型T细胞增殖,促进Th0细胞向Th1细胞分化,在抗肿瘤免疫及抗感染免疫中被人们寄予厚望[8]。本研究结果显示,慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者的血清IL-12水平均显著的高于对照组 (P<0.05),而且慢性HBV携带者的血清IL-12显著的高于慢性乙型肝炎患者、乙型肝炎肝硬化患者(P<0.05);表明HBV感染患者的IL-12水平较健康人群显著的增高,并且与患者肝功能、病毒复制、传染性具有一定的关系。白细胞介素4(interleukin 4,IL-4)是Th2细胞分泌的细胞因子,在调节体液免疫和适应性免疫中起关键作用。Lu Y等[9]研究发现,在慢性乙型肝炎中,IL-4升高,体液免疫增强,与HBV持续感染有关。本研究结果显示,慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者与对照组的血清IL-4水平差异均无统计学意义(P>0.05),可能与HBV感染未能明显影响Th2细胞合成和分泌IL-4有关,具体机制有待进一步研究。
micro RNA(mi RNA)是长度约 22 nt的内源性短链RNA,在体内可以通过促进靶向基因mRNA的降解,或抑制mRNA翻译,从而导致靶基因水平下降。研究表明,miRNA参与多种肿瘤细胞的活动,在多种肿瘤中异常表达[10]。肿瘤组织中往往存在特异性miRNA表达量的变化。miRNA在肝癌组织中低表达,但在肝癌患者血清中含量则升高,其表达水平和预后有密切关系[11]。microRNA-122是肝脏的特异性 (miRNA),占全部肝内miRNA的70%,研究表明miRNA-122能调控HBV的复制[12]。以往研究显示,慢性乙肝病毒引起肝脏损伤会导致到miRNA-122的升高[13]。但是较少有研究指出其与患者肝功能之间的关系。本研究结果显示,慢性HBV携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者的血清miRNA-122水平均显著的高于对照组 (P<0.05),这与国内外研究结果相符合[14,15]。进一步研究发现,慢性HBV携带者的血清miRNA-122显著的高于慢性乙型肝炎患者、乙型肝炎肝硬化患者(P<0.05);而慢性乙型肝炎患者的HBeAg、ALT水平显著的高于慢性HBV携带者、乙型肝炎肝硬化患者 (P<0.05)。说明血清miRNA-122的表达水平与肝脏损伤程度呈负相关,因此miRNA-122的表达水平有可能成为监控慢性HBV感染的血清学指标。
综上所述,HBV感染患者的miRNA-122、IL-12水平较健康人群显著的增高,并且与患者肝功能、病毒复制、传染性具有一定的关系,因此miRNA-122、IL-12在HBV感染患者血清中的表达情况,对该病的早期诊断、治疗和预后评估可能有重要意义,需进一步研究阐明其具体功能。
[1]刘再伏,胡光元,何启俊.乙型肝炎病毒含量及感染方式与临床治愈率相关性研究[J].中华医院感染学杂志,2015,25(3):562-563.
[2]谢震宇,傅益飞,张爱华,等.乙型肝炎病毒变异在母婴传播中的初步研究[J].第二军医大学学报,2015,36(7):715-721.
[3]李曼,孙学华,周振华,等.慢性乙型肝炎病毒感染者外周血T细胞γ干扰素和白细胞介素4的水平变化[J].细胞与分子免疫学杂志,2016,32(2):240-244.
[4]张凯,刘小静,蔺淑梅.乙型肝炎病毒相关肝细胞癌抗病毒治疗的作用及对预后的影响 [J].中国实用内科杂志,2015,35(6):495-498.
[5]赫晓林,黄建炜,许瑞安,等.HBV病毒复制机制及慢性乙型肝炎药物靶点[J].中国药理学通报,2015,31(2):152-156.
[6]梁金明,陈聪,欧志莲,等.乙型肝炎病毒标志物检测方法的选择与应用[J].实验与检验医学,2016,34(5):568-570.
[7]Liu L,Xu Y,Liu Z,et al.IL12 polymorphisms,HBV infection and risk of hepatocellular carcinoma in a high-risk Chinese population.[J].J GASTROENTEROL Journal of Gastroenterology,2011,128(7):1692.
[8]Crett陶鹏辉.乙型肝炎病毒感染者血清HBV DNA与IL-21及IFN-γ 水平的相关性[J].实验与检验医学,2017,35(3):347-350.[9]Lu Y,Wu Z,Peng Q,et al.Role of IL-4 gene polymorphisms in HBV-related hepatocellular carcinoma in a Chinese population[J].PLOS ONEPlos One,2014,9(10):e110061.
[10]Li Z,Guo Y,Zhou L,et al.Association of a functional RAD52 genetic variant locating in a miRNA binding site with risk of HBV-related hepatocellular carcinoma[J].Mol Carcinai,2015,54(9):853-858.
[11]郝美君,郑素军,丁惠国,等.MicroRNA-122作用于HBx影响乙肝病毒复制[J].生物医学工程学杂志,2011,28(4):784-789.
[12]Zheng QF,Zhang JY,Wu JS,et al.Upregulation of miRNA-130a Represents Good Prognosis in Patients With HBV-Related Acuteon-Chronic Liver Failure:A Prospective Study[J].Medicine,2016,95(6):e2639.
[13]Qiu L,Fan H,Jin W,et al.miR-122-induced down-regulation of HO-1 negatively affects miR-122-mediated suppression of HBV.[J].Biochem Biophys Res Commun,2010,398(4):771-777.
[14]Feng P,Xiao X,Jiang Y,et al.HBx Down-Regulated Gld2 Plays a Critical Role in HBV-Related Dysregulation of miR-122[J].Plos One,2014,9(3):e92998.
[15]Luna JM,Michailidis E,Rice CM.Mopping up miRNA:An integrated HBV transcript disrupts liver homeostasis by sequestering miR-122[J].J Hepatol,2016,64(2):257.
