拉氧头孢对大肠埃希菌和肺炎克雷伯菌体外敏感性分析
2018-04-25周国强朱振武欧阳清黄燕敏丘丽慧潘俊均
周国强 ,朱振武 ,欧阳清 ,黄燕敏 ,丘丽慧 ,潘俊均 ,
(1、东莞市万江医院检验科,广东 东莞 523000;2、东莞市万江医院口腔科,广东 东莞 523000;3、东莞市康华医院检验科,广东东莞523000)
拉氧头孢是80年代由日本研制的半合成的非典型1-氧-8-内酰胺类抗生素[1],属氧头孢烯类抗菌药,该药抗菌谱广,杀菌作用强,对超广谱β-内酰胺酶(ESBLs)稳定,对革兰阴性菌尤其是肠杆菌科细菌有较强的抗菌作用。而大肠埃希菌和肺炎克雷伯菌是临床上分离率最高的肠杆菌科细菌,为了明确拉氧头孢对大肠埃希菌和肺炎克雷伯菌的体外抗菌活性,本文对拉氧头孢体对大肠埃希菌和肺炎克雷伯菌的体外抗菌敏感性进行了分析,希望为临床上合理使用拉氧头孢提供依据。现报告如下:
1 材料与方法
1.1 材料来源 收集本院2016年1月到2016年12月间临床标本分离出的共390株大肠埃希菌和肺炎克雷伯菌的菌株。
1.2 仪器与试剂 仪器:全自动细菌鉴定仪VITEK 2 Compact(法国梅里埃),全自动血培养仪FX(美国BD)。试剂:微生物培养所用培养平板和手工法M-H平板及GN鉴定卡和AST-13药敏卡均选用法国梅里埃,拉氧头孢试剂为浙江惠迪森公司提供,美罗培南等手工药敏纸片选用英国OXOID。质控菌株大肠埃希菌ATCC25922、大肠埃希菌ATCC35218和ATCC25922、 肺炎克雷伯菌ATCC700603、均购自广东省临床检验中心。所有试剂均在有效期内使用,室内质控均在控。
1.3 方法 所有标本的接种,培养,鉴定和药敏均严格按全国临床检验操作规程[2]及CLSI(2014版)[3]药敏标准规范化操作,对拉氧头孢和美罗培南进行最低抑菌浓度MIC法和纸片扩散法(K-B法)测定,根据CLSI-2014版标准进行药敏结果的判读。ESBLs表型确证:大肠埃希菌和肺炎克雷伯菌的ESBLs表型确证试验采用CLSI(2014版)推荐的双纸片扩散法;改良Hodge试验检测产碳青霉烯酶表型确认试验参照CLSI(2014版)标准操作进行。
1.4 统计学分析 所有实验数据采用WHONET5.6和惠桥检验系统软件进行统计学分析。
2 结果
2.1 390株临床分离大肠埃希菌和肺炎克雷伯菌原始标本临床分布及构成比的情况 见表1。
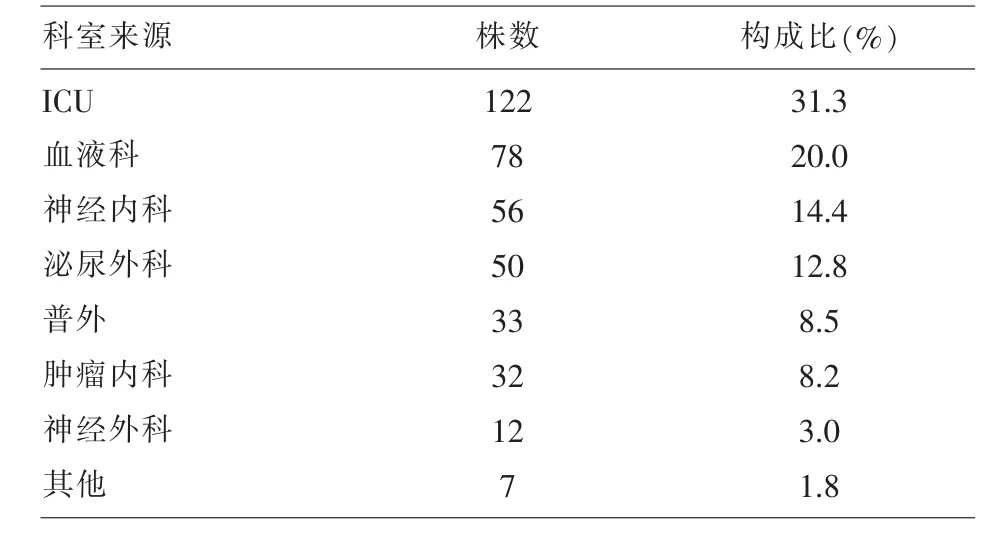
表1 390株分离菌标本临床分布及构成比
2.2 390株分离菌标本类别分布及构成比 见表2。
2.3 拉氧头孢和美罗培南对390株大肠埃希菌和肺炎克雷伯菌的体外敏感性结果 见表3。
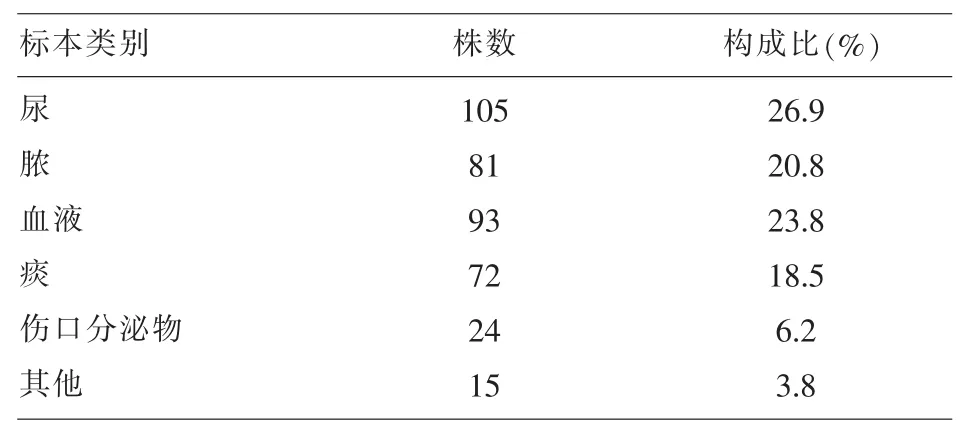
表2 390株分离菌标本类别分布及构成比
3 讨论
拉氧头孢是80年代日本研制的半合成新型抗生素,属于氧头孢烯类抗生素,具有抗菌谱广,血药浓度维持较久,组织分布广,能耐受大多数β-内酰胺酶对细胞外膜和组织穿透力强等的临床特点[4,5],对革兰阴性杆菌具有高效广谱的抗菌活性,但对非发酵类细菌抗菌活性明显偏低。超广谱β-内酰胺酶(ESBLs)在革兰阴性杆菌中的大肠埃希菌和肺炎克雷伯菌中最容易检出。研究显示表明超广谱-内酰胺酶是质粒介导的,能水解青霉素类、头孢菌素及单环β-内酰胺类抗生素,且容易被酶抑制剂如舒巴坦,他唑巴坦,克拉维酸等抑制的β-内酰胺酶。产ESBLs是临床最常见的多重耐药机制之一,据 Oteo 等[6,7]相关的报道:产超广谱 β-内酰胺酶的大肠埃希菌及肺炎克雷伯菌是引起院内血流感染及社区感染的主要病原体,常导致治疗失败而使病死率增高,因此科学准确及时地治疗产ESBLs细菌引起的感染在临床上就显得尤为重要,越来越被临床所重视。在2014年中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识[8]中推荐到碳青霉烯类抗菌药对产ESBLs肠杆菌科有高度的抗菌活性。本文统计结果显示,美罗培南为代表的碳青霉烯类抗菌药对产超广谱β-内酰胺酶和非超广谱β-内酰胺酶的大肠埃希菌的敏感率分别为100%和96.4%;对产超广谱β-内酰胺酶和非超广谱β-内酰胺酶的肺炎克雷伯菌的敏感率分别为100%和97.3%,拉氧头孢对产超广谱β-内酰胺酶和非超广谱β-内酰胺酶的大肠埃希菌的敏感率分别为96.7%和96.4%;对产超广谱β-内酰胺酶和非超广谱β-内酰胺酶的肺炎克雷伯菌的敏感率分别为95%和97.3%,与崔兰卿等[9-10]所报道的有关拉氧头孢对肠杆菌科细菌等的体外抗菌敏感程度比较相近,提示拉氧头孢对产超广谱β-内酰胺酶和非超广谱β-内酰胺酶的大肠埃希菌和肺炎克雷伯菌具有比较好的抗菌活性。
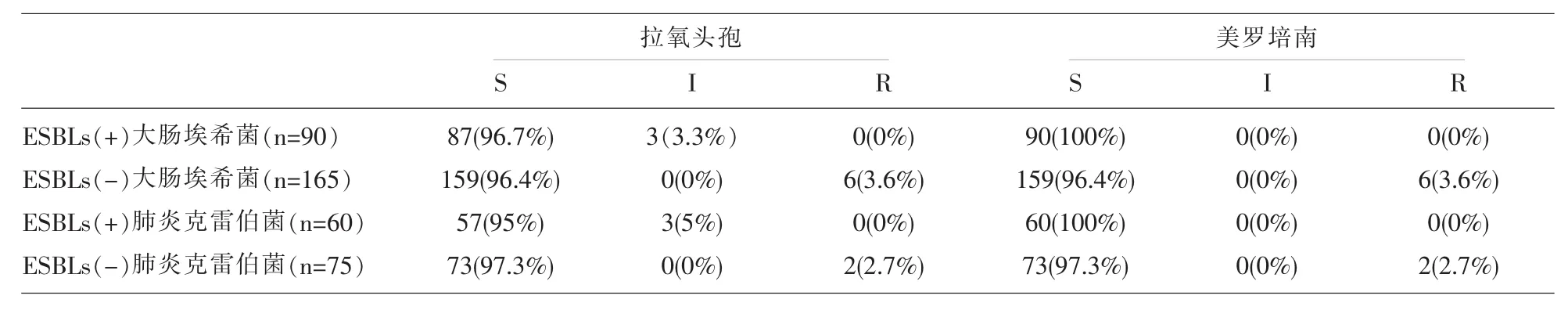
表3 拉氧头孢和美罗培南对390株大肠埃希菌和肺炎克雷伯菌的体外敏感性结果
由于拉氧头孢结构的特殊性所带来的对大肠埃希菌和肺炎克雷伯菌具有的比较好的体外敏感活性,充分了解拉氧头孢的体外抗菌活性,可以指导临床更合理地使用抗生素,达到更好的治疗效果。
[1]Yoshioka M,Tauji T,Uyeo S,et al.Stereocontrolled straightforward synthesis of 3-substituted methyl 7a-methoxy-1-oxacephems[J].Tetrahedron Lett,1980,21(4):351-354.
[2]叶应妩,王毓三,申子瑜,等.全国临床检验操作规程[M].第3版.南京:东南大学出版社,2006:886-887.
[3]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twenty-fourth informational supplement[S].Document M100-S24.Wayne,PA:CKSI;2014.
[4]杨青,陈石波,顾怡明,等.氧头孢烯类抗生素对产超广谱β-内酰胺酶菌株的体外抗菌活性研究 [J].中国感染与化疗杂志,2003,3(6):344-346.
[5]杨洋,朱德妹,叶信予,等.拉氧头孢的体外抗菌作用[J].中国感染与化疗杂志,2013,13(6):365-375.
[6]Oteo J,Perez-Vazqucz M,Campos J.Extended-spectrum[beta]-lactamase producing escherichia eoli:changing epidemiology and clinical impact[J].Curr Opin Infect Dis,2010,23(5):320-326.
[7]钟敏,张凯,黄湘宁,等.社区获得性血流感染产ESBLs大肠埃希菌与肺炎克雷伯菌流行情况及危险因素初步分析[J].中华微生物学和免疫学杂志,2016,36(2):117-123.
[8]周华,李光辉,陈佰义,等.中国产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略专家共识 [J].中华医学杂志,2014,94(24):1847-1856.
[9]崔兰卿,李耘,吕媛,等.我国2004年至2014年临床分离肠杆菌科细菌对拉氧头孢的体外敏感性分析 [J].中国临床药理学杂志,2016,32(9):813-817.
[10]全晶晶,王瑶,季京淑,等.拉氧头孢对肠杆菌科细菌及厌氧菌的体外抗菌活性观察[J].中国医学杂志,2016,96(18):1459-1462.
