Xpert MTB/RIF检测结核杆菌的应用效果及对患者用药影响
2018-04-25李静黄国楼
李静,黄国楼
(惠州市结核病防治研究所,广东 惠州 516008)
结核病是一种慢性传染性疾病,由结核分枝杆菌感染引起,传染性强,肺结核是最常见的结核病类型,结核病是人类死亡的主要疾病之一,降低结核病的发病率和死亡率具有重要意义,对结核病进行早期诊断和耐药性检测对降低结核病发病率和死亡率具有重要意义[1,2]。结核病传统的确诊方法为培养法和涂片法,但培养法周期长,涂片法检出率低[3]。Xpert MTB/RIF是一种新的分子检测方法,在结核分枝杆菌和利福平耐药性的诊断中受到大家关注[4]。本文对Xpert MTB/RIF对肺结核患者痰标本中结核分枝杆菌利福平耐药的应用效果及对患者用药影响进行研究,为临床提供依据。
1 资料与方法
1.1 临床资料 收集我所2014年1月-2017年6月肺结核患者痰标本1200例进行药敏试验;诊断为耐多药肺结核患者100例,根据随机数字法分为Xpert MTB/RIF组和比例法组,每组50例,Xpert MTB/RIF法组患者根据Xpert MTB/RIF药敏试验结果指导用药,比例法组患者根据比例法药敏试验结果指导用药。Xpert MTB/RIF组患者病程2.78±0.34年,年龄 39.67±14.26 岁,男性 33 例,女性17例;比例法组患者病程2.83±0.29年,年龄40.21±13.94岁,男性35例,女性15例,两组病程、年龄、性别差异无显著性。研究经伦理委员会审批。
纳入标准:1200例痰标本肺结核患者签署知情同意书,100例耐多药肺结核患者签署治疗知情同意书,耐多药肺结核患者均为继发性肺结核,均耐多药,X线示肺病有空洞和肺结核病灶,纳入前4个月内痰涂片AFB染色或痰培养结核分枝杆菌阳性,资料完整。
排除标准:肺结核合并肺外结核者,拒绝参与者,严重肝肾功能异常者,高血压、心律失常等心血管病史者,糖尿病者,嗜酒者,对治疗药物过敏者。
1.2 研究方法 1200例痰标本进行Xpert MTB/RIF法检测和固体比例法药敏实验检测药物敏感性,比较其诊断利福平耐药的一致性,并以比例法药敏实验结果分析利福平耐药诊断耐多药结核分枝杆菌的可行性;对耐多药肺结核患者根据Xpert MTB/RIF法和比例法指导治疗,比较治疗效果。
固体比例法药敏试验:取培养基上的菌落制成1mg/ml的菌悬液,梯度稀释为10-2mg/ml、10-4mg/ml,接种 10-2mg/ml和 10-4mg/ml菌液0.01ml到含利福平、异烟肼、链霉素、乙胺丁醇的罗氏固体培养基及空白对照培养基,培养28d后观察结果。
Xpert MTB/RIF法检测:取1ml痰标本于前处理管中,加入2ml SR处理液震荡15~30s,静置15min液化,取2ml加入反应盒,放置到仪器检测模块,开始自动化检测,在检测系统窗口读取是否存在结核分枝杆菌以及结核分枝杆菌的利福平耐药性。
治疗:耐多药肺结核患者在药敏结果出来前选用耐药率低的抗结核药物进行治疗,药敏结果出来后根据药敏结果选择敏感药物进行化疗方案调整。收集治疗3个月和6个月时两组患者痰菌转阴和肺部影像学资料。
肺结核空洞变化和病灶吸收判定标准:患者于治疗前和治疗6个月时进行胸部X线正位片。空洞变化:原空洞消失为空洞闭合,空洞直径≤原空洞直径的1/2为空洞缩小,空洞无变化或增大<原空洞直径的1/2为空洞不变,空洞直径≥原空洞直径的1/2为空洞增大,空洞治疗有效率为(空洞闭合数+空洞缩小数)/总病例数×100%。病灶变化:病灶完全吸收或病灶基本完全吸收为病灶完全吸收,病灶吸收≥原来病灶的1/2为病灶显著吸收,病灶吸收<原病灶的1/2为病灶吸收,病灶扩大或无明显变化为无效,病灶吸收好转为(病灶完全吸收数+病灶显著吸收数+病灶吸收数)/总病例数×100%。
1.3 统计学方法 采用SPSS 20.0软件分析,计量资料以(x±s)表示,采用 t检验,计量资料以%表示,采用卡方检验,取P>0.05为差异有统计学意义。
2 结果
2.1 Xpert MTB/RIF法和比例法利福平耐药比较比例法检测出利福平耐药410例,耐药率34.2%,Xpert MTB/RIF法检测出利福平耐药422例,耐药率35.2%,以比例法为金标准,Xpert MTB/RIF法检测利福平耐药的灵敏度、特异度、阳性预测值、阴性预测值分别为 100.0%(410/410)、98.5%(778/790)、97.2% (410/422)、100.0% (778/778),Kappa值0.978,P=0.000,Xpert MTB/RIF法检测利福平耐药性与比例法一致性比较高。见表1。
2.2 利福平耐药和异烟肼、利福平同时耐药诊断耐多药结核分枝杆菌结果比较 利福平耐药410例患者中377例异烟肼耐药,以异烟肼、利福平同时耐药作为耐多药结核分枝杆菌的诊断标准,利福平耐药筛查耐多药结核分枝杆菌的灵敏度、特异度、阳性预测值、阴性预测值分别为100.0%(377/377)、96.0% (790/823)、92.0% (377/410)、100.0%(790/790),Kappa 值 0.938,P=0.000,利福平耐药筛查耐多药结核分枝杆菌与异烟肼、利福平同时耐药诊断的一致性比较高。见表2。
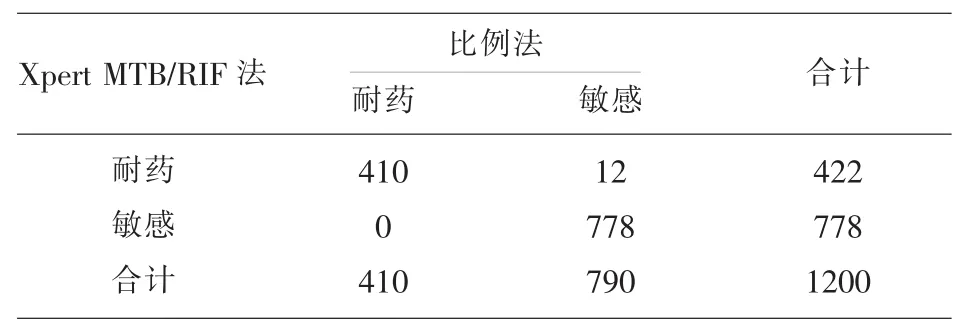
表1 Xpert MTB/RIF法和比例法利福平耐药比较
2.3 Xpert MTB/RIF组和比例法组指导肺结核治疗后痰菌转阴情况比较 Xpert MTB/RIF组和比例法组指导肺结核治疗,两组治疗3个月和治疗6个月痰菌转阴率比较差异无统计学意义(P>0.05)。见表3。
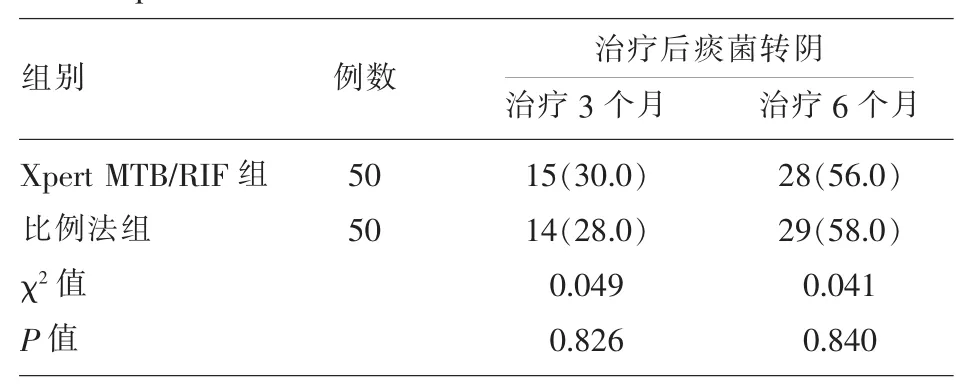
表3 Xpert MTB/RIF法和比例法指导治疗后痰菌转阴情况比较
2.4 Xpert MTB/RIF组和比例法组指导肺结核治疗后肺部空洞闭合和病灶吸收情况比较 治疗6个月时,Xpert MTB/RIF组和比例法组肺部空洞治疗有效率和病灶吸收好转率比较差异无统计学意义(P>0.05)。 见表 4。
3 讨论
涂片法和培养法是我国常规应用的结核病实验室诊断方法,涂片法检查结核病的灵敏度比较低,培养法虽然诊断结核病的灵敏度比较高,但耗时比较长,至少需要3~8周时间,并且需要标本中含有活菌,因培养法需要时间比较长,含有活菌的标本难以获得,会延迟结核病的诊治[5]。SAT-TB技术只检测活的结核分枝杆菌,无法检测是否耐药[6]。Xpert MTB/RIF是一种自动化、全封闭半巢式快速诊断结核病和结核分枝杆菌耐药的检测方法,该方法对结核分枝杆菌利福平耐药核心区间设计引物和探针进行PCR扩增,检测标本中是否含有结核分枝杆菌及是否对利福平耐药,该方法简单易学,检测时间短,约2h可出结果[7-9]。徐东芳等[10]研究发现Xpert MTB/RIF系统检测结核分枝杆菌的敏感性和液体培养法一致性较高,且高于直接涂片法,对利福平耐药性监测中,Xpert MTB/RIF系统检测的敏感性为94.59%,特异性为97.56%,与液体培养法药敏试验比较差异无显著性,表明Xpert MTB/RIF在结核分枝杆菌和利福平耐药性检测方面具有较高的应用价值。伊惠霞等[11]研究也发现Xpert MTB/RIF在结核分枝杆菌和利福平耐药性检测方面的应用价值比较高。本结果发现:比例法检测利福平耐药率为34.2%,Xpert MTB/RIF法检测利福平耐药率为35.2%,以比例法为金标准,Xpert MTB/RIF法检测利福平耐药的灵敏度、特异度、阳性预测值、阴性预测值分别为100.0%、98.5、97.2%、100.0%,Kappa 值 0.978, 可见,Xpert MTB/RIF法检测利福平耐药性与比例法一致性比较高。
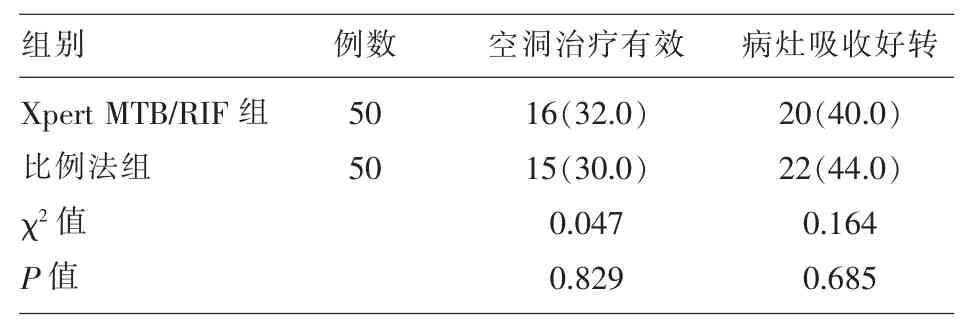
表4 Xpert MTB/RIF组和比例法组指导肺结核治疗后肺部空洞闭合和病灶吸收情况比较
耐多药结核分枝杆菌指结核分枝杆菌至少对异烟肼和利福平同时耐药,耐多药结核分枝杆菌对临床肺结核的治疗带来了困难[12-14]。传统的结核杆菌体外药敏实验可同时检测异烟肼、利福平、链霉素、乙胺丁醇4种抗结核药物的耐药性,但传统结核杆菌药敏试验需要时间比较长,无法达到快速诊断耐多药结核分枝杆菌的需要[15-17],近年来,基因芯片技术等[18,19]可同时检测异烟肼和利福平耐药,但检测步骤繁琐,需要时间2d左右,且价格比较昂贵,难以在一般实验室开展。Xpert MTB/RIF虽只能筛查利福平的耐药性,但研究发现用利福平耐药可作为筛选多耐药结核分枝杆菌的比较好的指标[20],余琴等[21]研究发现用利福平耐药诊断耐多药结核分枝杆菌的灵敏度和特异度分别为100.0%和98.53%;吴详兵等[22]研究发现利福平耐药作为耐多药结核分枝杆菌的筛查指标的灵敏度和特异度分别为100.0%和99.13%。本结果发现:利福平耐药筛查耐多药结核分枝杆菌的灵敏度、特异度、阳性预测值、阴性预测值分别为100.0%、96.0、92.0%、100.0%,Kappa值 0.938,可见,利福平耐药筛查耐多药结核分枝杆菌与异烟肼、利福平同时耐药诊断的一致性比较高。本文根据Xpert MTB/RIF药敏结果和固体比例法药敏实验结果指导耐多药肺结核患者治疗,结果发现两组患者治疗3个月和治疗6个月痰菌转阴率比较差异无显著性,治疗6个月时,肺部空洞治疗有效率和病灶吸收好转率比较差异无显著性。可见,根据Xpert MTB/RIF药敏结果可用于指导肺结核治疗。
综上所述,Xpert MTB/RIF简便、快速,可以准确检测利福平的耐药性,可作为耐多药结核分枝杆菌的快速筛查手段用于指导肺结核的临床治疗,Xpert MTB/RIF适合在临床肺结核的诊治中推广应用。
[1]El-Samadony H,Althani A,Tageldin MA,et al.Nanodiagnostics for tuberculosis detection[J].Expert Rev Mol Diagn,2017,17(5):427-443.
[2]Kumar N,Shreshtha AK,Patra S.The Metabolomic Strategy in?Tuberculosis Therapy[J].Comb Chem High Throughput Screen,2017,20(3):235-246.
[3]Cowan JF,Chandler AS,Kracen E,et al.Clinical Impact and Costeffectiveness of Xpert MTB/RIF Testing in Hospitalized Patients With Presumptive Pulmonary Tuberculosis in the United States[J].Clin Infect Dis,2017,64(4):482-489.
[4]Walters E,van der Zalm MM,Palmer M,et al.Xpert MTB/RIF on Stool Is Useful for the Rapid Diagnosis of Tuberculosis in Young Children With Severe Pulmonary Disease[J].Pediatr Infect Dis J,2017,36(9):837-843.
[5]Rufai SB,Singh S,Singh A,et al.Performance of Xpert MTB/RIF on Ascitic Fluid Samples for Detection of AbdominalTuberculosis[J].J Lab Physicians,2017,9(1):47-52.
[6]张慧慧,熊国亮.SAT技术检测肺结核患者痰标本中结核分枝杆菌的临床应用研究[J].实验与检验医学,2015,33(4):407-409.
[7]Tsuyuguchi K,Nagai H,Ogawa K,et al.Performance evaluation of Xpert MTB/RIF in a moderate tuberculosis incidence compared with TaqMan MTB and TRCRapid M.TB[J].J Infect Chemother,2017,23(2):101-106.
[8]李静,林日文,张灿强.Xpert MTB/RIF检测痰标本结核分枝杆菌与利福平耐受性的临床应用研究 [J].国际检验医学杂志,2017,38(4):480-482.
[9]Somily AM,Barry MA,Habib HA,et al.Evaluation of GeneXpert MTB/RIF for detection of Mycobacterium tuberculosis complex and rpo B gene in respiratory and non-respiratory clinical specimens at a tertiary care teaching hospital in Saudi Arabia[J].Saudi Med J,2016,37(12):1404-1407.
[10]徐东芳,王庆.Xpert MTB/RIF系统在结核分枝杆菌和利福平耐药性快速检测中的应用[J].检验医学,2017,(8):722-726.
[11]伊惠霞,侯新月,王泉,等.Xpert MTB/RIF系统快速检测结核分枝杆菌及利福平耐药性研究 [J].新疆医科大学学报,2014,37(12):1643-1646.
[12]Sogi KM,Lien KA,Johnson JR,et al.The Tyrosine Kinase Inhibitor Gefitinib Restricts Mycobacterium tuberculosis Growth through Increased Lysosomal Biogenesis and Modulation of Cytokine Signaling[J].ACS Infect Dis,2017,3(8):564-574.
[13]Gautam SS,Mac Aogáin M,Bower JE,et al.Differential carriage of virulence-associated loci in the New Zealand Rangipo outbreak strain ofMycobacterium tuberculosis[J].Infect Dis(Lond),2017,49(9):680-688.
[14]Song L,Jenner M,Masschelein J,et al.Discovery and Biosynthesis of Gladiolin:A Burkholderia gladioli Antibiotic with Promising Activity against Mycobacterium tuberculosis[J].J Am Chem Soc,2017,139(23):7974-7981.
[15]Jang JC,Jung YG,Choi J,et al.Bedaquiline susceptibility test for totally drug-resistant tuberculosis Mycobacterium tuberculosis[J].J Microbiol,2017,55(6):483-487.
[16]Shea J,Halse TA,Lapierre P,et al.Comprehensive Whole-Genome Sequencing and Reporting of Drug Resistance Profiles on Clinical Cases of Mycobacterium tuberculosis in New York State[J].J Clin Microbiol,2017,55(6):1871-1882.
[17]Yu X,Ma YF,Jiang GL,et al.Sensititre MYCOTB MIC plate for drug susceptibility testing of Mycobacterium tuberculosiscomplex isolates[J].Int J Tuberc Lung Dis,2016,20(3):329-334.
[18]刘朋冲,阎锡新,李志惠,等.基因芯片技术检测方法对耐多药肺结核治疗的指导价值研究 [J].临床肺科杂志,2014,19(4):682-685.
[19]韩珍,林日文,骆妙卡.线性探针技术和传统基因检测技术在耐药结核病诊断中的可靠性和及时性对比 [J].实验与检验医学,2015,33(2):150-153.
[20]Jayakumar A,Savic RM,Everett CK,et al.Xpert MTB/RIF Assay Shows Faster Clearance of Mycobacterium tuberculosis DNA with Higher Levels of Rifapentine Exposure[J].J Clin Microbiol,2016,54(12):3028-3033.
[21]余琴,俞南,林楠,等.北京市朝阳区367例结核病患者耐药情况分析[J].中国卫生检验杂志,2015,25(22):3964-3966+3969.
[22]吴祥兵,李娜,蔡明明,等.应用Xpert MTB/RIF技术快速筛查耐多药肺结核[J].预防医学,2017,29(7):754-756.
