HISCL-5000高敏发光酶免疫分析仪性能评价及定量检测感染性标志物临床应用
2018-04-25王晓萌辛颖张乐颜艳胡静仪张飚
王晓萌,辛颖,张乐,颜艳,胡静仪,张飚
(天津市环湖医院检验科,天津市脑血管病和神经变性重点实验室,天津 300350)
按照医学实验室认可和医疗机构临床实验室管理办法的要求,临床实验室所用的方法、仪器等应保证检验结果的准确可靠,临床实验室应对所用的仪器和方法学进行性能验证和评价,以保证所选用的方法、试剂、仪器达到临床性能、分析性能和经济性能等各方面的要求[1,2]。因此对本院新购买的Sysmex HISCL-5000全自动高敏发光免疫分析仪分别从携带污染率、批内精密度、日间精密度、线性范围、检出限等方面进行性能验证,并对临床标本检测结果进行了分析。
1 材料与方法
1.1仪器与试剂 全自动高敏发光免疫分析仪HISCL-5000及原装配套试剂、校准品和质控品,由日本Sysmex医学电子(上海)有限公司提供。检测项目:乙型肝炎表面抗原(HBsAg)、乙型肝炎表面抗体(HBsAb)、乙型肝炎 e 抗原(HBeAg)、乙型肝 炎 e抗 体 (HBeAb)、 乙 型 肝 炎 核 心 抗 体(HBcAg)、丙型肝炎抗体(HCV-Ab)、梅毒螺旋体抗体(TP-Ab)。 HBsAg、HCV-Ab 和 TP-Ab 胶体金标记试剂由上海科华公司提供。
1.2 验证方法
1.2.1 携带污染率验证 参照卫生部 《临床血液学检验项目的分析质量要求》行业标准,选取HB-sAg>2000IU/ml的高浓度血液样本和 HBsAg<0.03IU/ml低浓度血液样本,连续测定3次,测定值分别记为 H1、H2、H3 和 L1、L2、L3。 按公式:携带污染率=|(L1-L3)|/(H3-L3)计算携带污染率。
1.2.2 批内精密度验证 参考美国CLSI EP15-A2指南文件[3],分别选取各验证项目高浓度和低浓度的临床血清样本2份,重复检测20次,计算20次检测结果的算术平均值(MEAN)、标准差(SD)和变异系数(CV)。以精密度CV值小于或等于厂商给定的10%为判断标准。
1.2.3 日间精密度验证 参考美国CLSI EP15-A2指南文件,使用高低2个浓度水平的质控品,每天至少检测4次,连续检测5d,计算Mean、SD和CV值。
1.2.4 线性验证 参考美国CLSI EP6-A指南文件[4],进行HBsAg和HBsAb线性试验,选取高值、中值、低值临床样本,将样品按100%、80%、60%、40%、20%、0%的比例进行稀释,每个稀释度重复测定2次,计算均值。结果进行线性回归分析,计算y=ax+b,计算相关系数r和决定系数R2。
1.2.5 检出限验证 参考CLSI EP15-A2文件,用厂商配套校准品和稀释液,将浓度为0.25IU/ml的HBsAg和10mIU/ml的HBsAb的校准品对倍稀释成5个浓度系列,作为验证的样本,每个浓度连续检测20次,计算CV,CV<20%最低浓度为检测限。
1.2.6 HISCL-5000分析仪检测临床样本结果分析常规检测2016年5月至2016年11月天津市环湖医院。门诊及住院患者临床样本11785例,其中HBsAg、HCV-Ab和TP-Ab阳性样本,应用胶体金方法进行重复检测。
1.2.7 统计学分析 应用SPSS 16.0软件进行数据处理及统计学分析,计数资料以例数或百分率表示,两种方法检测阳性率比较采用配对卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 携带污染率验证结果 根据仪器厂家要求携带污染率<1.0%为合格,检测结果见表1。
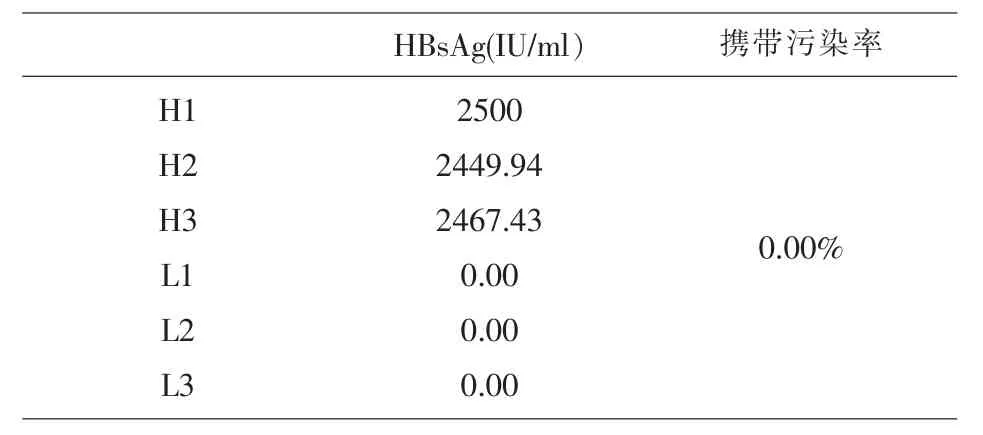
表1 HISCL-5000分析仪携带污染率验证结果
2.2 批内精密度验证结果 各项目检测结果见表2,所有项目检测结果均符合仪器厂商规定批间CV≤10%的要求。

表2 HISCL-5000分析仪批内精密度验证结果
2.3 日间精密度验证结果 日间精密度验证结果见表3,所有项目结果均符合仪器厂商规定日间精密度CV≤10%的要求。
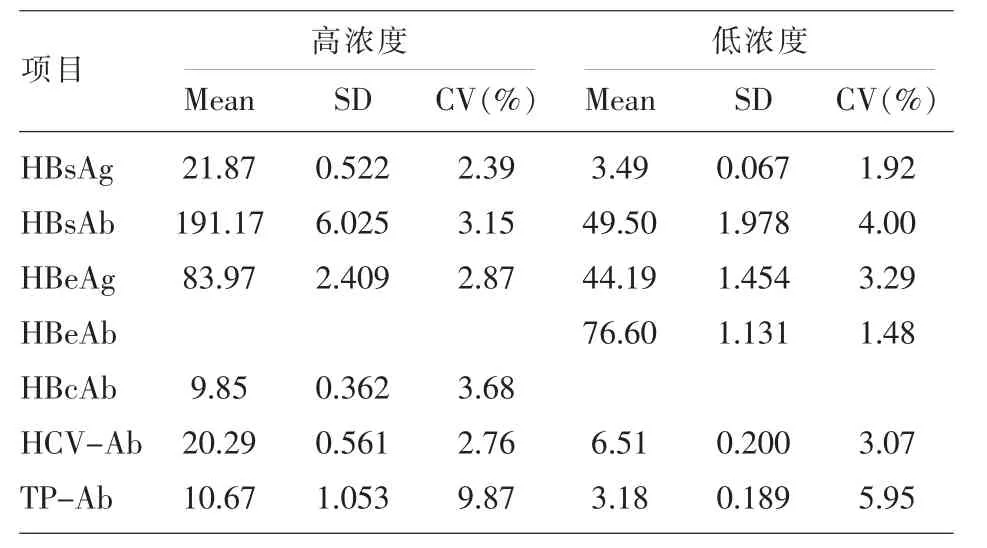
表3 HISCL-5000分析仪日间精密度验证结果
2.4线性验证结果 选取的高值、中值、低值浓度分 别 为 2371.27IU/ml,146.16IU/ml,19.26IU/ml 三份HBsAg阳性标本;和浓度为 718.75IU/ml,134.0IU/ml,36.25IU/ml三份HBsAb阳性标本。按照100%、80%、60%、40%、20%、0%的比例稀释后。每个浓度检测两次取平均值,进行线性回归分析,检验HBsAg和HBsAb检测系统的稀释线性,要求a值范围1±0.05,r≥0.95。两个项目三个浓度稀释后都呈现较好的线性相关性,其线性方程和相关系数见表4。
2.5 检测限验证结果 HBsAg和HBsAb定值标准品用配套稀释液稀释为规定浓度,进行重复检测,结果见表5。本次验证HBsAg和HBsAb检测下限分别为0.0071IU/ml和0.306mIU/ml,低于厂家声称的 0.03IU/ml和 5mIU/ml。
2.6 HISCL-5000分析仪检测临床样本感染性标志物结果分析 HISCL-5000分析仪检测11785例临床 患 者 HBsAg、HBsAb、HBeAg、HBeAb、HBcAb、HCV-Ab、TP-Ab等指标,其中HbsAg阳性331例,阳性率2.81%(331/11785),结果在 0.03-5.0IU/ml范围内的39例,占HBsAg阳性标本的11.78%(39/331),大于或等于5.0IU/ml 292例,占阳性标本的88.22%(292/331);HCV-Ab 阳性 88例, 阳性率0.75(88/11785),TP-Ab 阳性 147 例,阳性率 1.25%(147/11785)。乙肝五项检出模式见表 6,HBsAg、HCV-Ab、TP-Ab阳性结果均经快速胶体金标记法进行复检,HISCL-5000检测阳性的HBsAg、HCVAb和TP-Ab标本,胶体金方法检测分别有9例、12例和11例阴性,两种方法符合率见表7。
3 讨论
乙型肝炎、丙型肝炎和梅毒分别是由乙型肝炎病毒、丙型肝炎病毒和苍白螺旋体感染引起的严重危害人类健康的重要传染病。乙型肝炎病毒和丙型肝炎病毒的靶器官是人体肝脏,病毒可损伤肝细胞,导致细胞坏死死亡,最终可引起肝硬化和肝癌[5,6]。梅毒可经性接触和血液传播,感染后可引起全身系统性症状,近年来梅毒感染率在我国有逐年上升趋势[7]。目前,手术、输血和各种穿刺前对 患 者 进 行 乙 肝 五 项 (HBsAg,HBsAb,HBeAg,HBeAb,HBcAb),HCV-Ab,TP-Ab 和 HIV-Ab 检测已成为患者就医过程中的必检项目。近年来对这些感染性标志物检测逐渐从定性的手工方法发展到自动化的化学发光法。高敏化学发光酶免疫分析仪5000(HISCL-5000)是一款新型全自动定量检测系统,该系统采用新型底物CDP-Star,增加了检测灵敏度,检测限更低,通过创新的B/F分离技术,最大限度降低非特异性反应,应用滤镜切换技术,提升了浓度检测线性范围,降低标本稀释频率,缩短测试时间和试剂成本,该设备可在运行过程中随时更换试剂和耗材,体现了仪器的高度智能化和分析测试的连续性,国内外已有文献报道了其临床应用[8,9]。
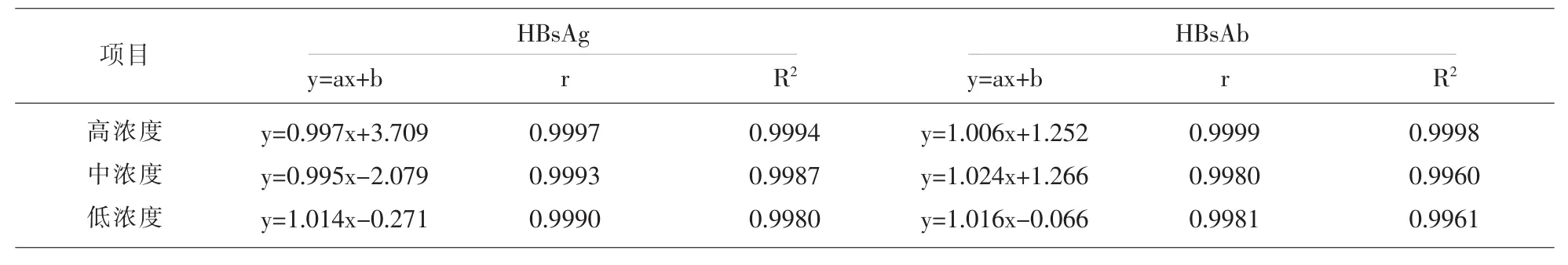
表4 HISCL-5000分析仪线性验证结果
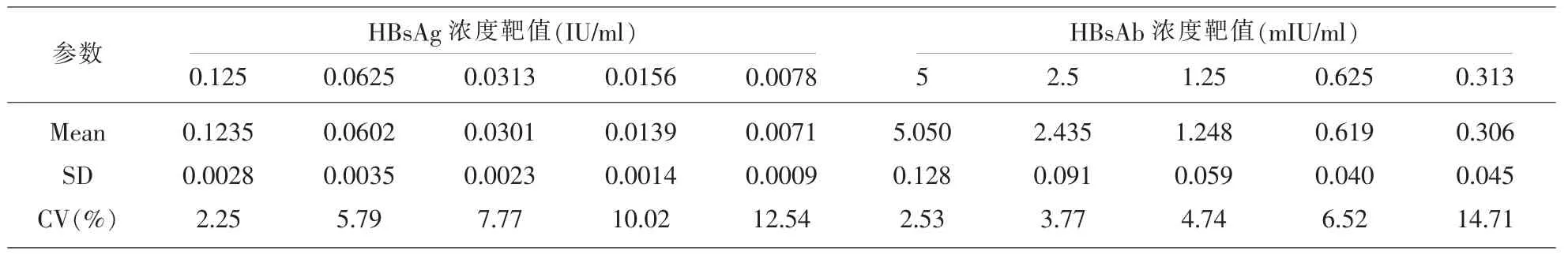
表5 HISCL-5000分析仪HBsAg和HbsAb检测限验证结果

表6 HISCL-5000分析仪检测HBsAg阳性模式

表7 HISCL-5000分析仪检测阳性结果与胶体金标记法检测结果比较
根据实验室管理和ISO5189的规范要求,新仪器应用前必须对其性能进行验证。因此本研究首先对HISCL-5000检测感染性标志物的性能进行验证,结果显示HISCL-5000分析仪携带污染率为0%,小于厂商要求的1%,表明该仪器可有效避免检测过程中的交叉污染,确保结果的准确性。除了TP-Ab批间精密度和日间精密度CV%分别为9.87%和5.95%外,其余项目批内和日间精密度CV%均小于5%,远小于厂商要求的10%,说明检测结果稳定,重复性好。HISCL-5000检测HBsAg和HBsAb高、中、低三个浓度线性范围,R2均大于0.99,说明被测物浓度在分析线性范围时,所测结果可信,更接近被测物质真值。因此HISCL-5000性能可满足医学实验室认可的要求和临床对感染性标志物定量检测的需求。
随后对HISCL-5000检测的11785例临床样本结果进行了分析,结果显示所检测患者HBsAg阳性率为2.81%,明显低于文献报道的全国一般人口的7.18%[10],慢性乙型肝炎联合治疗专家共识已经把HBsAg定量检测作为临床治疗慢性乙肝的参考指标[11],HBsAg定量也可以预测抗病毒治疗反应和肝细胞癌的发生[12]。因此准确地定量检测乙肝五项指标对于疗效评估和病情监测有重要意义。HCV-Ab阳性率为0.75%,与文献报道的结果相似[13,14],丙型肝炎是输血后肝炎的重要原因,定量检测对输血安全和有效避免医疗纠纷有重要意义。TP-Ab阳性率为1.25%,与我们以前报道的结果相符[15],低于文献报道的阳性率[13]。由于我院是神经科专科医院,因此HBsAg和TP-Ab阳性率低于综合性医院报道的阳性率可能与此有关。所有阳性结果应用胶体金标记方法复检,三项指标阳性标本,均存在部分胶体金结果阴性,提示作为快速检测方法的胶体金标记方法,敏感性较HISCL-5000差,存在一定的漏检率。
总之,HISCL-5000高敏发光酶免疫分析仪具有灵敏度高、特异性强、线性范围宽、携带污染低、检测反应时间短、自动化程度高等优点,可以很好地满足临床对感染性指标的定量要求,能更好地用于患者病情监测和疫苗接种效果评价,HISCL-5000能为临床乙型肝炎、丙型肝炎和梅毒的诊断、治疗、动态监测和疗效评估提供准确的科学依据。
[1]魏昊,丛玉隆.医学实验室质量管理与认可指南[M].北京:中国计量出版社.2004.59-75.
[2]中国合格评审国家认可委员会.医学实验室质量和能力认可准则(ISO15189:2012)[S].2013.
[3]CLSI.User demonstration of performance for precision and accuracy,in Approved guideline-second Edition(EP15-A2)[S].2004.
[4]CLSI.Evaluation of the linearity of quantitative measurment procedures:a statistical approach,in approved guideline (EP6-A)[S].2003.
[5]Bitton Alaluf M,Shlomai A.New therapies for chronic hepatitis B[J].Liver Int,2017,36(6):775-782.
[6]Ohnishi M,Higuchi A,Matsumura H,et al.Involvement of Ornithine Carbamoyltransferase in the Progression of Chronic Hepatitis C and Liver Cirrhosis[J].Int J Med Sci,2017,14(7):629-638.
[7]陶长余,章士军,陈郁.2005-2014年我国梅毒发病率趋势分析及预测[J].职业与健康,2015,31(21):3026-3029.
[8]Feng S,Wei B,Rao C,et al.Clinical Evaluation of the Newly Developed HISCL-5000 Analyzer on Detection of Hepatitis B Virus Markers in West China Hospital[J].Clin Lab,2016,62(6):1053-60.
[9]饶郴丽,丰姝,魏彬,等.高敏发光技术定量检测乙型肝炎病毒表面抗原的临床应用[J].中华检验医学杂志,2015,38(8):537-542.[10]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南[J].临床肝胆病杂志,2015,31(12):1941-1960.
[11]慢性乙型肝炎联合治疗专家委员会.慢性乙型肝炎联合治疗专家共识[J].中国肝脏病杂志(电子版),2012,4(1):39-46.
[12]Kim SE.Quantitative hepatitis B surface antigen predicts the antiviral response and hepatocellular carcinoma development in patients with chronic hepatitis B[J].Korean J Intern Med,2017,32(4):631-633.
[13]刘彩玲,古旭东,周菊琳.手术前及输血前血清感染性标志物检测7100例结果分析[J].实验与检验医学,2010,28(4):421.
[14]王青,梁晓峰,陈园生.丙型病毒性肝炎的研究近况[J].国际检验医学杂志,2006,27(4):349-351.
[15]吕丽霞,阚鹏程,朱彧,等.36151例神经系统疾病住院患者梅毒螺旋体抗体检测结果分析 [J].中华传染病杂志,2015,33(7):426-427.
