VEGFR-1、VEGFR-2和HGF表达情况与乙肝发病相关性及作用机制分析
2018-04-25刘圆方樊宏伟高改云倪猛李静
刘圆方,樊宏伟,高改云,倪猛,李静
(南阳市中心医院消化内科一病区,河南 南阳473000)
乙型肝炎病毒(Hepatitis B virus,HBV)可通过多种途径侵入人体,进而诱发多种感染,而其感染结果常取决于患者的年龄。另外,相关研究[1]发现宿主免疫因素也在HBV的感染过程中具有重要地位。肝脏出现病变时,肝细胞死亡后新的肝细胞再生,其刺激再生体液主要来自肝外组织、肝脏以及肝内有肝细胞生长因子(Hepatocyte growth factor,HGF)和胰岛素生长因子。刘哲[2]的研究已证实HGF可加强对肝损伤的保护并可作为肝损伤的重要判断指标。
相关资料[3]显示血管的成熟和新生在肿瘤的发生、发展过程中作用显著,其中血管内皮生长因子受体(Vascular endothelial growth factor,VEGFR)-1、VEGFR-2、VEGF及HGF均于血管新生具有密切联系。肝脏具有较强血液运输能力,其相关因子的调控作用对于维持肝脏的正常功能具有重要作用。上述因子关于肝癌的研究较多,但关于乙肝的相关研究相对较少。因此,本研究探究了VEGFR-1、VEGFR-2和HGF表达情况与乙肝发病相关性分析及作用机制,取得了较好的结果。现报告如下。
1 资料与方法
1.1 研究对象 选取我院在2016年1月至2017年7月期间收治的、符合纳入标准的CHB患者80例。CHB患者年龄22~74岁,平均年龄 (37.25±10.17)岁;男性57例,女性23例;根据分组标准分为:⑴抗病毒组(n=14):HBeAg 阳性(或阴性)患者经我院治疗后ALT恢复正常,HBeAg血清转换,PCR检测未发现HBV DNA;⑵HBeAg阳性组(n=24):血清 ALT 升高>60U/L,抗-HBe 阴性,肝组织学检查肝炎病变;⑶HBeAg 阴性组(n=24):HBeAg阴性,抗-HBe阴性或阳性,HBsAg和HBV DNA阳性,血清 ALT 异常>60U/L;⑷肝衰竭组(n=18):符合中华医学会肝病学分会及中华医学会感染病学分会联合制定的肝衰竭诊疗指南[4]。所有病例均排除酒精性肝炎、脂肪性肝炎、肝炎病毒感染、药物性肝炎及其他疾病。同期选择我院门诊体检并注射乙肝疫苗者22例(对照组),其中男性15例,女性 7例;年龄 24~47岁,平均年龄(28.13±10.52)岁;对照组患者肝功能均正常,无肝炎病毒感染,无急、慢性疾病。本研究获我院伦理委员会批准通过,所有患者及其家属均知情同意,并签署相关知情同意书。
1.2 方法
1.2.1 血清HBVM检测 定量检测使用免疫荧光分析法检测血清HBVM浓度;定性检测使用酶联免疫吸附试验(ELISA)检测血清HBVM浓度。试剂盒购于深圳匹基生物工程公司。
1.2.2 HBV DNA检测 荧光定量PCR法检测HBV DNA水平,试剂盒购于南京建成生物研究所。
1.2.3肝功能检测 全自动生化分析仪 (型号OLYMPUSAU,美国GE公司生产)检测患者肝功能。
1.2.4 HGF检测 酶联免疫吸附试验(ELISA)检测HGF水平,试剂盒购于美国Bio-Rad公司。
1.2.5 VEGFR-1及VEGFR-2检测 使用我院液相悬浮芯片系统(型号Luminex200,德国西门子公司生产),对血浆样本进行检测,相关细胞因子试剂盒均购于美国Bio-Rad公司。
1.3 统计学方法 采用SPSS 22.0,计量资料以平均值±标准差表示,运用t/F检验判断其差异程度;计数资料以构成比形式表示,运用χ2/Fisher确切概率法检验判断其差异程度,采用Spearman等级相关检验其相关性,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组VEGFR-1、VEGFR-2及HGF水平 五组VEGFR-1、VEGFR-2及HGF水平差异均具有统计学意义(F=7.50、6.75、27.84,P<0.01);组间比较发现抗病毒组VEGFR-1水平均低于HBeAg阳性组、HBeAg阴性组及肝衰竭组,差异具有统计学意义(P<0.05);对照组VEGFR-2及HGF均低于抗病毒组、HBeAg阳性组、HBeAg阴性组及肝衰竭组,差异具有统计学意义(P<0.05);抗病毒组HGF水平均低于HBeAg阳性组、HBeAg阴性组及肝衰竭组,差异具有统计学意义(P<0.05);HBeAg阳性组HGF水平均低于HBeAg阴性组及肝衰竭组,差异具有统计学意义 (P<0.05);HBeAg阴性组HGF水平均低于肝衰竭组,差异具有统计学意义 (P<0.05),见表 1。
2.2 病毒载量与VEGFR-1、VEGFR-2及HGF水平 高病毒载量组的VEGFR-1、VEGFR-2及HGF水平均高于低病毒载量组,差异具有统计学意义(t=11.14、10.98、2.72,P<0.01),见表 2。
2.3 VEGFR-1、VEGFR-2及HGF水平与肝功能指标、HBV DNA的相关性 经Spearman等级相关检验分析发现,VEGFR-1、VEGFR-2及HGF与ALT、AST 及 Tbil均呈正相关关系 (r=0.29、0.52、0.37、0.48、0.59、0.70、0.53、0.55、0.33,P<0.05);VEGFR-1、VEGFR-2及HGF与HBV DNA无相关性(r=0.13、0.19、0.15,P>0.05);VEGFR-1 与 VEGFR-2 及 HGF呈正相关关系 (r=0.53、0.68,P<0.05);VEGFR-2 与HGF 呈正相关关系(r=0.47,P<0.01)。
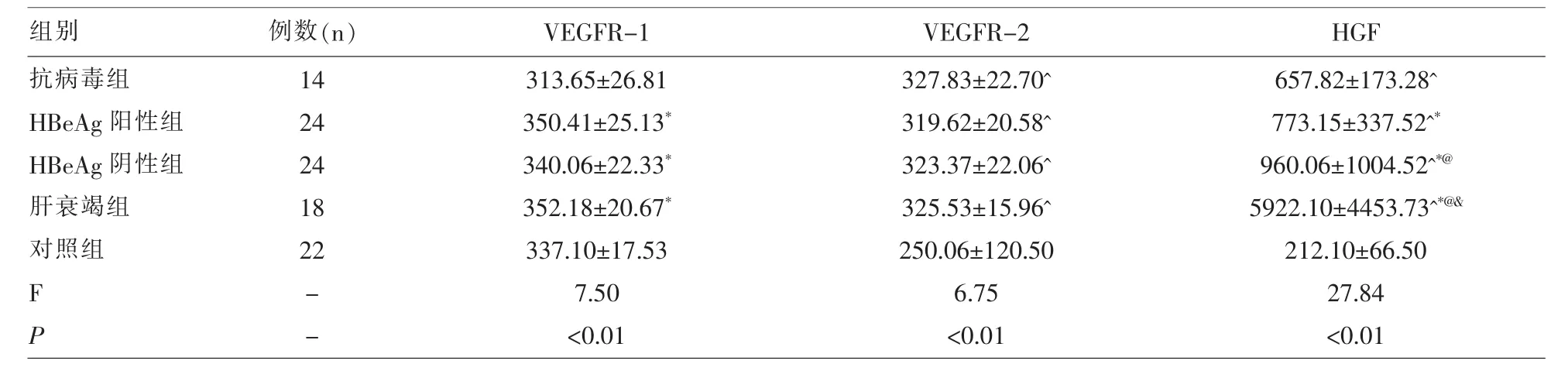
表1 各组VEGFR-1、VEGFR-2及HGF水平(x±s,pg/ml)

表2 病毒载量与VEGFR-1、VEGFR-2及HGF水平(x±s,pg/ml)
3 讨论
乙型病毒性肝炎是由HBV引起的、以肝脏炎性病变为主的一种疾病。此外,其还可能引起以肾脏为主的其它器官损害。据世界卫生组织报道,全球约20亿人曾感染乙肝病毒,其中2.4亿人为慢性乙肝病毒感染者,每年约有65万人死于乙肝病毒感染所致的肝衰竭、肝硬化和肝细胞癌(HCC)[5]。全球肝硬化和HCC患者中,由乙肝病毒感染引起的比例分别为30%和45%[6]。由此可见,乙肝已成为严重威胁人类健康的世界性疾病,也是我国当前流行最为广泛、危害性最严重的一种疾病。
乙肝发展的主要基础是血管新生。VEGF是调节血管新生最特异的细胞因子,亦是作用最强的因子,其可与VEGFR有效结合并发挥作用,进而调节内皮细胞增殖。HCG是具有促进细胞增殖和分裂的多功能细胞因子,有刺激体内血管的再生,对某些肿瘤的发生、转移和浸润同样具有重要影响作用[6,7]。VEGF及HGF因均参与肿瘤血管的心声,故与肝癌血管增生过度具有密切关系,此外在血管成熟过程中同样具有类似相同作用,进而存在出现一定的协同作用,进一步调控血管生成和血管内皮的通透[8]。但上述因子在肝癌的研究较多,关于乙肝的相关研究相对较少。故此,本研究探究了VEGFR-1、VEGFR-2和HGF表达情况与乙肝发病相关性分析及作用机制。
本研究发现五组 VEGFR-1、VEGFR-2及HGF水平差异均具有统计学意义(P<0.01);高病毒载量组的VEGFR-1、VEGFR-2及HGF水平均高于低病毒载量组,差异具有统计学意义 (P<0.01)。上述结果提示随着乙肝的病毒的浸润及程度的加深,VEGFR-1、VEGFR-2及HGF水平也逐渐升高。我们认为VEGFR-1、VEGFR-2及HGF具有成为评价乙肝发展程度的生物学治疗的重大潜力。随着乙肝程度的加深,VEGF表达升高,进而诱导相应血管新生,形成一个循环[9]。VEGFR-1、VEGFR-2均为VEGF受体,VEGFR-1主要在血管内皮细胞和巨噬细胞上表达,VEGFR-2主要在肝细胞、肝癌细胞及血管内皮细胞上表达,钟武[10]的研究发现肝癌组织的VEGFR-1、VEGFR-2表达率显著高于癌旁组织,这提示VEGFR-1、VEGFR-2在肿瘤组织的发展过程中具有重要作用。HGF最先在重型肝炎患者中纯化,并逐渐在肝硬化几慢性肝炎患者的腹水中发现,各种肝脏疾病均可诱发HCG的表达,Kanazawa H[11]认为肝病患者HCG水平的变化可有效反映肝细胞修复和坏死的程度。肝硬化和慢性重症肝炎患者因肝脏代谢能力下降HCG的被清除率也随之下降,此外一些相关炎性因子的浓度升高刺激非实质细胞加速合成HGF,进而导致 HCG 含量升高[12,13]。
经Spearman等级相关检验分析发现,VEGFR-1、VEGFR-2及 HGF 与 ALT、AST 及 Tbil均呈正相关关系 (P<0.05);VEGFR-1 与 VEGFR-2 及HGF 呈正相关关系(P<0.05);VEGFR-2 与 HGF 呈正相关关系(P<0.01)。 上述结果提示,VEGFR-1、VEGFR-2及HGF可作为判断乙肝疾病发展和预后的参考指标。肝脏出现炎症时,在多种炎症因子的刺激下可刺激肝星状细胞,并刺激VEGFR-1、VEGFR-2及HGF的合成[14]。此外,肝细胞产生的胰岛素生长因子也可刺激HCG的生成。因肝损伤好转后,激活的星状细胞可出现自发逆转,HCG水平随之下降,因而,临床常把HCG作为肝损伤的评价指标之一[15]。
综上所述,VEGFR-1、VEGFR-2和 HGF与乙肝发病密切相关。
[1]王玲,赵卫东.HIF-1α、VEGF、VEGFR-1、VEGFR-2 在稽留流产患者绒毛组织中的表达 [J].安徽医科大学学报,2015,13(2):227-231.
[2]刘哲,张晓梅,秦慧慧,等.肺纤方对肺间质纤维化大鼠VEGF及VEGFR1、VEGFR2基因表达的影响 [J].北京中医药大学学报,2014,37(11):753-757.
[3]朱丹,新吉夫,郭凯,等.VEGFR-1和VEGFR-2在氧诱导视网膜病变小鼠视网膜中表达的变化[J].中华实验眼科杂志,2015,33(1):42-46.
[4]徐江霞,龚淑琪,万振华,等.新型乙肝定量PCR试剂检测性能验证[J].实验与检验医学,2016,34(2):149-151.
[5]汤海玲,范丽梅,韩珍,等.乙肝相关肝癌各临床分期中血管新生相关因子的研究[J].中国药理学通报,2015,21(6):882-883.
[6]Nakagawa T,Matsushima T,Kawano S,et al.Lenvatinib in combination with golvatinib overcomes hepatocyte growth factor pathway-induced resistance to vascular endothelial growth factor receptor inhibitor[J].Cancer Science,2014,105(6):723-730.
[7]田雪飞,黄晓蒂,周青,等.归肝经中药作用于人肝癌细胞差异表达 蛋白酪氨酸激酶的筛选与分析 [J].中国中西医结合急救杂志,2015,22(3):227-233.
[8]Awada HK,Johnson NR,Wang Y.Dual delivery of vascular endothelial growth factor and hepatocyte growth factor coacervate displays strong angiogenic effects[J].Macromolecular Bioscience,2014,14(5):679.
[9]孙立,闫冬,原泉,等.血管内皮细胞生长因子可溶性受体1与慢性肾小球肾炎相关性研究 [J].中国实用内科杂志,2016,13(6):469-471.
[10]钟武,杨帆,陈睦虎,等.血管内皮细胞生长因子受体2在慢性静脉性溃疡组织中表达的研究 [J].重庆医学,2015,44(20):2756-2758.
[11]Kanazawa H,Tochino Y,Asai K,et al.Simultaneous Assessment of Hepatocyte Growth Factor and Vascular Endothelial Growth Factor in Epithelial Lining Fluid From Patients With COPD[J].Chest,2014,146(5):1159-1165.
[12]陶鹏辉.乙型肝炎病毒感染者血清HBV DNA与IL-21及IFN-γ水平的相关性[J].实验与检验医学,2017,35(3):347-350.
[13]El-Gohary AM,Attia FM,Eldin ARG,et al.Vascular endothelial growth factor mRNA expression can be a marker for response to antiviral treatment of HCV [J].Comparative Clinical Pathology,2014,23(4):923-928.
[14]姚杨,苏杰,徐锐,等.水通道蛋白1与血管内皮生长因子在乙肝相关性肝癌中的表达及其意义 [J].实用医学杂志,2015,21(19):3189-3192.
[15]莫之婧,李康智,马义丽,等.基于基因表达谱分析的乙肝阳性转移性肝细胞癌的分子机制分析 [J].基因组学与应用生物学,2017,31(4):1272-1279.
