大豆凝集素的分离纯化及血凝效果研究
2018-04-25湛润生纪丽颖邢宝龙张旭丽
湛润生,纪丽颖,邢宝龙,张旭丽
(1.山西大同大学生命科学学院,山西大同037009;2.山西大同大学设施农业技术研发中心,山西大同037009;3.山西省农业科学院高寒区作物研究所,山西大同037008)
凝集素(agglutinin)是一类含糖(少数例外)并能与糖专一结合的蛋白质,它具有凝集细胞和刺激细胞分裂的作用,广泛存在于各种真菌、无脊椎动物、脊椎动物、人体以及某些病毒体内。常用的植物凝集素(PNA),通常以其被提取的植物命名,如麦胚凝集素(WGA)、花生凝集素(PNA)、大豆凝集素(SBA)等[1-4]。在细胞表面,组成细胞膜的糖脂和糖蛋白伸出寡糖链,形成细胞外被(又被称为糖萼)。凝集素能与细胞外被中的糖分子连接,在细胞间形成“桥”,从而引起细胞凝集[5-6]。
大豆凝集素(soybean agglutinin,SBA)是最早被描述的植物凝集素之一,利用凝集素与不同的糖蛋白特异性结合的原理,大豆凝集素在糖生物化学、血型鉴定、生物医药等领域有着广泛应用[7-11]。同时作为大豆中主要抗营养因子之一,大豆凝集素可对动物肠壁、刷状缘酶活性、小肠黏膜细胞代谢、肠道细菌生态物质代谢及免疫机能产生一定的影响[12]。因此开展大豆凝集素提取工艺及凝集活性检测实验尤为重要,本实验采用生理盐水提取的方法分离纯化得到大豆凝集素样品,并对其血凝活性进行了研究,旨在探索不同大豆凝集素含量的差异。
1 材料与方法
1.1 实验材料
大豆由山西省农业科学院高寒区作物研究所提供,分别是晋科5号、晋豆25号、长豆34号、晋遗57号和晋遗59号。
1.2 主要试剂
0.9 %NaCl溶液;肝素钠注射液(河南省国药医药有限公司)。
1.3 主要仪器
冷冻离心机(安徽中科中佳科学仪器有限公司);电子天平(上海精科天美科学有限公司);生物显微镜CKX41(日本OLYMPUS公司);分光光度计(上海博迅实业有限公司);高压蒸汽灭菌锅(江阴滨江医疗设备有限公司)。
1.4 实验方法
主要依据参考文献[13-15]进行。
1.4.1 大豆中凝集素的提取及其纯化
称取不同品种大豆10g,用0.9%NaCl溶液清洗干净,加入100 mL 0.9%NaCl溶液在4℃的冰箱中浸泡24h,用研钵将大豆研碎。在大豆粉中加入100 mL 0.9%NaCl溶液,置于4℃冰箱中放置一夜抽提。将大豆混合物用4层纱布过滤,将过滤好的滤液放到5 000 r∕min冷冻离心机中离心20 min。将上清液转移到烧杯中,4℃的冰箱中保存备用。
1.4.2 红细胞悬液的制备
以无菌方法抽取兔耳缘静脉血液(5 mL注射器先吸取3 mL 1%肝素溶液)1 mL,用0.9%NaCl溶液洗涤5次,每次3 000 r∕min离心5 min,最后按沉淀红细胞体积用0.9%NaCl溶液配成2%红细胞悬液。
1.4.3 血凝反应的测定
吸取大豆凝集素提取液和红细胞悬液各1滴在载玻片上,充分混匀,静置15 min,在光学显微镜下观察凝集效果。并用0.9%NaCl溶液作为空白对照,观察凝血效果。
1.4.4 凝集素相对含量的测定
1)将相同体积试管洗净灭菌后烘干称重,然后向各管内分别加入不同品种大豆凝集素提取液5 mL,并且用0.9%NaCl溶液做对照实验。
2)在各试管内同时加入1 mL的2%的红细胞悬液,充分摇晃均匀,15 min内观察红细胞的凝集情况。
3)在其中一种豆子中的红细胞团最先完全积淀的同一时刻,取出每个试管中的一部分上液,使每一个试管内的溶液都维持在同一刻度。与此同时再向各个试管内取2 mL的溶液于比色皿中,于分光光度计内测定其在620 nm时的吸光度值(OD)。
4)将每个试管中的溶液全部用胶头滴管取出,此时试管中只有红细胞凝块,然后再将试管放入烘干箱内烘干后称重。
1.4.5 凝集程度的判别与记录
试管内的溶液是清澈的,液体内的血红细胞在试管底部完全凝集后,轻轻摇晃试管时,可在试管内见到大的凝块,为高度凝集(++);试管内的液体浑浊,试管底部可观察到较小的凝块,为轻度凝集(+);试管内的液体中的红细胞分布均匀,试管底部未观察到凝块,为不凝集(-)。
2 结果与分析
2.1 细胞凝集反应
吸取凝集素提取液和红细胞悬液各1滴在载玻片上,混均,静置15 min,观察结果见表1。
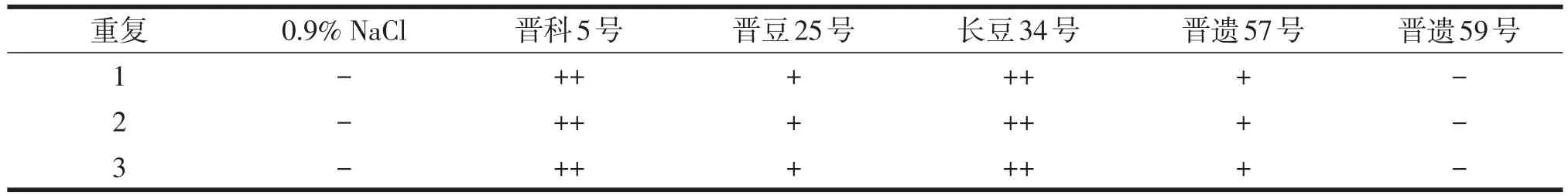
表1 凝集素提取液与2%的红细胞悬液的凝集反应情况
可以看出,除0.9%NaCl、晋遗59号外,其他4种大豆凝集素提取液都使得红细胞悬液有不同程度的凝集。晋科5号、长豆34号使得红细胞凝集程度最高,证明其凝集素含量最高;晋豆25号、晋遗57号使得红细胞凝集程度次之,证明其凝集素含量相对较低。
2.2 发生凝集反应后上清液的吸光值
发生凝集反应后,在各试管内取2 mL溶液放入比色皿中,于分光光度计内测定其在620 nm时的吸光值(OD)。见表2。

表2 凝集素与2%红细胞悬液作用后上清液吸光值
当大豆中凝集素含量高时,凝集素使得溶液中的红细胞大量凝集,发生凝集反应后溶液澄清,吸光度值较小;反之,当凝集素含量低时,溶液中的红细胞较少凝集,溶液浑浊,吸光度值较大。总体来说,不同品种大豆凝集素含量顺序为:晋科5号>长豆34号>晋豆25号、晋遗57号>晋遗59号。
2.3 凝集红细胞沉淀的干重
发生凝集反应后,用胶头滴管将试管内的溶液全部吸走,试管内余下红细胞凝块,将试管及血凝块一起放入烘干箱内烘干称重。
大豆中凝集素含量较高时,实验中血凝反应效果明显,红细胞的凝集团较大,最后所得凝集红细胞沉淀的干重较大。反之,凝集素含量低时,血凝反应的效果不明显,红细胞的凝集团较小,最后所得沉淀的干重较小。凝集素含量顺序为,晋科5号>长豆34号>晋豆25号>晋遗57号>晋遗59号。见表3。

表3 凝集红细胞沉淀的干重/mg
3 讨论与结论
本实验采用山西省广泛种植的几种大豆为实验材料,以0.9%NaCl溶液为提取剂。经过简单的前期提取过程,通过观察红细胞凝集状况,来初步区分凝集素含量的高低;再通过测定吸光度值和凝集红细胞干重,来进一步区分不同品种大豆凝集素相对含量的高低。实验过程表明,0.9%NaCl溶液作为提取剂对凝集素的活性影响较小,所得结果准确;兔血对血液的凝集反应也有较高的灵敏性。同时实验结果表明,不同品种大豆凝集素含量区分明显,晋科5号含量最高,长豆34号含量含量次之,晋豆25号和晋遗57号含量相对较低,晋遗59号含量最低。相信随着科技不断发展,新技术的不断涌现,今后对于大豆凝集素的提取方法会越来越精确,同时也会发现越来越多的关于大豆凝集素在生物学方面的应用。
[1]翟中和,王喜忠,丁明孝.细胞生物学[M].4版.北京:高等教育出版社,2011.
[2]王崇英,高清祥.细胞生物学实验[M].3版.北京:高等教育出版社,2011.
[3]湛润生,戎婷婷,白静.血凝法测定绿豆与红小豆中植物凝集素质量分数[J].食品科技,2017,42(4):277-279.
[4]Nathan S,Halina L.History of lectins:from hemag-glutinins to biological recognition molecules[J].Glycobiology,2004,14(11):53R-62R.
[5]杨远和.植物凝集素的主要生物学作用及应用[J].生物学杂志,1994,12(2):1-3.
[6]Florin I,Carmen I,Aneta P.Effects of plant lectin and extracts on adhesion molecules of endothelial progenitors[J].Cent Eur J Biol,2011,6(3):30-34.
[7]Godlewski M M,Slazak P,Zabielski R,et al.Quantitative study of soybean-induced changes in proliferation and programmed cell death in the intestinal mucosa of young rats[J].Can J Physiol Pharmaco,2006,57(7):125-133.
[8]王幸,马秋枝,刘强.大豆凝集素的分离纯化和血凝活性研究[J].家畜生态学报,2006,27(6):57-60.
[9]车东升,刘飞飞,穆成龙,等.大豆凝集素的分离纯化及活性鉴定[J].吉林大学学报(理学版),2012,50(5):1041-1044.
[10]王逸群,荆玉祥.豆科植物凝集素及其对根瘤菌的识别作用[J].植物学通报,2000,17(2):127-132.
[11]张柏林,秦贵信,刘宁,等.大豆凝集素结构及其活性测定方法的研究进展[J].大豆科学,2009,28(1):160-163.
[12]吴莉芳,秦贵信,孙玲,等.大豆凝集素及其对动物健康的影响[J].大豆科学,2007,26(2):259-263.
[13]荆剑,赵翔,张页.大豆凝集素的纯化及其凝集不同肿瘤细胞的探讨[J].中国生物化学与分子生物学报,2003,19(3):401-405.
[14]于敏,王志德,董志芳.植物凝集素(PHA)的提取及血凝效果研究[J].安徽技术师范学院学报,2002,16(1):23-25.
[15]Dai D Z,Chen M Y,Ye J,et al.Quanti fi cation of Lectins in feed by hemagglutination[J].Chinese Journal of Veterinary Science,2005,25(4):438-440.
