内镜黏膜下剥离术衍生技术内镜黏膜下挖除术在消化道神经内分泌肿瘤中的应用*
2018-04-25周震宇王小云龚镭唐学军彭晓斌吴高珏胡臻
周震宇,王小云,龚镭,唐学军,彭晓斌,吴高珏,胡臻
(南京医科大学附属无锡二院 消化内科,江苏 无锡 214000)
消化道神经内分泌肿瘤(neuroendocrine tumor,NET)是指一类起源于肽能神经元和神经内分泌细胞、相对少见、但发病率不断上升的肿瘤,其中以胃肠胰腺NET最为常见[1]。据统计,美国肺和胃肠胰NET的发病率为5.25/10万,比30年前增高约5倍[2]。胃肠NET起病隐匿,很多患者发现时即有远处转移。因此,早期发现、早期诊断和早期治疗是十分重要的。对于胃肠NET大多数病变处于G1或者G2,早期发现,安全有效切除,对于疾病预后有重要意义。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)目前已在消化道早癌上获得广泛的实践,并进入临床治疗指南[3-4]。以ESD衍生技术内镜黏膜下挖除术(endoscopic submucosal excavation,ESE)治疗消化道NET,可以完整剥离病灶,可作为消化道NET的治疗手段[5],并为病理检查提供完整标本。本文回顾性研究2014年1月-2017年2月ESE治疗的23例消化道NET,并评估其安全性及有效性。
1 资料与方法
1.1 一般资料
所有患者签署知情同意书。入选标准为:①病灶位于食道、胃、十二指肠及结肠、直肠;②术后标本免疫组化提示NET。23例均采用ESE方法治疗,其中男13例、女10例,年龄38~74岁,中位年龄55岁。肿瘤位于胃3例,乙状结肠3例,直肠17例,本组患者均无特异性临床症状,其中3例存在腹部隐痛不适,其余均是在内镜检查时偶然发现,23例患者均无NET综合征的表现。所有患者术前常规行超声内镜检查明确肿瘤大小、侵犯深度、周围有无淋巴结转移,行胸、腹、盆腔增强CT扫描明确有无周围组织、肝或肺转移。
1.2 方法
1.2.1 器械 ERBE VIO 200D高频电切装置和APC300氩离子凝固器;Olympus GIF-Q260J,Olympus GIF-2TQ260M胃 镜,Olympus GIF-PCF-Q260JI肠 镜,EU-M 30内镜超声系统,微超声探头采用UM-2R和UM-3R,频率分别为12和20 MHz;NM-4L-1注射针,KD-620LR Hook刀,KD-611L IT刀,KD-650L Dual刀及FG-8U-1异物钳,SD-230U.20圈套器,FD-410LR热活检钳,ROCC-D-26-195止血夹,D-201.11802透明帽,二氧化碳CO2气泵,MAJ-254尼龙绳。
1.2.2 超声内镜检查 胃镜检查或者肠镜检查发现消化道黏膜下隆起性病灶后,采用附冲水胃镜或者附冲水肠镜,以脱气水充盈法对病灶进行超声扫描,观察病灶大小、形状、来源层次、内部回声强度、边界以及有无淋巴结转移。内镜及CT检查结果见图1。
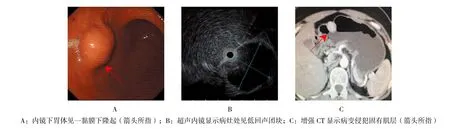
图1 内镜及CT检查结果Fig.1 The results of endoscopy and CT examination
1.2.3 ESE方法 对于诊断明确者,按标准步骤进行ESE术。上消化道病变治疗在气管插管、全身麻醉下进行,下消化道病变治疗在全身麻醉下进行,麻醉用药为丙泊酚,剂量为2.0~2.5 ml/kg,静脉推注。ESE治疗过程中内镜头端附加D-201.11802透明帽。①标记:应用APC、海博刀或Dual刀于病灶隆起边缘进行电凝标记,位于肠道病变也可以不标记;②黏膜下注射:多点黏膜下注射预先配制的0.4%靛胭酯+0.025 mg/ml肾上腺素+甘油果糖氯化钠混合注射液[6],一般于隆起病灶边缘标记点处进行注射,注射顺序是自远侧向近侧,可以重复注射;③切开病变外侧缘黏膜:应用Hook刀或者Dual刀沿瘤体边缘标记点处切开黏膜至黏膜下层,先切开病灶远侧黏膜,后切开病灶近侧黏膜;④借助透明帽显露瘤体,于瘤体外缘2 mm处沿黏膜下层对瘤体进行剥离挖除病变,如有浸润固有肌层,沿固有肌层对瘤体进行剥离,剥离时注意尽量保持瘤体包膜的完整,剥离过程中多次黏膜下注射,保持病灶与肌层分离,剥离过程中创面如有出血,应用切开刀直接电凝出血点,或应用电凝钳钳夹出血点电凝止血,对发现粗大血管可以采用热活检预止血;血管较多时可以采用单纯电凝模式剥离;⑤创面处理:切除病灶后对于创面可见的血管,应用APC或电凝钳凝固治疗,必要时应用金属止血夹缝合或部分缝合创面。具体操作步骤见图2。
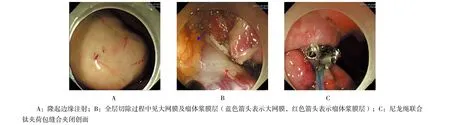
图2 ESE切除瘤体过程Fig.2 The progress of tumor resection by ESE
1.3 组织评价
所有切除病灶送病理检查,确定病变性质,观察病灶边缘和基底有无肿瘤累及以及脉管浸润。病理评价根据2010年第4版WHO消化系统肿瘤分类以及NET的命名和分类标准[7]。整块切除是指病变在内镜下整块切除,获得单块标本。完整切除是指病灶不仅整块切除,同时病理诊断外侧缘、基底无肿瘤侵犯。完整治愈切除指病灶在完整切除的基础上病理评估无脉管浸润侵犯。神经内分泌癌不纳入治愈切除标准。
NET包括神经内分泌瘤和神经内分泌癌。其中神经内分泌瘤:是高分化NET,由相似于相应正常内分泌细胞特征的细胞组成,表达神经内分泌分化的一般标志物(通常弥漫强阳表达嗜铬粒多肽CgA和突触小泡蛋白Syn)和部位相关的激素(常强表达但不弥漫),核异型性轻至中度;按增殖活性和组织学分为G1级和G2级(G1:核分裂象<2/10 HPF,Ki-67增殖指数≤2%,G2:2/10 HPF≤核分裂象≤20/10 HPF,2%<Ki-67增殖指数≤20%)。神经内分泌癌:低分化高度恶性肿瘤,由小细胞或大至中细胞组成,具有类似神经内分泌瘤的器官样结构,弥漫性表达神经内分泌分化的一般性标志物(弥漫表达突触素,弱局灶性表达CgA),有显著核异型性,多灶性坏死和核分裂象数高(>20/10 HPF,Ki-67增殖指数>20%)。胃NET临床分型为3型,1、2型胃NET分化良好,分化差的胃NET(多为胃神经内分泌癌)列入3型[8-9]。
1.4 并发症及术后处理
术后禁食1或2 d,予常规补液和止血药物,如有肌层损伤可以酌情使用抗生素3~5 d,观察排便情况、腹部体征。有效封闭创面,可以预防术后穿孔发生。如果由于肿瘤侵犯肌层,为保证瘤体完整切除所发生主动穿孔不计入并发症。如有迟发性出血(手术结束时无活动性出血,而在术后出现呕血、黑便或便血等症状[10]),及时内镜下止血。
1.5 随访
1个月后随访复查内镜,观察创面愈合情况。术后第1年每3个月行内镜、B超检查,第2年起每6个月、第3年起每年1次行内镜、B超,排除局部复发和远处转移。
2 结果
2.1 肿瘤切除情况
术前超声内镜显示22例肿瘤位于为黏膜下层,1例胃的病变侵犯固有肌层,主要表现为回声欠均匀的低回声肿块,周围无淋巴结转移。23例诊断为NET;肿瘤直径0.4~3.0 cm,中位大小1.0 cm。23例病变均一次性完整剥离,ESE手术时间(自黏膜下注射至完整剥离病变)20~75 min,中位时间30 min。ESE治疗过程中创面均有少量出血,中位出血量40 ml,均经电凝成功止血;1例(4.3%)术后出现迟发性出血,再次内镜下以金属夹止血成功。1例(4.3%)因病变位于胃体,侵犯固有肌层行全层切除,主动穿孔并采用尼龙绳及钛夹联合荷包缝合。23例侧切缘及基底切缘未见肿瘤组织残留,无脉管浸润。住院时间2~7 d,中位时间4 d。切除的瘤体大小约2.5 cm×3.0 cm,瘤体标本见图3。
2.2 术后病理
术后切除标本完整送病理,其中G1级21例(91.3%),G2级2例(8.7%),3例胃NET中,1级2例(66.7%),2级1例(33.3%)。术后病理报告见图4。
2.3 术后随访
本组病例均得到随访,随访率达100.0%,随访时间6~36个月,中位随访时间28个月。1个月后胃镜或者肠镜随访,创面基本愈合;3个月后创面呈白色疤痕样变。随访期间无1例出现肿瘤复发和转移。
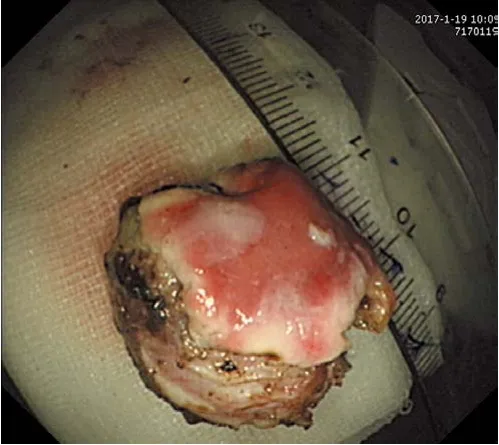
图3 瘤体标本Fig.3 Tumor specimen
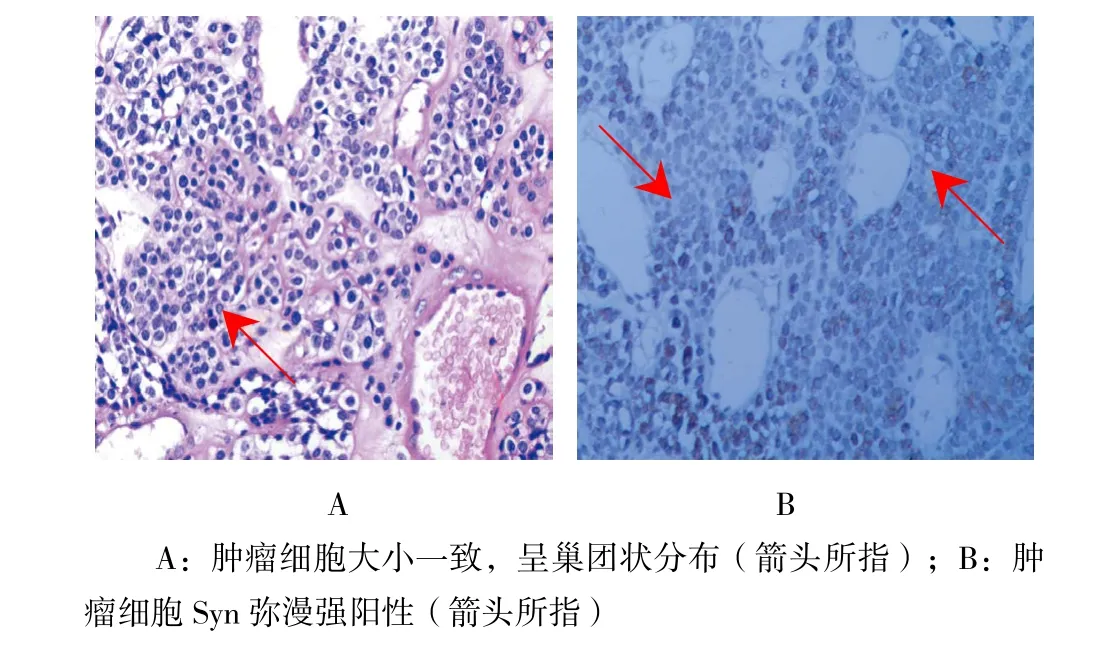
图4 病理报告 (HE×200)Fig.4 Pathological report (HE×200)
3 讨论
NET是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,可发生于全身许多器官和组织,其中胃肠道是最为常见的发病部位之一,约占全部NET的50.6%[2]。NET曾被称为类癌,直到2010年WHO第4版消化系统肿瘤分类将其重新命名为NET,并将其定义为恶性肿瘤[7]。NET具有从惰性生长,低度恶化,高转移性的生物学特征[11],并且早期缺乏特异性的临床表现,容易造成误诊漏诊,大部分患者因不适来就诊时已属局部晚期或出现转移,只能选择手术和姑息治疗,而且疗效较差[12-13]。对于NET,肿瘤大小及浸润深度是影响预后的重要因素,以直肠为例,肿瘤直径小于1.0 cm时,几乎不会发生转移,肿瘤生长至1.0 cm以上时,有3.5%的淋巴结转移率和7.0%~34.0%的远处转移率,而当肿瘤直径超过2.0 cm时,近70.0%会发生转移[14]。因此,对于NET患者,早期发现、早期诊断和早期治疗显得尤为重要。
胃NET根据肿瘤分化程度分为1~3型。1型和2型均存在高胃泌素血症,分别与慢性萎缩性胃炎和胃泌素瘤相关,而3型较为少见,多为散发,与高胃泌素血症无关。其中1型最常见,多为G1/G2级NET,复发多见,但转移较少见,预后较好;2型也多为G1/G2级NET;3型多为G3级神经内分泌癌,转移相对常见,预后也较差[8-9]。
ESD作为一项日渐成熟的内镜下治疗技术,已被广泛应用于消化道早癌的治疗中。与传统外科手术相比,ESD不改变消化道解剖结构,术后恢复快,并发症少,患者生活质量不受影响。而ESE是在ESD技术上发展起来,适用于黏膜下肿瘤的切除,并且是一种局部切除病灶的方法,已经在消化道固有肌层来源的平滑肌瘤及间质瘤的治疗中广泛应用[15]。它可以保证病变的完整切除,但是对操作者有着较高的要求,要求切除过程中沿着肿瘤的外侧缘将肿瘤从黏膜下层或者固有肌层剥离,并保持肿瘤包膜的完整[16-17]。本研究采用ESE治疗23例患者,一次性完整切除24处病灶(有1例切除2处病灶),成功率100.0%,结合术后病理评估,均为完整治愈切除。
出血是ESE最常见的并发症[18]。在大部分情况下,出血相对于穿孔对操作者有着更大的考验,如何预防出血是十分重要的。尽量在可视下剥离病变,对切开和剥离过程中发现的黏膜下层小血管,可以用切开刀头端直接电凝;对于较粗的血管,用电凝钳钳夹血管后提拉,使之与管腔壁保持一定距离再电凝血管。上述止血方法如不能成功止血,可以采用止血夹夹闭出血点,但是这不是首选方法,因为会影响后续的黏膜下剥离操作。当病变完整切除后,可应用APC或电凝钳电凝创面所见的小血管,可以预防ESE治疗后的迟发性出血。术后24 h应加强监护和管理,术后予以适当的禁食、补液,上消化道术后出血风险可考虑胃管置入。当出现术后出血时,应及时内镜下止血[19]。在本研究中有1例位于直肠的病变,术后34 h出现迟发性出血,予以及时内镜下止血后好转。穿孔是并不常见的并发症。腹膜返折线以上的结肠及远端直肠位于腹膜内,这些部位穿孔易形成气腹及腹膜炎,但如果穿孔位于系膜侧,由于系膜的遮挡作用,气腹症状有时可能不明显,而当位于腹膜返折线以下的近端直肠穿孔时,气体的弥散易形成皮下气肿和阴囊气肿。充分的黏膜下注射、避免长时间的高频电凝、多方向调整切割平面,都是有效剥离、防止穿孔的方法。另外,ESE操作时肠腔内积聚大量气体,及时抽吸肠腔内的气体可减少术中穿孔风险。一旦出现穿孔,应立即用金属夹封闭,或者尼龙绳联合金属夹的荷包缝合技术。建议手术全程采用CO2灌注,术后与气相关并发症可以得到较好控制,结合术后禁食、胃肠减压、抗生素使用可避免进一步外科手术。本研究中,1例因主动穿孔后进行荷包缝合外,其余无1例出现穿孔。
由于本临床研究收集的病例数较少,随访时间较短,评估ESE术对消化道NET的长期疗效,还需要进行大规模较长时间的回顾性研究。
综上所述,ESE治疗消化道NET,不仅可以完整剥离病灶,而且术中创伤较小,术后并发症少,又可提供准确的病理学评估。对于NET G1及G2分期,大小在3.0 cm以下,应用ESD衍生技术ESE是安全有效的。
参 考 文 献:
[1]MODLIN I M, KIDD M, LATICH I, et al. Current status of gastrointestinal carcinoids[J]. Gastroenterology, 2005, 128(6):1717-1751.
[2]YAO J C, HASSAN M, PHAN A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. J Clin Oncol, 2008, 26(18): 3063-3072.
[3]TAKEUCHI Y, IISHI H, UEDO N, et al. Endoscopic resection for early gastric cancer--JGCA gastric cancer treatment guidelines and indications for endoscopic resection[J]. Nippon Shokakibyo Gakkai Zasshi, 2008, 105(3): 344-350.
[4]房静远, 郑树, 姜泊, 等. 中国结直肠肿瘤筛查、早诊早治和综合预防共识意见(二)[J]. 胃肠病学, 2011, 32(12): 735-744.
[4]FANG J Y, ZHENG S, JIANG B, et al. Consensus opinion on colorectal cancer screening, early diagnosis, early treatment and comprehensive prevention in China (two)[J]. Chinese Journal of Digestion, 2011, 32(12): 735-744. Chinese
[5]DEPREZ P H. Endoscopic diagnosis and treatment of upper gastrointestinal tumors[J]. Endoscopy, 2011, 43(11): 966-970.
[6]WANG X Y, XU M D, YAO L Q, et al. Submucosal tunneling endoscopic resection for submucosal tumors of the esophagogastric junction originating from the muscularis propria layer: a feasibility study (with videos)[J]. Surgical Endoscopy, 2014, 28(6): 1971-1977.
[7]FLÉJOU J F. WHO Classification of digestive tumors: the fourth edition[J]. Annales De Pathologie, 2011, 31(5 Suppl): S27-S31.
[8]陈洛海, 陈洁, 周志伟. 胃肠道神经内分泌肿瘤治疗最新指南解读[J]. 中华胃肠外科杂志, 2016, 19(11): 1201-1204.
[8]CHEN L H, CHEN J, ZHOU Z W. Interpretation of the latest guidelines in the treatment of gastrointestinal neuroendocrine neoplasms[J]. Chinese Journal of Gastrointestinal Surgery, 2016,19(11): 1201-1204. Chinese
[9]DELLE FAVE G, O’TOOLE D, SUNDIN A, et al. ENETS consensus guidelines update for gastroduodenal neuroendocrine neoplasms[J]. Neuroendocrinology, 2016, 103(2): 119-124.
[10]张轶群, 姚礼庆, 周平红, 等. 内镜下黏膜剥离术后迟发性出血的治疗及危险因素分析[J]. 中华消化内镜杂志, 2010,27(12): 647-649.
[10]ZHANG Y Q, YAO L Q, ZHOU P H, et al. Treatment of delayed bleeding after endoscopic mucosal dissection and analysis of risk factors[J]. Chinese Journal of Digestive Endoscopy, 2010, 27(12):647-649. Chinese
[11]中国胃肠胰神经内分泌肿瘤病理专家组. 中国胃肠胰神经内分泌肿瘤病理学诊断共识[J]. 中华病理学杂志, 2011, 40(4):257-262.
[11]Chinese Panel of Pathology of Gastrointestinal Neuroendocrine Tumors. Consensus of pathological diagnosis of gastrointestinal neuroendocrine tumors in China[J]. Chinese Journal of Pathology,2011, 40(4): 257-262. Chinese
[12]徐建明. 重视对胃肠胰腺神经内分泌肿瘤的认识[J]. 中华肿瘤杂志, 2012, 34(2): 158-160.
[12]XU J M. Pay attention to the understanding of gastrointestinal and pancreatic neuroendocrine tumors[J]. Chinese Journal of Oncology, 2012, 34(2): 158-160. Chinese
[13]HASSAN M M, PHAN A, LI D, et al. Risk factors associated with neuroendocrine tumors: A U.S.-based case-control study[J].International Journal of Cancer Journal International Du Cancer,2008, 123(4): 867-873.
[14]STRIDSBERG M, ERIKSSON B, OBERG K, et al. A comparison between three commercial kits for chromogranin A measurements[J]. Journal of Endocrinology, 2003, 177(2): 337-341.
[15]WANG S, SHEN L. efficacy of endoscopic submucosal excavation for gastrointestinal stromal tumors in the cardia[J]. Surgical Laparoscopy Endoscopy & Percutaneous Techniques, 2016,26(6): 493-496.
[16]ZHOU P H, YAO L Q, QIN X Y, et al. Advantages of endoscopic submucosal dissection with needle-knife over endoscopic mucosal resection for small rectal carcinoid tumors: a retrospective study[J]. Surgical Endoscopy, 2010, 24(10): 2607-2612.
[17]YAHAGI N, FUJISHIRO M, KAKUSHIMA N, et al. Endoscopic submucosal dissection for early gastric cancer using the tip of an electrosurgical snare (thin type)[J]. Digestive Endoscopy, 2004,16(1): 34-38.
[18]SAITO Y, FUKUZAWA M, MATSUDA T, et al. Clinical outcome of endoscopic submucosal dissection versus endoscopic mucosal resection of large colorectal tumors as determined by curative resection[J]. Surgical Endoscopy, 2010, 24(2): 343-352.
[19]YOSHIDA N, YAGI N, NAITO Y, et al. Safe procedure in endoscopic submucosal dissection for colorectal tumors focused on preventing complications[J]. World Journal of Gastroenterology, 2010, 16(14): 1688-1695.
