腹腔镜腹部外科手术全身麻醉时镇痛/伤害性刺激指数的变化研究
2018-04-25田华
田华
[三峡大学第一临床医学院(湖北省宜昌中心人民医院) 普外科,湖北 宜昌 443000]
全身麻醉主要是催眠、镇痛(主要是阿片类药物)和肌肉松弛药物联合作用的结果,主要用于抑制患者意识和自主反应,以预防外科手术中疼痛[1]。麻醉过程中,自主神经系统(autonomous nervous system,ANS)反应被催眠和镇痛药物联合抑制,剂量不足和过量都会造成严重副作用,寻找最低有效剂量是现代麻醉学的重要课题[2]。目前临床上通过皮肤电导监测仪或手术体积描记指数(surgical pleth index,SPI)监测交感神经活动,从而反映麻醉和手术时交感神经的自主神经系统变化[3-4]。然而到目前为止,尚未有经过验证的常规用于临床的镇痛监控方法。因此,临床实践中通过监测心率(heart rate,HR)和血压等常规血流动力学参数的变化评估患者对镇痛药物的需求。目前研究证实手术全麻过程中,心率变化(heart rate variability,HRV)能够用于监测麻醉和手术时患者ANS反应[5-7]。最近研究表明HRV能够预测疼痛刺激引起的血流动力学反应[7]。本研究拟通过镇痛/伤害性刺激指数(analgesia nociception index,ANI)监控器实时监测全麻患者ANI,探讨ANI能否准确反映麻醉过程中镇痛/伤害性刺激变化相关事件,尤其是HR和血压等血流动力学参数的变化。现报道如下:
1 资料与方法
1.1 一般资料
本研究为一项前瞻性、非介入性队列研究,研究经三峡大学医学伦理委员会批准同意,所有受试者均自愿参与本次研究,并对此次研究内容知情同意。纳入2016年1月-2016年12月53例因腹腔镜阑尾切除术和胆囊切除术而全身麻醉的患者,采用ANI监控器(Metro Doloris,法国)实时监测患者ANI。非窦性心律、ANS改变疾病或药物治疗患者排除在此次研究之外。其中,男32例,女21例,年龄(28.1±9.7)岁,体重(65.2±8.2)kg,体质指数(body mass index,BMI)(22.4±8.7)kg/m2。患者均无ANS改变,患者术前均未使用其他药物,麻醉持续时间(129.2±42.4)min。患者麻醉药物使用量为:异丙酚(0.2±0.1)mg/(kg·min)和瑞芬太尼(0.3±0.1)μg/(kg·min)。麻醉过程中所有患者肌肉松弛药物顺-阿曲库铵的使用量为0.15 mg/kg。
1.2 麻醉与手术方案
患者术前不使用任何镇静类药物,进入手术室后常规建立下肢静脉通道,面罩吸氧去氮,监测HR、无创血压(noninvasive blood pressure,NBP)、呼吸频率(respiratory rate,RR)和经皮脉搏氧饱和度。诱导前静脉输注平衡盐液,总量达至10 ml/kg。诱导采用多模式静脉麻醉工作站(Orchestra,费森尤斯卡比,法国)双通道靶控输注(target controlled infusion,TCI)丙泊酚(得普利麻,10 mg/ml,阿斯利康)和瑞芬太尼(20μg/ml,宜昌人福),设定丙泊酚的血浆靶浓度(ProCp)为2μg/ml,如发生血流动力学反应(HemodReact)则调整丙泊酚剂量,血流动力学反应是指HR或收缩压(systolic blood pressure,SBP)升高20%以上。
1.3 肌肉松弛监测
采用Datex ohmeda S/5CAM紧凑型麻醉监护仪监测肌肉松弛。用75%乙醇擦拭患者额部、右颞部和手腕部的皮肤并晾干。将肌肉松弛监测电极片置于腕部上方尺侧,两个电极间距不超过2 cm,传感器探头固定于左拇指,监测4个成串刺激模式,刺激电流60 mA,波宽0.2 ms,频率2 Hz,刺激间隔20 s,显示第四个肌颤搐与第一个肌颤搐的高度比值即4个成串刺激的比值(train of four ratio,TOFR)和肌颤搐的计数。将温度探头固定于大鱼际处,通过保温方式维持温度在32℃以上,并将左上肢固定稳妥。
1.4 数据采集时间
在下列时间点采集ANI、血流动力学和麻醉参数:①麻醉诱导前(阶段Ⅰ):麻醉诱导前;②无刺激1(阶段Ⅱ):麻醉诱导和容量控制通气后;③强直(阶段Ⅲ):尺骨神经强直刺激(100 Hz,80 mA,5 s)后;④4个成串刺激1(阶段Ⅳ):皮肤切开并插入套管针后,气腹术前,一般刺激持续平均时间为3~5 min,腹腔镜检查通常需要插入3或4个套管针;⑤4个成串刺激2(阶段Ⅴ):腹腔镜手术时采用二氧化碳CO2气腹;⑥如果产生血流动力学反应(阶段Ⅵ);⑦无刺激2(阶段Ⅶ):手术后但仍处在容量控制通气麻醉状态。
1.5 手术方法
纳入本次研究的所有患者由两名固定的高年资微创外科医生负责进行手术,以减少由不同外科医生进行手术造成的手术刺激差异。阑尾切除术时,将套管针插入脐下、左髂窝和耻骨上;而胆囊切除术时,将套管针插入脐上,右季肋部和左右侧腹部。本研究过程中,所有套管针均插入到视野可见范围内(开放式腹腔镜入路);但是不同患者间各阶段手术诱导的伤害刺激可能存在差异。用气腹机充入CO2,手术过程中压力维持在12 mmHg。
1.6 统计学方法
采用SPSS 20.0统计软件进行数据处理。采用参数检验进行统计分析,当结果显著时,Friedman检验后进行Wilcoxon检验。所有结果均以均数±标准差(±s)表示。P<0.05为差异有统计学意义。
2 结果
2.1 不同时间点血流动力学参数比较
不同时间点血流动力学参数比较见附图。麻醉诱导前预给氧时(阶段I),患者HR为(73.1±7.2)次/min、SBP 为(139.6±19.4)mmHg,ANI值为(89.8±12.3);麻醉诱导后无刺激时(无刺激1,阶段Ⅱ),HR和SBP值下降,差异有统计学意义(P<0.05),脑电双频指数(bispectral index,BIS)为(38.2±10.3),ANI为(81.6±11.2),与阶段Ⅰ无差异。术前对所有患者进行强直刺激,强直刺激后患者血流动力学参数HR和SBP无明显变化(阶段Ⅲ),而ANI值显著下降,由阶段Ⅱ时的(81.6±11.2)降至(58.6±11.7),差异有统计学意义(P<0.05),强直刺激后5 min内,所有患者ANI值均恢复至强直刺激前水平。强直刺激后(12.1±4.2)min后开始手术,套管针插入时(4个成串刺激1,阶段Ⅳ),HR和SBP值稳定,而ANI下降至(40.4±3.9),差异有统计学意义(P<0.05)。4 个成串刺激2阶段(阶段Ⅴ),套管针插入耗时(7.2±5.1)min,CO2气腹建立后短时间内,HR和SBP值显著上升,BIS值在预先设定范围内,ANI值为(50.2±15.8),所有53例患者在腹腔镜手术开始后(8.1±2.2)min内至少出现1次短暂血流动力学反应。
2.2 不同时间点异丙酚和瑞芬太尼效应室浓度比较
瑞芬太尼效应室浓度上升至(5.0 ±1.9)ng/ml。上升后5 min,SBP持续升高使得瑞芬太尼效应浓度再次上调(0.7 ±0.1)ng/ml,瑞芬太尼靶点浓度再次上调前ANI值为(50.3 ±2.1)。患者手术后但仍处在容量控制通气麻醉状态时,ANI上升至(90.1±3.4),与手术前无刺激1时差异无统计学意义。Spearman秩检验表明ANI和SBP(Rho=-0.4,P<0.05)外的其他参数变化无相关性。见附表。
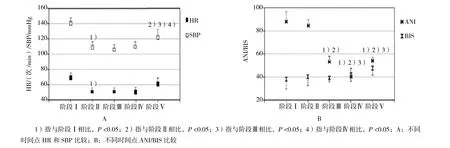
附图 不同时间点血流动力学参数比较Attached fig. Comparison of hemodynamic parameters at different time points
附表 不同时间点异丙酚和瑞芬太尼效应室浓度比较 (±s)Attached table Comparison of the effect-site concentration of propofol and remifentanil at different time points (±s)
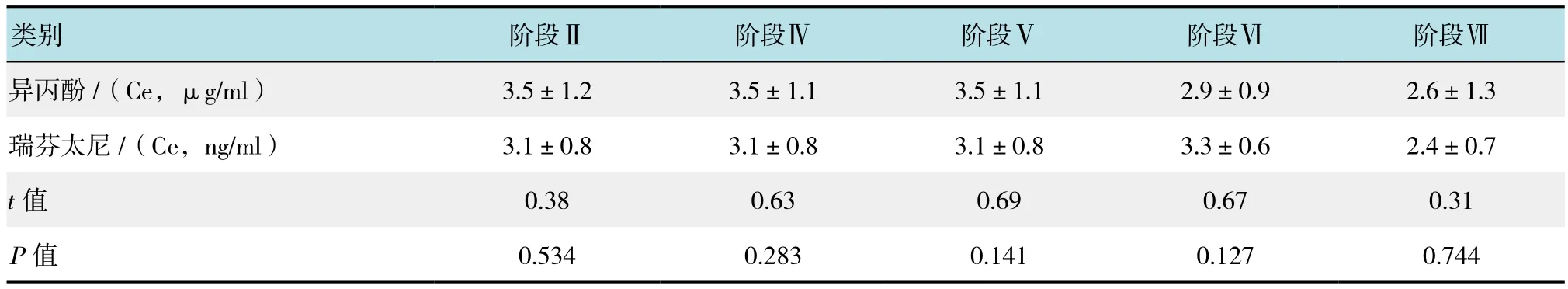
附表 不同时间点异丙酚和瑞芬太尼效应室浓度比较 (±s)Attached table Comparison of the effect-site concentration of propofol and remifentanil at different time points (±s)
注:Ce指效应室浓度
类别 阶段Ⅱ 阶段Ⅳ 阶段Ⅴ 阶段Ⅵ 阶段Ⅶ异丙酚 /(Ce,μg/ml) 3.5±1.2 3.5±1.1 3.5±1.1 2.9±0.9 2.6±1.3瑞芬太尼 /(Ce,ng/ml) 3.1±0.8 3.1±0.8 3.1±0.8 3.3±0.6 2.4±0.7 t值 0.38 0.63 0.69 0.67 0.31 P值 0.534 0.283 0.141 0.127 0.744
3 讨论
本研究结果表明通过ANI监测相对副交感神经张力能够评价全凭静脉麻醉(total infusion venus anesthesia,TIVA)时的伤害性刺激程度,ANI能够敏感和有效反映镇痛/伤害性刺激情况。患者麻醉诱导后、未进行刺激,且接受控制通气时,患者HR和SBP下降与高ANI值有关,多项研究均表明联合使用异丙酚和阿片药物能够引起患者交感神经张力下降,而副交感神经张力相对增高,这些研究结果与本研究一致[8-9]。
早在1984年,EVANS等提出用测定食管下段收缩性的方法来监测麻醉深度[10]。食管下段括约肌主要受迷走神经支配,其收缩的频率和波幅均随麻醉深度的加深而降低,随手术刺激的增强而增加,这可能是麻醉药抑制了食管的运动中枢迷走神经背核和其附近的网状活动中心,也可能和麻醉药直接作用于食管肌间神经丛有关。但食管下段收缩性受很多因素的影响,如个体差异性、药物作用尤其是肌松药的广泛应用等,用来监测麻醉深度的敏感性、特异性均受到质疑。许多研究者常用肌肉松弛仪进行强直刺激,以获得针对重复性伤害性刺激的ANS反应[11-12]。强直刺激的ANS反应迅速,如果基值信号稳定,且强直刺激是唯一影响ANS的事件,ANI能够准确监测到强直刺激的ANS反应,对腹部急诊手术来说,在几分钟内不进行任何刺激很难实现,这也是本组53例患者中只有43例患者接受术前刺激的原因。
值得注意的是,所有患者均未在强直刺激后发生血流动力学反应,43例接受强制刺激的患者中39例在强直刺激后30 s内ANI明显下降,提示ANI对伤害性刺激的敏感性高于HR和SBP等常见血流动力学参数。由于ANI的计算是以HRV为基础,既往有研究发现手术过程中HRV变化分析能够预测血流动力学反应,这一研究结果与本研究一致。手术开始对HR或SBP无明显影响,瑞芬太尼Ce和异丙酚Ce与手术开始前大致相同,但是ANI值从(81.6±11.2)降至(58.6±11.7),提示手术开始后伤害性刺激增加,但是镇痛作用仍然保持稳定。手术结束后,将瑞芬太尼效应室浓度设定为0,以唤醒患者,此时,ANI值为(90.1±3.4),表明患者副交感神经张力偏高,与术前状况类似,药物的镇痛效果超过低水平伤害性刺激引起的疼痛。
本研究结果与LUGINBÜHL等[13]研究结果不一致。LUGINBÜHL等[13]根据瑞芬太尼输注速率,对住院患者进行分组,分析了强直刺激尺骨神经及气管插管对HRV的影响,其研究发现,强直刺激尺骨神经及气管插管对各组患者HRV的影响类似,但是该研究并未严格区分麻醉时血流动力学反应的差异。本研究结果也不能区分这一差异,因为在不同研究中,患者本身和外源性预设刺激及记录患者数据时均存在差异。本结果表明ANI比LUGINBÜHL等[13]采用的HRV分析对疼痛刺激更敏感。
理想的镇痛抗伤害刺激程度监测应当与疼痛及伤害性刺激、镇痛药物药代动力学相关的指数具有良好的相关性,且不易受外界因素干扰,特异性及敏感性均较高,目前有关镇痛抗伤害程度监测方法都不能满足临床需求,寻找在客观水平反映镇痛/抗伤害程度的参数和方法还有很长的路要走,基于ANI的围术期镇痛/抗伤害应激程度监测方法具有一定的应用前景。
本研究存在一定的局限性,首先,本研究样本量小,但麻醉和手术时的参数仍然具有统计学显著意义。其次,本研究纳入患者的年龄和共存疾病[美国麻醉医师协会(American Society of Anesthesiologists,ASA)1和2]只代表日常临床实践中较少的患者群体。因此,本研究结果并不能外推至所有需要麻醉的患者。
综上所述,ANI监测能够有效协助接受异丙酚-瑞芬太尼全身麻醉的年轻患者行消化道手术,但是仍然需要在大样本量研究中证实。
参 考 文 献:
[1]LO T S, LIN C T, HUANG H J, et al. The use of general anesthesia for the tension-free vaginal tape procedure and concomitant surgery[J]. Acta Obstetricia Et Gynecologica Scandinavica, 2003,82(4): 367-373.
[2]MOUNTANTONAKIS S E, ELKASSABANY N, KONDAPALLI L, et al. Provocation of atrial fibrillation triggers during ablation:does the use of general anesthesia affect inducibility[J]. Journal of Cardiovascular Electrophysiology, 2015, 26(1): 16-20.
[3]COLOMBO R, RAIMONDI F, RECH R, et al. Surgical Pleth Index guided analgesia blunts the intraoperative sympathetic response to laparoscopic cholecystectomy[J]. Minerva Anestesiologica, 2015,81(8): 837-845.
[4]WON Y J, LIM B G, YEO G E, et al. The effect of nicardipine on the surgical pleth index during thyroidectomy under general anesthesia: a prospective double-blind randomized controlled trial[J]. Medicine (Baltimore), 2017, 96(6): e6154.
[5]HUH I Y, KIM D Y, SUNG M, et al. Change of QT variability index during general anesthesia[J]. Korean Journal of Anesthesiology,2016, 69(3): 250-254.
[6]KRATZ T, DETTE F, SCHMITT J, et al. Impact of regional femoral nerve block during general anesthesia for hip arthoplasty on blood pressure, heart rate and pain control: a randomized controlled study[J]. Technol Health Care, 2015, 23(3): 313-322.
[7]MARTIN J, SCHNEIDER F, KOWALEWSKIJ A, et al. Linear and non-linear heart rate metrics for the assessment of anaesthetists’workload during general anaesthesia[J]. British Journal of Anaesthesia, 2016, 117(6): 767-774.
[8]WIN N N, FUKAYAMA H, KOHASE H, et al. The different effects of intravenous propofol and midazolam sedation on hemodynamic and heart rate variability[J]. Anesthesia & Analgesia, 2005, 101(1):97-102.
[9]PATKI A, SHELGAONKAR V C. A comparison of equisedative infusions of propofol and midazolam for conscious sedation during spinal anesthesia-a prospective randomized study[J]. Journal of Anaesthesiology Clinical Pharmacology, 2011, 27(1): 47-53.
[10]EVANS J M, DAVIES W L, WISE C C. Lower oesophageal contractility: a new monitor of anaesthesia[J]. Lancet, 1984,1(8387): 1151-1154.
[11]BARVAIS L, ENGELMAN E, EBA J M, et al. Effect site concentrations of remifentanil and pupil response to noxious stimulation[J]. British Journal of Anaesthesia, 2003, 91(3): 347-352.
[12]WENNERVIRTA J, HYNYNEN M, KOIVUSALO A M, et al.Surgical stress index as a measure of nociception/antinociception balance during general anesthesia[J]. Acta Anaesthesiologica Scandinavica, 2010, 52(8): 1038-1045.
[13]LUGINBÜHL M, YPPÄRILÄ-WOLTERS H, RÜFENACHT M, et al. Heart rate variability does not discriminate between different levels of haemodynamic responsiveness during surgical anaesthesia[J]. Br J Anaesth, 2007, 98(6): 728-736.
