三联益生菌对便秘小鼠肠道推进功能改善及其对小鼠肠道菌群调节作用的研究
2018-04-24黄毅溦金鑫娜迪拉巴吾尔江葛亚中蔡美琴
黄毅溦,金鑫,娜迪拉·巴吾尔江,葛亚中,蔡美琴
1.上海交通大学公共卫生学院,上海 200025; 2.无限极(中国)有限公司,广东 广州 510665
便秘(chronic constipation,CC)是一种临床常见的功能性胃肠病,已成为困扰现代人的主要健康问题之一,严重影响着人们的生活质量[1]。研究表明,便秘患者普遍存在肠道蠕动缓慢,肠道菌群紊乱[2]等现象。使用益生菌制剂能够改善肠道菌群紊乱,提高肠道菌群定植抗力,增强小肠蠕动能力,改善便秘症状。现有研究表明,部分单菌种益生菌对于便秘症状有改善作用[3-5],而多菌种合用对便秘症状的改善作用研究则相对较少。本实验意在研究新型嗜酸乳杆菌NCFM-乳双歧杆菌Bi-07-鼠李糖乳杆菌NH001三联益生菌制剂对小鼠肠道菌群构成比例的调节作用,以及其对便秘小鼠小肠蠕动作用的促进从而改善功能性便秘的能力。
1 材料与方法
1.1实验用益生菌及剂量配置 新型三联益生菌制剂(主要成分为菊粉、嗜酸乳杆菌NCFM、乳双歧杆菌Bi-07、山楂粉、山药粉、鼠李糖乳杆菌HN001)由无限极(中国)有限公司提供。规格:2 g/包,活菌总数不低于1.0×1010CFU/g。以人体推荐量的10倍为其中的一个剂量组即中剂量组,另设5倍低剂量组及30倍高剂量组。该新型三联益生菌的人体推荐量为2 g/d,按照标准人体重量60 kg计算,人体正常剂量为0.033 g/(kg·bw),则:低剂量组=0.165 g/(kg·bw)、中剂量组=0.330 g/(kg·bw)、高剂量组=0.990 g/(kg·bw)。益生菌制剂的配置:低剂量组,准确称取受试益生菌制剂0.0825 g,蒸馏水定容至10 mL并混匀;中剂量组,准确称取受试益生菌制剂0.165 g,蒸馏水定容至10 mL并混匀;高剂量组准确称取受试益生菌制剂0.495 g,蒸馏水定容至10 mL并混匀。
1.2小肠推进率实验
1.2.1实验动物 健康雄性昆明小鼠共50只,SPF级,体重18~22 g,购于上海斯莱克生物科技有公司[实验动物生产许可证号:SCXK(沪)2012-0002],饲养于上海交通大学医学院动物科学部屏障环境内。
1.2.2药物及试剂 复方地芬诺酯片(每片含复方地芬诺酯2.5 mg,江苏华阳制药有限公司,国药准字H32020933);阿拉伯树胶(国药集团化学试剂有限公司);活性碳粉;小鼠饲料[上海普路腾生物科技有限公司斯莱康大小鼠繁殖饲料,生产许可证:沪饲证(2014)04001]。墨汁的配置:准确称取阿拉伯树胶10 g,加水80 mL,煮沸至溶液透明,称取活性炭(粉状)5 g加至上述溶液中煮沸3次,待溶液凉后加水定容到100 mL,于冰箱中4℃保存,用前摇匀。0.5%复方地芬诺酯混悬液的配制:复方地芬诺酯片,每片含复方地芬诺酯2.5 mg,取复方地芬诺酯50 mg(20片),用研钵研碎成粉末后加水至10 mL,临用前配制。
1.2.3实验方法 参照中国国家食品药品监督管理局《保健食品检验与评价技术规范》(2003版)中保健食品对因便秘引起肠道蠕动抑制改善作用的检测方法,所有小鼠进行5 d适应性饲养观察无异常后,随机分为空白对照组、模型对照组、低剂量组、中剂量组、高剂量组,每组各10只。
每天早上9点固定时间对各组小鼠进行灌胃。3个剂量组按照剂量设计方法,以0.2 mL/(10 g·bw)连续灌胃14 d,空白对照组与模型对照组以相同灌胃量连续给予蒸馏水14 d。每天早上均准确称取每只小鼠体重,及时调整灌胃量。第14天末次灌胃后,各组小鼠禁食不禁水24 h。除空白对照组以外,各组小鼠以50 mg/(kg·bw)口服复方地芬诺酯混悬液[即0.1 mL/(10 g·bw)],空白对照组以相同灌胃量给予蒸馏水。45 min后以0.5 mL/只给予各组小鼠墨汁灌胃,30 min后立即脱颈椎处死各组小鼠,开腹取小肠,剪取上端自幽门、下端至回盲部的肠管,轻拉成直线,测量小肠总长度及墨汁推进最前端长度,计算每只小鼠小肠墨汁推进率。小肠墨汁推进率=墨汁推进长度/小肠总长度×100%。
1.3肠道菌群调节作用实验
1.3.1实验动物 健康雄性BALB/c小鼠共42只,SPF级,体重18~22 g,购于上海灵畅生物科技有限公司[生产许可证:SCXK(沪)2013-0018],饲养于上海交通大学医学院动物科学部屏障环境内。
1.3.2药物及试剂 小鼠饲料[上海普路腾生物科技有限公司斯莱康大小鼠繁殖饲料,生产许可证:沪饲证(2014)04001];小鼠粪便DNA提取盒QIAamp Fast DNA Stool Mini Kit(51604)(美国QIAamp公司)。
1.3.3实验方法 参照中国国家食品药品监督管理局《保健食品检验与评价技术规范》(2003版)中保健食品对肠道菌群调节作用的检测方法,所有小鼠进行5 d适应性饲养观察无异常后随机抽取10只小鼠,在无菌环境下对粪便进行取样作为自身前后对比的空白组(A组),随后将所有小鼠随机分为空白对照组(B组)、低剂量组(C组)、中剂量组(D组)、高剂量组(E组)。
每天早上9点固定时间对各组小鼠进行灌胃。3个剂量组按照剂量设计方法,以0.2 mL/(10 g·bw)连续灌胃30 d,空白对照组以相同灌胃量连续给予蒸馏水30 d。每天早上准确称取每只小鼠体重,及时调整灌胃量。第30天末次灌胃后,无菌环境下对所有小鼠粪便进行取样封装,并于-80℃冰箱保存至进行DNA提取与分析。小鼠粪便DNA提取及16S rDNA测序分析由上海锐翌生物科技有限公司完成。
1.4统计学方法 小肠推进率实验中数据使用SPSS 21.0统计软件进行单因素方差分析,其中各组间多重比较采用Dunnet′t检验。肠道菌群调节作用实验中各组肠道菌群差异使用非参数检验。
2 结 果
2.1新型三联益生菌短期及长期使用对小鼠体重的影响 由表1、2可知,两实验从开始到结束的过程中,各组小鼠的体重逐步增加,体重变化在各组间差异均无统计学意义,说明小鼠体重增长均来自进食及自身正常生长。并且,在实验过程中,各组小鼠均保持正常进食进水,毛色正常,精神状态良好。表明该新型三联益生菌不同剂量的短期及长期使用对小鼠体重增长无作用,同时对小鼠生长无不良反应。
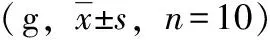
表1 新型三联益生菌对小肠推进率实验各组小鼠体重的影响
2.2新型三联益生菌对便秘小鼠小肠墨汁推进率的影响 由表3可知,便秘模型对照组小鼠小肠推进率显著低于空白对照组(P<0.05),表明小肠推进实验中便秘模型建立成功。经统计分析,低、中、高剂量组小鼠的墨汁推进率数值均高于模型对照组,其中高剂量组小鼠小肠墨汁推进率显著高于模型对照组(P<0.05),表明新型嗜酸乳杆菌NCFM-乳双歧杆菌Bi-07-鼠李糖乳杆菌NH001三联益生菌对便秘小鼠小肠蠕动有促进作用。
2.3新型三联益生菌对小鼠肠道菌群的影响
2.3.1新型三联益生菌对小鼠肠道菌群多样性的影响 由表4、图1可知,各组间肠道菌群多样性不尽相同。Shannon指数和Simpson指数均用来估算微生物群落的多样性,两者值越大,说明被测样品的菌群多样性越高。比较各组小鼠粪便中菌群多样性指数Simpson 值及Shannon 值后发现,进行适应性饲养5 d的小鼠肠道菌群多样性显著低于其他各组,正常进食进水给予蒸馏水灌胃饲养30 d对于小鼠肠道菌群多样性有改善,同时相同饲养条件给予不同剂量新型三联益生菌灌胃相较单给予蒸馏水对于小鼠肠道菌群多样性有更显著改善。

表3 新型三联益生菌制剂对便秘小鼠小肠墨汁推进率的影响
注:a、b、c与模型对照组相比差异有统计学意义,P<0.05。
PCoA分析能够展示各组间的差异大小,如果各组间距离较近,则表示各组的肠道菌群组成较相近;反之,各组间距离较远,则表示各组的肠道菌群组成有差异。由图2可看出,自身空白对照组(A组)和空白对照组(B组)两组小鼠肠道菌群组成均数接近,但B组小鼠肠道菌群组成较A组更多样;低中高剂量组(CDE组)各剂量组之间小鼠肠道菌群组成接近,但与AB两组差异有统计学意义,说明给予新型三联益生菌30 d后对于小鼠肠道菌群组成有显著改变。
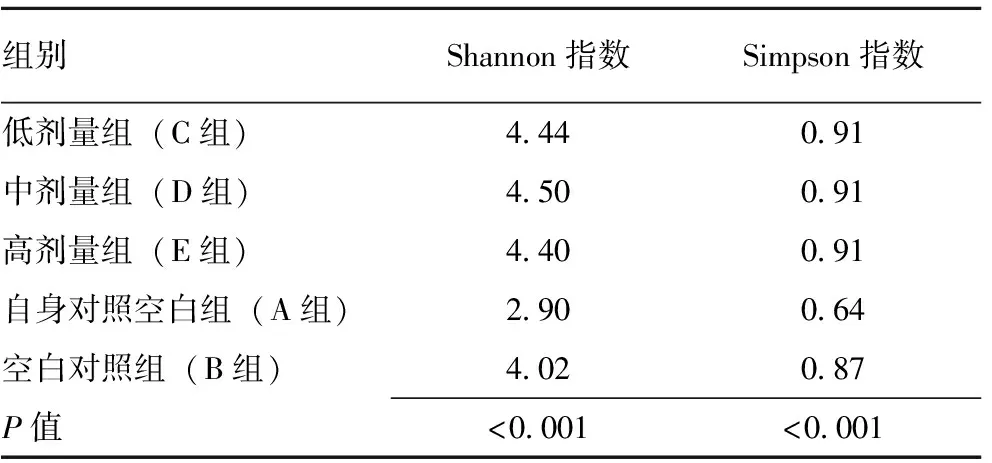
表4 新型三联益生菌对小鼠肠道菌群多样性的影响
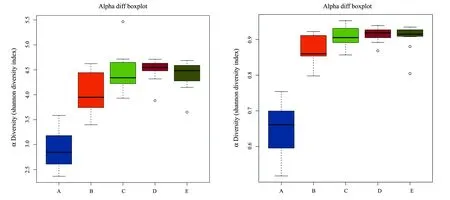
A:自身对照空白组,B:空白对照组,C:低剂量组,D:中剂量组,E:高剂量组
A:自身对照空白组,B:空白对照组,C:低剂量组,D:中剂量组,E:高剂量组
图2各组小鼠粪便中菌群多样性的PCoA分析
2.3.2新型三联益生菌对小鼠肠道菌群丰度的影响 由图3、图4丰度图可以解读所有小鼠及各剂量组组间优势菌种的差异,结果发现,拟杆菌科各剂量组前后差异有统计学意义,三联益生菌制剂组和蒸馏水组显著减少,并且各剂量组减少程度均比空白对照组更大。A组中明显无乳杆菌,而剂量组中乳杆菌显著增加。
2.3.3新型三联益生菌对小鼠肠道特殊菌群的影响 由表5可知,各组小鼠粪便中双歧杆菌、肠球菌、乳杆菌、肠杆菌、梭菌菌量均数在统计学上有显著性差异:各剂量组小鼠粪便中双歧杆菌和乳杆菌在属和科水平较未给予三联益生菌制剂前有显著性提高,且乳杆菌各剂量组增长程度较蒸馏水组更高,差异有统计学意义;各剂量组小鼠粪便中梭菌、肠球菌在属水平较未给予益生菌制剂前有显著降低,差异有统计学意义;各剂量组小鼠粪便中肠杆菌在属水平较未给予益生菌制剂前有显著性降低,差异有统计学意义。
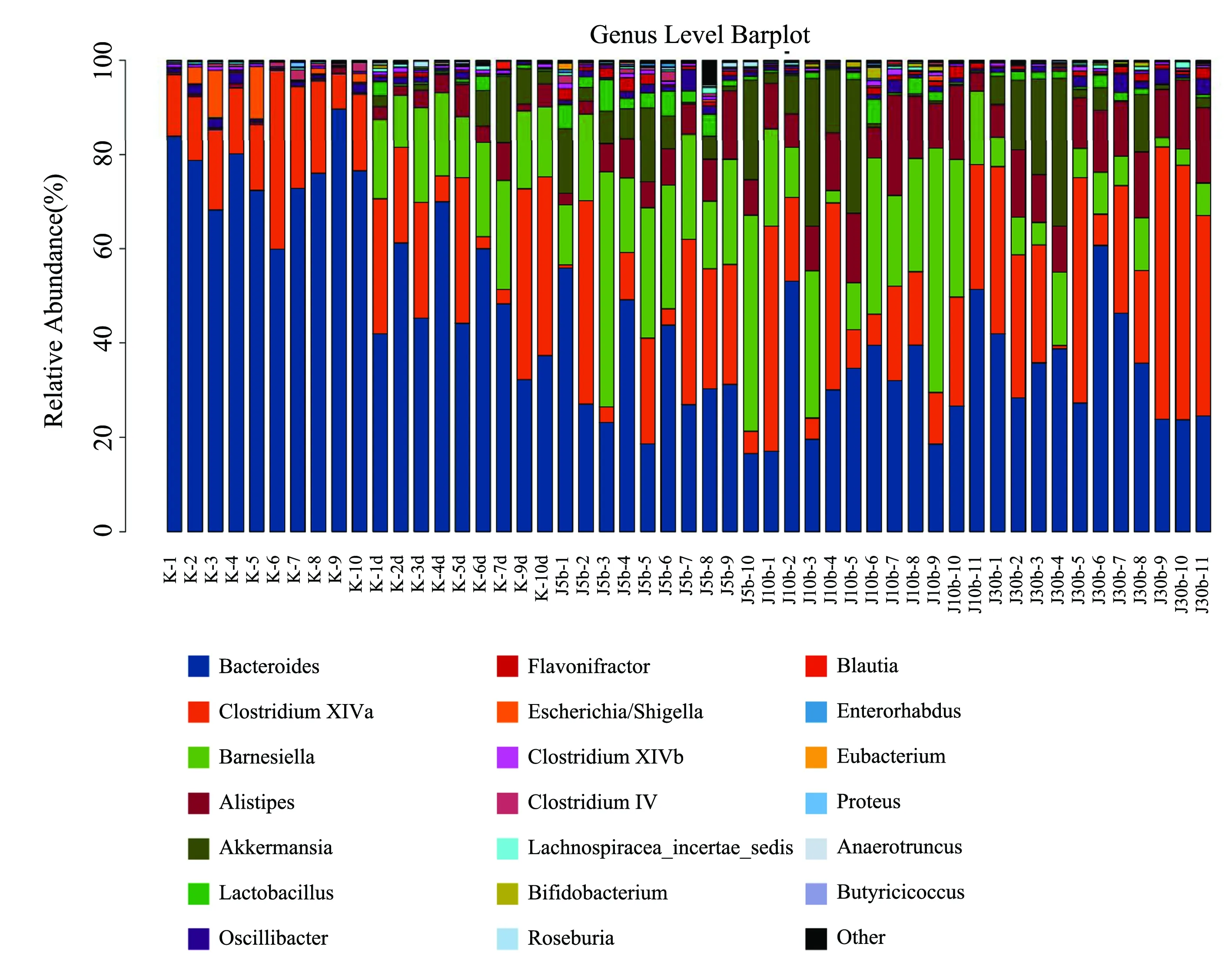
K1-10为A组样品、K1d-10d为B组样品、J5b1-10为C组样品、J10b1-11为D组样品、J30b1-11为E组样品

A:自身对照空白组,B:空白对照组,C:低剂量组,D:中剂量组,E:高剂量组
图4各组小鼠粪便中菌群属水平丰度图
3 讨 论
3.1肠道菌群与便秘 目前研究发现慢性便秘不仅与饮食结构、肠道动力学有关,同时还发现便秘患者肠道菌群结构与健康人群存在较大差异,肠道菌群紊乱可能参与便秘发病[6-7]。
Wang、Kang等[8-9]对便秘患者及健康人群粪便进行菌群培养后发现,便秘患者粪便中双歧杆菌、乳杆菌数量显著低于健康人群,而大肠埃希菌等条件致病菌及真菌则显著高于健康人群。随着16S rDNA技术的发展,可以通过DNA测序手段更准确的测定并分析肠道菌群种类及其结构组成,为肠道菌群在慢性便秘中的作用提供更全面的信息及证据[10-11]。安莹莹[12]对便秘患者及健康人群粪便进行16S rDNA测序分析后发现便秘患者肠道菌群丰度及多样性显著低于健康人群,慢性便秘组拟杆菌门(Bacteroidetes)、肠球菌门(Enterococcus)所占比例显著高于健康正常人组,而乳杆菌属(Lactobacillus)显著减少。随后通过提取便秘患者粪便菌群制作菌群液,对小鼠进行连续灌胃15 d后发现灌胃组小鼠排便频率、排便量及小肠墨汁推进率显著低于对照组。李根林等[13]发现便秘初期小鼠双歧杆菌与乳杆菌显著减少,后期大肠埃希菌、双歧杆菌增多,乳杆菌持续减少。说明便秘患者肠道菌群紊乱与其便秘发病及症状相关。
3.2结果分析 多项RCT研究表明,对便秘患者使用益生菌制剂后排便频率显著增多、结肠传输时间显著加快[14-18],并且对连续使用益生菌制剂的便秘患者肠道菌群进行前后自身对照后发现其肠道菌群紊乱改善,菌群结构组成向健康人群靠拢,便秘症状显著缓解[19]。Dimidi等[20]对14项使用益生菌制剂治疗便秘的RCT研究进行Meta分析后发现,对比安慰剂组或自身前后对比,便秘患者使用益生菌制剂后粪便在肠道中运输时间显著下降,排便频率显著上升,该效果在使用含双歧杆菌的益生菌产品中更加显著。现有研究中发现单菌株益生菌具有改善便秘的作用[3-5],但是对于多菌株联合使用对肠道菌群结构的调节以及其对便秘的改善作用尚较少。本研究中,使用大剂量复方地芬诺酯制造便秘模型并对便秘小鼠使用新型三联益生菌制剂后发现,高剂量组小肠推进率显著加快,而低、中剂量组小肠推进率也有明显加快趋势,说明该新型三联益生菌制剂能够有效增快便秘小鼠小肠推进率。
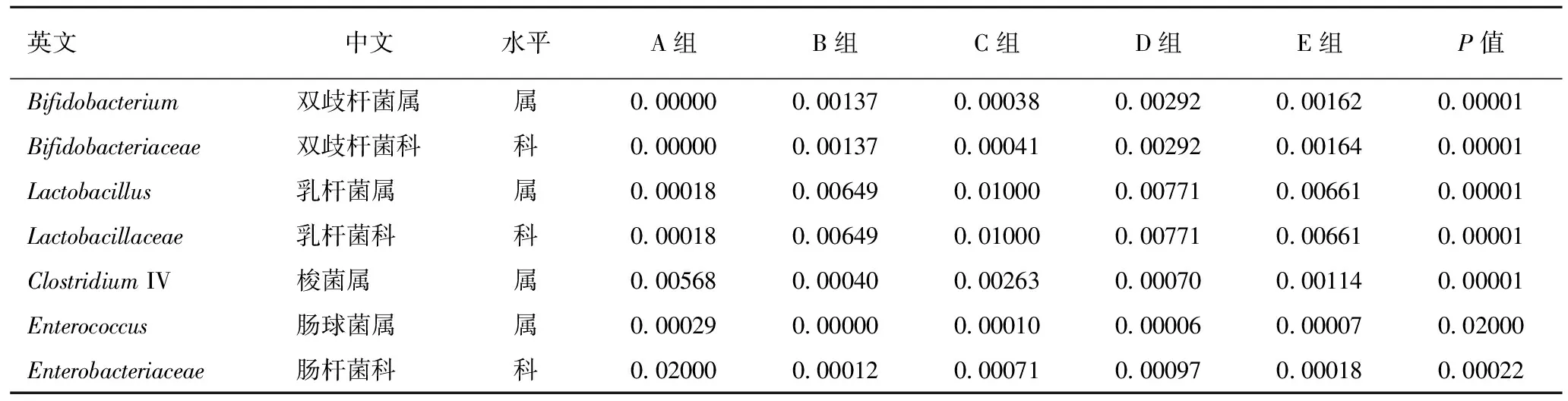
表5 新型三联益生菌小鼠粪便中不同微生物级别菌群的影响
注:A:自身对照空白组,B:空白对照组,C:低剂量组,D:中剂量组,E:高剂量组。
同时,对使用不同剂量灌胃的正常小鼠肠道菌群进行16S rDNA检测,发现使用益生菌制剂后其肠道菌群多样性显著增加,双歧杆菌属、乳杆菌属等肠道优势菌显著增加,大肠埃希菌属、梭菌属、肠球菌属等条件致病菌显著减少,提示新型三联益生菌能够改善小鼠肠道菌群结构,推测其可能为改善便秘的原因。
3.3益生菌改善便秘的可能机制 肠道菌群按照生理作用可分为三类:即生理性菌群,主要包括双歧杆菌、乳杆菌等专性厌氧菌,为肠道优势菌群,对肠道正常生理功能起保护作用;条件致病菌,包括大肠埃希菌、肠球菌、梭菌等,多为专性厌氧菌,仅在满足特定条件下对宿主产生影响;病原菌,多为变形杆菌等,如在肠道长期定植并大量繁殖可导致人体发病[21-22]。肠道菌群促进肠蠕动的机制尚不明确,可能与双歧杆菌、乳杆菌等专性厌氧菌在肠道内发酵、降解,降低肠道pH及其代谢产物中的短链脂肪酸(SCFAs)有关。SCFAs能够刺激回肠的推进与收缩,通过与肠道细胞表面受体作用,对肠壁神经有良好的刺激作用,能够促进肠道分泌5-羟色胺(5-HT)[23]。5-HT能够通过提高肠道通透性,增加肠内渗透压、增加水分分泌,促进肠道蠕动,是参与调节肠道蠕动的重要神经递质[24-25]。同时SCFAs能够降低肠道pH,促进结肠蠕动,研究证明给予SCFAs能够有效减少粪便在结肠中传输时间[23,26]。低pH环境同样能够以正反馈调节促进专性厌氧菌在肠道的定植,使SCFAs竞争性结合肠上皮细胞或黏膜上受体结合位,从而提高定植抗力,抑制条件致病菌及病原菌的定植和繁殖,改善便秘患者肠道菌群紊乱、维持正常肠道菌群结构[9,27],帮助预防及缓解因肠道菌群紊乱引起的便秘及其症状。
3.4本研究的不足之处 本研究通过动物实验发现新型嗜酸乳杆菌NCFM-乳双歧杆菌Bi-07-鼠李糖乳杆菌NH001三联益生菌制剂对正常小鼠肠道菌群有正向调节作用,但是对便秘模型小鼠肠道菌群作用如何有待进一步研究。同时,研究虽然提示该益生菌对便秘小鼠有促进肠道蠕动作用,但是本研究只是动物实验,对人体便秘是否有效以及缓解便秘的具体机制有待进一步验证。
3.5结论 本研究提示,新型嗜酸乳杆菌NCFM-乳双歧杆菌Bi-07-鼠李糖乳杆菌NH001三联益生菌制剂能够改善小鼠肠道菌群结构,同时能够促进便秘小鼠肠道蠕动,帮助便秘症状缓解。
[1] 崔龙. 便秘治疗的再认识[J]. 临床外科杂志, 2016, 24(6): 411-412.
[2]HUANG Linsheng, GAO Renyuan, YAN Xuebing, et al. Structure analysis of the gut microbiota in chronic functional constipation patients[J]. Chin J Colorectal Dis, 2017, 6(2): 121-126. (in Chinese)
黄林生, 高仁元, 严雪冰, 等. 慢性功能性便秘患者的肠道菌群分析[J]. 中华结直肠疾病电子杂志, 2017, 6(2): 121-126.
[3]DING Sheng, JIANG Jingli, LIU Songling, et al. Effect of Bifidobacteria strain on defecating function in constipation mice[J]. Food Sci, 2011, 32(3): 195-198. (in Chinese)
丁圣, 蒋菁莉, 刘松玲, 等. 长双歧杆菌BBMN68对便秘模型小鼠的通便作用[J]. 食品科学, 2011, 32(3): 195-198.
[4]Li C, Nie SP, Zhu KX, et al. Effect ofLactobacillusplantarumNCU116 on loperamide-induced constipation in mice[J]. Int J Food Sci & Nutr, 2015, 66(5): 533-538.
[5]Zhao X, Qian Y, Suo H, et al. Preventive effect ofLactobacillusfermentumZhao on activated carbon-induced constipation in mice[J]. J Nutr Sci & Vitaminol, 2015, 61(2): 131.
[6]YU Ying. The investigation of intestinal flora in the elderly people with and without constipation and the effects of intervention by microecological preparation[J]. Chin J Gastroenterol & Hepatol, 2010, 19(12): 1133-1135. (in Chinese)
余英. 老年性便秘与肠道菌群失调的相关性及药物干预性研究[J]. 胃肠病学和肝病学杂志, 2010, 19(12): 1133-1135.
[7]MIAO Yongxin, YU Shaolei, YANG Ailong, et al. Study on the bacterial flora change of constipation patient′s intestinal tract[J]. Chin J Coloproctol, 2014, 34(10): 53-54. (in Chinese)
苗永新, 喻少雷, 杨爱龙, 等. 便秘患者肠道菌群变化的研究[J]. 中国肛肠病杂志, 2014, 34(10): 53-54.
[8]Wang L, Hu L, Xu Q, et al.Bifidobacteriumadolescentisexerts strain-specific effects on constipation induced by loperamide in BALB/c mice[J]. Int J Mol Sci, 2017, 18(2): 318.
[9]Kang DW, Dibaise JK, Ilhan ZE, et al. Gut microbial and short-chain fatty acid profiles in adults with chronic constipation before and after treatment with lubiprostone[J]. Anaerobe, 2015, 33: 33-41.
[10] Tajima K, Aminov RI, Nagamine T, et al. Rumen bacterial diversity as determined by sequence analysis of 16S rDNA libraries[J]. FEMS Microbiol Ecol, 1999, 29(2): 159-169.
[11] Dorai-Raj S, O′Grady J, Cormican M, et al. Identification of host-specific Bacteroidales 16S rDNA sequences from human sewage and ruminant feces[J]. J Basic Microbiol, 2012, 52(3): 277.
[12] AN Yingying. Effects of intestinal microbiota of patients with chronic constipation on the expression of serotonin transporter and the bowel movement in mice[D]. Tianjin: Tianjin Medical University, 2016. (in Chinese)
安莹莹. 慢性便秘患者肠道菌群对小鼠肠道5-羟色胺转运体表达及排便功能的影响[D]. 天津: 天津医科大学, 2016.
[13] LI Genlin, ZHANG Yanyu, LI Hanbin. Effect of constipation induced by diphenoxylate on intestinal flora in a rat[J]. Chin J Tissue Engin Res, 2016, 20(49): 7404-7410. (in Chinese)
李根林, 张颜语, 李寒冰. 复方地芬诺酯建立大鼠便秘模型及对肠道菌群的影响[J]. 中国组织工程研究, 2016, 20(49): 7404-7410.
[14] Ojetti V, Ianiro G, Tortora A, et al. P. 06. 18Lactobacillusreuteri(DSM 17938) for the treatment of functional constipation in adult patients: A double-blind, randomized, placebo-controlled trial[J]. Digest & Liver Dis, 2013, 45(Suppl 2): S132-S132.
[15] Mazlyn MM, Nagarajah LH, Fatimah A, et al. Effects of a probiotic fermented milk on functional constipation: A randomized, double-blind, placebo-controlled study[J]. J Gastroenterol & Hepatol, 2013, 28(7): 1141-1147.
[16] Ishizuka A, Tomizuka K, Aoki R, et al. Effects of administration ofBifidobacteriumanimalissubsp.lactisGCL2505 on defecation frequency and bifidobacterial microbiota composition in humans[J]. J Biosci & Bioengin, 2012, 113(5): 587-591.
[17] Favretto DC, Pontin B, Moreira TR. Effect of the consumption of a cheese enriched with probiotic organisms(Bifidobacterium lactis bi-07) in improving symptoms of constipation[J]. Arquivos De Gastroenterologia, 2013, 50(3): 196.
[18] Del PM, Carmagnola S, Anderloni A, et al. The use of probiotics in healthy volunteers with evacuation disorders and hard stools: A double-blind, randomized, placebo-controlled study[J]. J Clin Gastroenterol, 2010, 44(8): 30-34.
[19] Kim SE, Choi SC, Park KS, et al. Change of fecal flora and effectiveness of the short-term VSL#3 probiotic treatment in patients with functional constipation[J]. J Neurogastroenterol & Motility, 2015, 21(1): 111.
[20] Dimidi E, Christodoulides S, Fragkos KC, et al. The effect of probiotics on functional constipation in adults: A systematic review and meta-analysis of randomized controlled trials[J]. Am J Clin Nutr, 2014, 100(4): 1075-1084.
[21] Zhu L, Liu W, Alkhouri R, et al. Structural changes in the gut microbiome of constipated patients[J]. Physiolog Genomics, 2014, 46(18): 679-686.
[22] SHEN Dingshu, CHEN Suyun. Gut microbial ecosystem and colonization resistance[J]. Chin J Microecol, 2012, 24(12): 1150-1152. (in Chinese)
沈定树, 陈素云. 肠道微生态与定植抗力[J]. 中国微生态学杂志, 2012, 24(12): 1150-1152.
[23] Reigstad CS, Salmonson CE, Rd RJ, et al. Gut microbes promote colonic serotonin production through an effect of short-chain fatty acids on enterochromaffin cells[J]. Faseb J Offic Public Feder Am Societ Exp Biol, 2015, 29(4): 1395-1403.
[24] ZHOU Xiaodan, LIU Aiping, ZHANG Ming, et al. Laxative effect ofLactobacillusparacaseisubsp.paracaseiLC-01 in constipated mice[J]. J Dairy Sci & Technol, 2012, 35(5): 7-11. (in Chinese)
周晓丹, 刘爱萍, 张明, 等. 副干酪乳杆菌LC-01对便秘小鼠的通便作用[J]. 乳业科学与技术, 2012, 35(5): 7-11.
[25] Shin A, Camilleri M, Kolar G, et al. Systematic review with meta-analysis: Highly selective 5-HT4 agonists(prucalopride, velusetrag or naronapride) in chronic constipation[J]. Aliment Pharmacol & Therapeut, 2014, 39(3): 239-253.
[26] Shi Y, Chen Q, Huang Y, et al. Function and clinical implications of short-chain fatty acids in patients with mixed refractory constipation[J]. Colorectal Dis Offic J Assoc Coloproctol Great Britain & Ireland, 2016, 18(8): 803-810.
[27] LI Lin, LI Yan. The therapeutic effect of Zheng ChangSheng combined with Chang LeKang on functional diarrhea complicated by intestinal dysbacteriosis[J]. Chin J Microecol, 2014, 26(3): 284-289. (in Chinese)
李琳, 李岩. 整肠生联合常乐康治疗伴肠道菌群失调功能性腹泻的疗效观察[J]. 中国微生态学杂志, 2014, 26(3): 284-289.
