基于高通量测序分析健康人咀嚼槟榔前后口腔菌群多样性
2018-04-24熊雄易书瀚赵紫薇成焕吴忠坤郭亦晨李珂王远亮
熊雄,易书瀚,赵紫薇,成焕,吴忠坤,郭亦晨,李珂,2,3,王远亮,2,3
1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.海南联合槟榔产业工程研究中心,海南 海口 570100
槟榔作为现代社会一种快速消费品正逐渐被大众所接受,并成增长趋势。首先,槟榔中含有槟榔碱、槟榔次碱等重要的生物碱,这些生物碱对人体口腔均有不同程度的毒性作用,长时间咀嚼槟榔还能导致口腔黏膜下纤维性变(OSF)及口腔鳞状细胞癌(OSCC)[1-3]。因此咀嚼槟榔大多数都是对口腔具有毒性作用。事实上,一个健康人口腔中含有亿万多的微生物,这其中绝大多数都是口腔菌群的正常微生物群落,当口腔过量咀嚼槟榔时,口腔黏膜组织会被破坏,这可能是咀嚼槟榔时口腔过度用力,导致槟榔残渣随同牙齿在口腔中来回摩擦,进而刺激口腔黏膜,造成口腔机械性物理损伤。研究咀嚼槟榔对口腔造成的不可逆伤害是口腔微生物多样性分析的重要内容,这对防治口腔疾病有着重要作用。随着科学的不断进步,利用分子生物学研究口腔微生物多样性已然成为当下趋势,相比传统的16S rDNA方法,高通量测序技术具有高准确性,高通量,高灵敏度和低运行成本等突出优势。本研究利用高通量测序方法对健康人咀嚼槟榔前后的唾液进行对比分析来探讨口腔微生物菌群结构分布及微生物群落多样性,以期为食用槟榔与口腔微生态相关性研究打下基础。
1 材料与方法
1.1材料
1.1.1槟榔 选自湖南某槟榔制造企业市售食用成品槟榔。
1.1.2健康人选取标准 从湖南农业大学食品科学技术学院选取8个健康成年人,年龄21~25周岁,被选者3个月内无注射或服用抗生素,无吸烟,无全身系统性疾病,无口腔溃疡,无进行口腔局部创伤手术,8人在此之前均无咀嚼过槟榔。
1.1.3健康人咀嚼槟榔前后唾液样本收集 采集咀嚼槟榔前的唾液样品,8名入选者用0.85%无菌生理盐水轻轻漱口1~2 min,采集自然排出的唾液2 mL,标记为Qa、Qb、Qc、Qd、Qe、Qf、Qg、Qh,记为Q组。同样,采集咀嚼槟榔后的唾液样品,入选者轻轻漱口1~2 min,然后咀嚼半颗槟榔(7~10 g),直至无甜味,槟榔残渣呈破裂纤维状,采集自然排出的唾液2 mL,对同一个体咀嚼5 min后、吐出槟榔后30 min采集唾液,分别标记为Ha5、Ha30、Hb5、Hb30、Hc5、Hc30、Hd5、Hd30、He5、He30、Hf5、Hf30、Hg5、Hg30、 Hh5、Hh30,记为H5组、H30组。所有采集的唾液均在-20℃冰箱保存备用。
1.2方法
1.2.1基因组总DNA提取及PCR扩增 各样品DNA的提取采用GV-Bacterial Genomic DNA Extraction Kit试剂盒提取,利用1%的琼脂糖凝胶电泳检测DNA完整性、纯度、片段大小和浓度。通过参考Walter等文献,采用口腔微生物16S rDNA通用引物HAD-1/HAD-2扩增V4区。50 μL PCR体系扩增程序为:95℃ 5 min预变性;98℃ 10 s,46℃ 15 s,72℃ 1 min,40个循环;72℃延伸5 min。PCR结束后,利用2%的琼脂糖凝胶电泳鉴定,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。提取质量合格的DNA样品,将样品送至天津诺禾致源生物信息科技有限公司进行口腔微生物16S rDNA V4区HiSeq2500 PE250测序平台的高通量测序。
1.2.2数据分析 利用Uparse软件[5]对所有样品的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),同时会选取OTUs的代表性序列,对OTUs代表序列进行物种注释,用Mothur方法与SILVA[6]的SSUrRNA数据库[7]进行物种注释分析(设定阈值为0.8~1.0),分别在界、门、纲、目、科、属、种统计各样本的群落组成。使用MUSCLE[8]软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后对各样品的数据进行均一化处理。另外,使用Qiime软件计算物种数(Observed-species)、Chao1指数、香农-威纳指数(Shannon-Wiener index)、辛普森指数(Simpson′ index)、ACE指数、深度测序指数(Good′s coverage)。
2 结 果
2.1基因组总DNA提取及PCR扩增 全部样品基因组经过DNA提取后,所有样品均在200 bp左右,条带均清晰可见,满足后续测序需要,见图1。

注:M:DNA标准分子量,1:Qa,2:Ha5,3:Ha30,4:Qb,5:Hb5,6:Hb30,7:Qc,8:Hc5,9:Hc30,10:Qd,11:Hd5,12:Hd30,13:Qe,14:He5,15:He30,16:Qf,17:Hf5,18:Hf30,19:Qg,20:Hg5,21:Hg30,22:Qh,23:Hh5,24:Hh30。
图1PCR扩增产物电泳图
2.2基因组菌群测序结果分析 所有样品的基因组DNA经PCR扩增16S rDNA V4区后进行高通量测序,经统计分析获得序列的alpha多样性。所有组别样品的测序覆盖率均在97%以上,表明样品中序列未被测到的概率低,见表1。
细菌群落丰富度用Chao1指数和ACE指数表示,其值越高表明群落物种的丰富度越高;细菌群落多样性程度用香农-威纳指数(Shannon-Wiener index)和辛普森指数(Simpson′ index)表示,Shannon指数和Simpson指数越大,说明群落多样性越高。在所有样品组别中,相对于咀嚼槟榔前的口腔微生物多样性,咀嚼槟榔5 min及30 min后,被发现的物种逐渐增多,ACE和Chao1指数降低,表明样品中菌群相对丰度降低。而Shannon指数和Simpson指数高,表明菌群的多样性高。

表1 咀嚼槟榔前、咀嚼5 min后和咀嚼30 min后口腔微生物菌群的alpha多样性比较
注:Q组:咀嚼槟榔前,H5组:咀嚼5 min后,H30组:吐出槟榔,咀嚼30 min后。
2.3细菌基因组菌群多样性分析
2.3.1基于门水平的细菌菌群结构分析 用Mothur方法与SILVA 的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息中门水平的群落组成,见表2。在咀嚼槟榔前、咀嚼5 min后和咀嚼30 min后,所有样品中的总细菌菌群相对丰度大于1%的菌门主要包含变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi),见图2。咀嚼槟榔前的平均相对丰度分别为31.0%、32.9%、17.2%、5.4%、3.7%、1.9%、2.2%,咀嚼5 min后分别为31.2%、32.2%、15.2%、4.6%、5.3%、2.2%、2.5%,咀嚼30 min后分别为34.7%、29.0%、14.0%、5.2%、5.2%、2.4%、2.5%。不同个体在门水平上的统计分析结果还包括少量的酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、螺旋体门(Spirochaetes)、放线菌门(Actinobacteria)等。

注:Q组:咀嚼槟榔前,H5组:咀嚼5 min后,H30组:吐出槟榔,咀嚼30 min后。
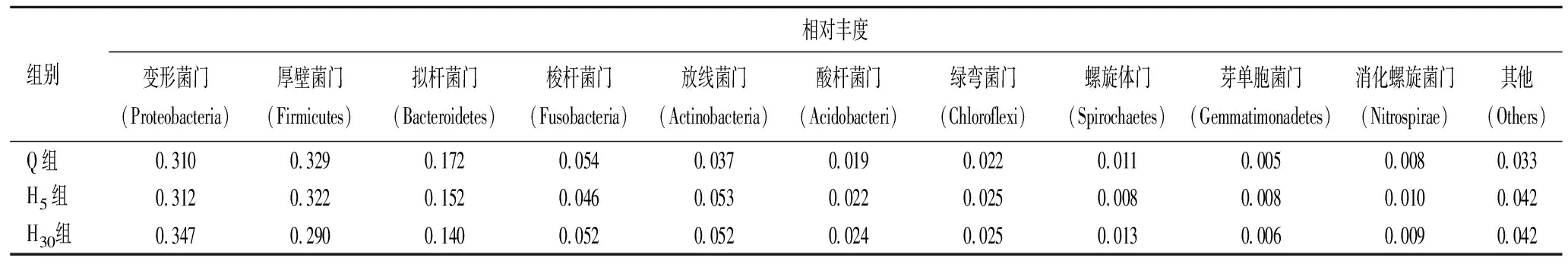
图2 咀嚼槟榔前、咀嚼5 min后和咀嚼30 min后菌群在门水平上的相对丰度分布图
注:Q组:咀嚼槟榔前,H5组:咀嚼5 min后,H30组:吐出槟榔,咀嚼30 min后。
2.3.2基于属水平的细菌菌群结构分析 基于宏基因组DNA测序的结果显示,在Q组、H5组和H30组中,相对丰度较大菌群在属水平上的分布见图3。链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、奈瑟菌属(Neisseria)相对丰度均大于5%,为主要菌群。而口腔微生物的30种核心菌属在3个样品组均有分布,分别占总量的62.93%、57.78%、58.77%。
在咀嚼槟榔前,口腔内菌群相对丰度大于1%菌属的有链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、奈瑟菌属(Neisseria)、纤毛菌属(Leptotrichia)、嗜血杆菌属(Haemophilus)、拟普雷沃菌属(Alloprevotella)、普雷沃菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)、梅毒螺旋体_2(Treponema_2)、罗思氏菌属(Rothia)、颗粒链菌属(Granulicatella)、兼性双球菌属(Gemella)、梭形杆菌属(Fusobacterium),占总量的52.98%,其中链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、奈瑟菌属(Neisseria)的相对丰度最大。在咀嚼5 min后,上述这14种相对丰度较大的菌属中,拟普雷沃菌属(Alloprevotella)、梅毒螺旋体_2(Treponema_2)和兼性双球菌属(Gemella)相对丰度均小于1%,其余菌属均大于1%。在咀嚼30 min后,兼性双球菌属(Gemella)均相对丰度小于1%,其余菌属均大于1%。而乳球菌属(Lactococcus)、加德纳菌属(Gardnerella)在咀嚼槟榔前未被检出,见表3。
在咀嚼5 min后,链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、纤毛菌属(Leptotrichia)、嗜血杆菌属(Haemophilus)、拟普雷沃菌属(Alloprevotella)、普雷沃菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)、梅毒螺旋体_2(Treponema_2)、普雷沃菌_6属(Prevotella_6)、兼性双球菌属(Gemella)的相对丰度均降低,而奈瑟菌属(Neisseria)、罗思菌属(Rothia)、梭形杆菌属(Fusobacterium)的相对丰度均增大。在咀嚼30 min后,纤毛菌属(Leptotrichia)、嗜血杆菌属(Haemophilus)、拟普雷沃菌属(Alloprevotella)、卟啉单胞菌属(Porphyromonas)、梅毒螺旋体_2(Treponema_2)、罗思菌属(Rothia)的相对丰度均增大。

注:Q组:咀嚼槟榔前,H5组:咀嚼5 min后,H30组:吐出槟榔,咀嚼30 min后。

图3 咀嚼槟榔前、咀嚼5 min后和咀嚼30 min后菌群在属水平上的相对丰度分布图
注:Q组:咀嚼槟榔前,H5组:咀嚼5 min后,H30组:吐出槟榔,咀嚼30 min后。
3 讨 论
3.1咀嚼槟榔前后口腔微生态研究 本研究通过高通量测序平台对8名健康成年人在咀嚼槟榔前、咀嚼5 min后和咀嚼30 min后的唾液进行对比分析,来探讨口腔微生物菌群结构分布及微生物群落多样性。研究结果表明,在已知检出的高丰度菌群中,大部分菌群在咀嚼槟榔5 min后较咀嚼前微生物群落多样性降低,包括链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、纤毛菌属(Leptotrichia)、嗜血杆菌属(Haemophilus)、拟普雷沃菌属(Alloprevotella)、普雷沃菌属(Prevotella)、卟啉单胞菌属(Porphyromonas)、梅毒螺旋体_2(Treponema_2)、颗粒链菌属(Granulicatella)、兼性双球菌属(Gemella)。而在咀嚼5 min后,吐出槟榔,30 min后,少数菌群如纤毛菌属(Leptotrichia)、嗜血杆菌属(Haemophilus)、拟普雷沃菌属(Alloprevotella)、卟啉单胞菌属(Porphyromonas)、梅毒螺旋体_2(Treponema_2)、罗思菌属(Rothia)微生物群落多样性增大。特别地,链球菌属(Streptococcus)、韦荣球菌属(Veillonella)作为主要变化的菌属在咀嚼槟榔的过程中,对口腔产生一定的作用,可能是口腔龋齿等牙周疾病的直接或间接影响因子,其作用机制还需进一步验证。
人口腔在咀嚼槟榔5 min后,口腔快速与槟榔进行互相作用,槟榔中的槟榔碱、槟榔次碱等生物碱发挥一定的毒性作用,表现在明显的抑菌方面,导致菌群数量减少[9]。此外,附着在口腔内壁上的正常菌群由于口腔咀嚼机械性运动,口腔内壁不断与槟榔进行摩擦,这也可能是导致大部分菌群数量减少的原因。而当咀嚼5 min后,吐出槟榔,30 min后,口腔中没有进行任何咀嚼活动及进食,口腔内大部分菌群数量明显增多,口腔重回内环境稳态。乳球菌属(Lactococcus)和加德纳菌属(Gardnerella)在咀嚼5 min后检出,这可能是槟榔本身带入的外源性菌属。而链球菌属(Streptococcus)、普雷沃菌_7属(Prevotella_7)、韦荣球菌属(Veillonella)、奈瑟菌属(Neisseria)成为主要变化的菌属,作为口腔微生物的重要成员,其自身的存在是口腔内环境稳态的基础。这些菌群呈高丰度分布,维持着微生物之间及微生物与宿主之间相互作用。
3.2咀嚼槟榔对口腔及口腔菌群关系的影响 在咀嚼槟榔时,牙齿接受槟榔的不断往复摩擦,牙床松动,牙龈红肿,导致牙周炎症。链球菌属(Streptococcus)和韦荣球菌属(Veillonella)作为龋齿、牙周炎等口腔疾病的参与者,发挥了重要的作用。在中国,食用槟榔是经过槟榔鲜果加工而产生的一种咀嚼食品,具有高甜度的特点。当短时接触高甜度食品,口腔中微生物产酸能力增大,正常情况下,口腔唾液具有缓冲作用,产酸耐酸菌群的产酸能力超过唾液缓冲能力后,牙菌斑中对酸性环境敏感的菌群生长受到抑制,导致产酸耐酸菌成为优势菌种,最终出现龋齿[10-11]。链球菌属(Streptococcus)是龋齿患者口腔中的优势菌,尤其是产酸链球菌在龋齿患者口腔中分布更多[12-13]。韦荣球菌属(Veillonella)作为龋齿活动口腔中的高丰度分布菌属,其丰度及多样性也影响口腔健康[14]。韦荣球菌属(Veillonella)不能直接代谢糖类产酸,但它能利用链球菌属产生的次级代谢产物如琥珀酸、丙酮酸、乳酸等作为营养物来源[15],这也提示链球菌属(Streptococcus)和韦荣球菌属(Veillonella)作为协同菌在龋齿等牙周疾病中发挥了重要作用,但两者协同的具体机制还需进一步研究。此外,增大样本量也是下一步研究开展的关键步骤,由于个体差异性,不同个体的口腔健康情况直接影响研究的进行,因此,排除个体差异性同样重要。
[1] Zuckerman AJ. Betel-quid and areca-nut chewing and some arecanut-derived nitrosamines[J]. BMJ, 1990, 48(7): 161-179.
[2]Ko YC, Chiang TA, Chang SJ, et al. Prevalence of betel quid chewing habit in Taiwan and related sociodemographic factors[J]. J Oral Pathol & Med, 1992, 21(6): 261-264.
[3]Trivedy CR, Craig G, Warnakulasuriya S. The oral health consequences of chewing areca nut[J]. Addict Biol, 2002, 7(1): 115-125.
[4]Walter J, Tannock GW, Tilsalatimisjarvi A, et al. Detection and identification of gastrointestinalLactobacillusspecies by using denaturing gradient gel electrophoresis, and species-specific PCR primers[J]. Appl Environ Microbiol, 2000, 66(1): 297-303.
[5]Edgar, Robert C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods, 2013, 10(10): 996-998.
[6]Wang Q, Garrity GM, Tiedje JM, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Appl Environ Microbiol, 2007, 73(16): 5261-5267.
[7]Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucl Acids Res, 2013, 41: D590-D596.
[8]Edgar RC. MUSCLE: Multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Res, 2004, 32(5): 1792-1797.
[9]XIONG Xiong, LI Ke, YI Shu-han, et al. Progress on toxicity and physiological activity of arecoline in edible areca[J]. Sci Technol Food Indust, 2017(20): 328-335. (in Chinese)
熊雄, 李珂, 易书瀚, 等. 食用槟榔中槟榔碱毒性及生理活性研究进展[J]. 食品工业科技, 2017(20): 328-335.
[10] WANG Yuxia, ZHOU Xuedong, LI Mingyun. A review on the role ofVeillonellain caries and its interaction withStreptococcus[J]. Int J Stom, 2017, 44(2): 195-199. (in Chinese)
王玉霞, 周学东, 李明云. 韦荣球菌与龋病和链球菌间的关系[J]. 国际口腔医学杂志, 2017, 44(2): 195-199.
[11] Marsh PD. Microbiology of dental plaque biofilms and their role in oral health and caries[J]. Dent Clin North Am, 2010, 54(3): 441-454.
[12] Peterson SN, Snesrud E, Liu J, et al. The dental plaque microbiome in health and disease[J]. PLoS One, 2013, 8(3): e58487.
[13] Oda Y, Hayashi F, Okada M. Longitudinal study of dental caries incidence associated withStreptococcusmutansandStreptococcussobrinusin patients with intellectual disabilities[J]. BMC Oral Health, 2015, 2(15): 102-106.
[14] Do T, Sheehy EC, Mulli T, et al. Transcriptomic analysis of threeVeillonellaspp. present in carious dentine and in the saliva of caries-free individuals[J]. Front Cell Infect Microbiol, 2015, 5(25): 21-28.
[15] Mikx FH, van der Hoeven JS. Symbiosis ofStreptococcusmutansandVeillonellaalcalescensin mixed continuous cultures[J]. Arch Oral Biol, 1975, 20(7): 407-410.
