亚胺培南西司他丁不同滴注速度对重症肺炎疗效的影响
2018-04-24杜月君徐治波成都市第二人民医院四川成都6007成都大学附属医院四川成都6008
宋 磊,陈 红,杜月君,徐治波,冯 薇 (.成都市第二人民医院,四川 成都 6007;.成都大学附属医院,四川 成都 6008)
肺炎是严重危害人类生命健康的一种常见呼吸道感染性疾病,其病原菌的组成及耐药特性有着区域性的差异,且随着时间的推移在不停变化,在人类感染性疾病死亡率中居于首位,在人类疾病总死亡率中排第五位或第六位。对于危及生命的重症肺炎而言,其除了具有肺炎常见的呼吸道症状以外,还存在呼吸衰竭,常常导致其他系统出现损伤,甚至死亡。目前的抗生素和支持治疗已经有了很大进步,但该病病死率仍然很高。早期给予恰当的抗生素是治疗重症肺炎的核心,目前提倡早期选用广谱强效的抗生素进行经验性治疗。
亚胺培南西司他丁为碳青霉烯类抗生素,是一种广谱的β内酰胺类抗生素,呈时间依赖性杀菌作用,具有抗菌谱广、抗菌效力强、耐酶、低毒且稳定的特点。研究发现其在多重耐药所致的感染中具有举足轻重的作用[1]。要做到对体内抗菌药物疗效的评价和预测,抗菌药物合适的剂量的选择,需要综合PK/PD的特性来判断[2]。作为时间依赖性抗生素,其杀菌作用与T>MIC有关。早期研究表明,当浓度达到MIC的4倍时,β-内酰胺类抗生素的杀菌作用达到最大值[3]。因此T>MIC有助于指导临床给药方案的合理制定,临床常用的给药方式为静脉给药。国外多项研究指出持续静脉滴注给药方式的临床疗效优于间歇多次给药,这在如铜绿假单胞菌所致感染的难治性病原体治疗中尤为突出,是目前临床上最佳的给药方案[4-5]。为做到合理用药,使临床疗效最大化,有人提出改良的药动学/药效学,即通过增加给药量,增加给药次数,延长静脉滴注时间[6]。但随着药物剂量及输注次数的增加,药物的不良反应必然会增加。因此在不增加药物剂量和药物输注次数的前提下,仅仅通过增加药物滴注时间能否获得更好的临床效果,现将研究过程与结果报告如下。
1 资料与方法
1.1 一般资料:2014年3月~2016年2月于成都市第二人民医院住院患者66例,符合重症肺炎诊断标准,男40例,女26例,平均年龄(68.15±6.90)岁。分组:试验组33例,亚胺培南西司他丁钠1 g/2 h输注每8小时给药。对照组33例,亚胺培南西司他丁钠1 g/0.5 h输注每8小时给药。试验组33例 ,其中男22例,女11例,平均年龄(67.9±8.27)岁,平均病程(12.9±6.41)d,平均呼吸频率(29.9±3.30)次/min,治疗过程中行有创机械通气2例,死亡1例。对照组33例,男18例,女15例,平均年龄(69.1±6.30)岁,平均病程(13.0±5.54)d,平均呼吸频率(29.6±3.23)次/min,治疗过程中行有创机械通气3例,其中2例死亡。两组患者一般情况及入院后初始评价的年龄、病程、呼吸频率比较,差异无统计学意义(P>0.05),具有可比性。见表1。
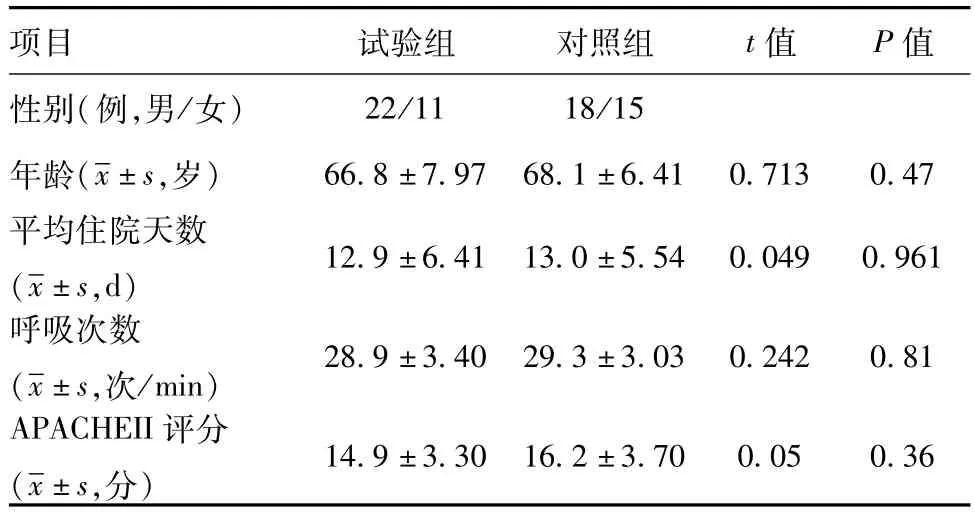
表1 两组患者一般情况比较
1.2 主要试验试剂
1.2.1 主要试剂:亚胺培南西司他丁钠,美国默沙东公司(杭州)生产,规格:500 mg/支。
1.2.2 试验器材:WZ-50F6(双道)微量注射泵入(浙江史密斯医学仪器有限公司);50 ml注射器;微泵延长管。
1.3 纳入标准及排除标准
1.3.1 纳入标准:重症肺炎诊断符合IDSA/ATS于2007年发表的成人CAP处理的共识指南。
1.3.2 排除标准:①有明显肾功能不全者,肌酐清除率≤70 ml/(min·1.73 m2)需要减量治疗的患者或治疗过程中肾功能损害明显,需要药物减量者;②存在吸入性危险因素的患者,存在心功能不全、脑出血、上消化道出血的住院患者;③既往有癫痫病史的患者;④既往有意识障碍史患者。
1.3.3 剔除标准:①治疗过程中需入住RICU的患者;②需应用有创机械通气者;③治疗过程中死亡的患者。
1.3.4 肺炎临床稳定的标准:①体温(T)≤37.8℃;②心率(HR)≤100次/min;③呼吸频率(R)≤24次/min;④血压(Bp):收缩压≥90 mm Hg(1 mm Hg=0.0133 3 kPa);⑤呼吸室内空气条件下SpO2≥90%或PaO2≥60 mm Hg;⑥能够口服进食;⑦精神状态正常。
1.4 方法:①抗菌药物的调整:治疗3 d,根据肺炎临床稳定的标准评估病情及病原菌药敏调整目标抗生素使用,并于第5天及第10天再次评估。②药物输注方式:微泵泵入的方式控制药物滴注速度。③炎性指标检测:用药前抽血送检PCT、CRP,并于停药当日再次抽血送检。④痰液标本的留取:清水漱口,用力咯痰留取标本;无法咯痰者,采用无菌吸痰的方式留取标本。
1.5 临床疗效评价:疗效判断标准根据卫生部药政局《抗生素临床研究指导原则》为标准,分为如下四种:痊愈:症状、体征、实验室检查和病原学四项全部恢复正常;显效:病情明显好转,但上述四项观察指标中有一项未完全恢复至正常;进步:通过治疗后病情有好转,但尚未达到显效的标准;无效:用药72 h后病情无明显改善或者病情反而进一步加重;总有效率=(痊愈例数+显效例数)÷总例数×100%。
1.6 细菌学评价:治疗前和治疗后均对痰液进行细菌学检查,痰涂片和痰培养是同步进行的。根据检验结果通过计算细菌清除率来进行比较。细菌学疗效评价:按病原菌清除、部分清除、未清除、菌群交替四级来统计细菌的清除率:清除:治疗结束后原有的病原菌完全消失;部分清除:原有超过两种病原菌,但治疗结束后其中的一种病原菌被清除;未清除:原有的致病菌在结束治疗后依然存在,但未出现新的菌种;菌群交替:在治疗结束后第1天的留取的痰标本中分离出新的病原菌,并出现感染症状和体征。
1.7 统计学方法:采用SPSS17.0统计软件包统计,以P<0.05为差异有统计学意义,计量资料比较应用均数±标准差(x±s)表示,组间差异分析以及两样本均数比较采用t检验。计数资料用例数和百分比(%)表达,采用χ2检验,检验水准α=0.05。
2 结果
2.1 两组CRP、PCT治疗前后比较:试验组与对照组治疗前比较,差异无统计学意义(P>0.05),治疗后试验组与对照组比较,差异具有统计学意义(P<0.05)。见表2。治疗前试验组PCT与对照组PCT比较,差异无统计学意义(P>0.05),治疗后试验组与对照组比较,差异具有统计学意义(P<0.05)。见表2。
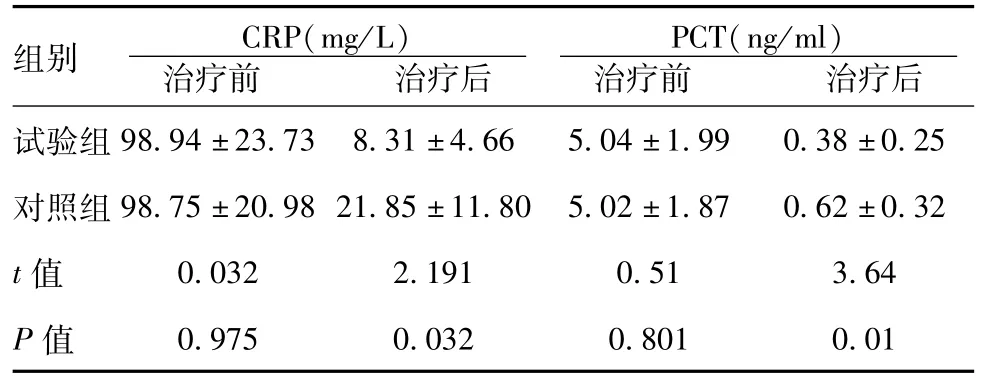
表2 两组患者CRP、PCT治疗前后比较(x±s,n=33)
2.2 两组细菌清除率比较:试验组清除率(86.36%)明显高于对照组(57.89%)清除率,差异有统计学意义(P<0.05)。见表3。
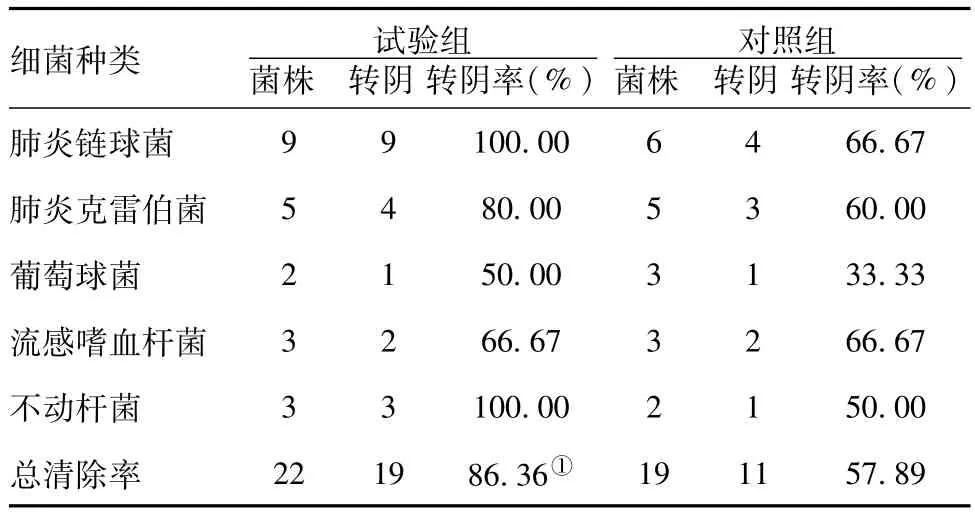
表3 两组细菌清除率比较(n=33)
2.3 两组临床疗效比较:试验组与对照组比较,试验组有效率明显高于对照组,差异有统计学意义(P<0.05)。见表4。
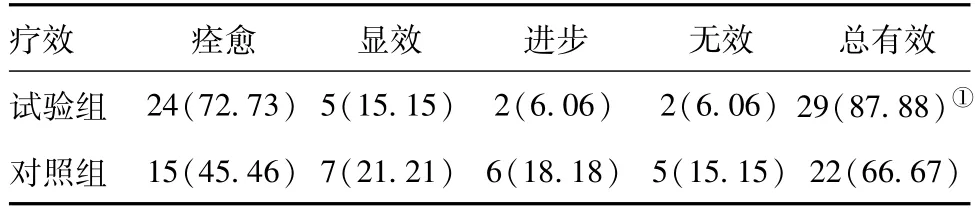
表4 两组临床疗效比较[例(%),n=33]
2.4 两组平均住院天数比较:试验组平均住院天数为(10.5±1.7)d,对照组为(12.2±1.9)d,提示试验组较对照组疗程缩短,两组差异有统计学意义(P<0.05)。见图1。
图1 两组患者住院天数比较
2.5 两组不良反应比较:治疗过程中亚胺培南西司他丁不良反应发生率低,试验组发生轻度恶心1例,腹泻2例,不良反应发生率10%;对照组腹泻1例,轻度精神症状1例,肝脏酶学轻度升高1例,不良反应发生率10%。试验组与对照组不良反应发生率相等,差异无统计学意义(P>0.05)。
3 讨论
重症肺炎为严重的呼吸道感染,是老年人最重要的死亡原因之一[7]。尤其医院获得性重症肺炎,常见于 ICU及RICU,临床病死率高[8]。目前重症肺炎的治疗推荐“重拳猛击”的原则,即在获得微生物学培养结果之前,给予广谱抗生素治疗,尽可能覆盖可能的致病菌。在用药48~72 h,当病情得到有效控制、临床症状改善、体温下降,再根据细菌学及药敏报告调整相应抗生素。近些年随着细菌耐药性增加及多重感染的出现,使得初始治疗抗菌药物的选择显得尤为重要。有研究发现,如果病原菌对初始抗生素耐药,会明显增加死亡率[9]。亚胺培南西司他丁具有比其他抗生素高效、广谱、高耐酶性的特点,已成为临床上治疗严重院内外感染、耐药菌、多重感染的有效抗菌药物[10]。时间依赖性为其药代学特性,当β内酰胺类药物T>MIC的时间达给药间期的40%~50%时,可达85%以上的临床疗效,当T>MIC的时间达给药间期的60%~70%时,可获得最佳细菌学疗效[11]。尽管碳青霉烯类抗生素在给药间隙要求高于MIC的40%,但在鼠类动物大腿感染模型中的研究表明,给药间隙中浓度高于MIC的20%即可对大肠杆菌和绿脓杆菌有抑菌作用[12],此研究也间接说明即使亚胺培南西司他丁维持较低的药物浓度亦可发挥抗菌活性,也为我们延长给药时间提供了实验室证据。除此之外,亚胺培南西司他丁具有较强的抗生素后效应,当血液内药物浓度低于最低抑菌浓度或药物消除以后,依然能持续抑制细菌的繁殖,使其不能恢复正常,因此可适当延长药物滴注时间--只有达到合适的T>MIC的期望值,才能保证较好的抗菌疗效。
本研究通过观察亚胺培南西司他丁不同滴注时间治疗66例入组重症肺炎患者疗效,并通过对两组CRP、PCT、细菌清除率、临床疗效、住院天数的比较发现,试验组的数据明显优于对照组,2 h给药组对重症肺炎的治疗效果优于0.5 h给药组,差异有统计学意义(P<0.05)。说明通过延长亚胺培南西司他丁滴注时间能够对重症肺炎的治疗产生更好的临床效果。由此推测采取延长抗菌药物滴注时间的给药方式,可产生更好的药代学效果。
此外,碳青霉烯类抗生素存在不良反应,主要为中枢神经毒性症状,胃肠道损害(恶心、呕吐、二重感染、菌群失调)及皮疹。本研究药物输注过程中出现6例不良反应,腹泻3例,恶心症状1例,轻度精神症状1例,轻微肝脏酶学改变1例。腹泻原因考虑由于强有力的广谱抗生素的使用,破坏了肠道菌群平衡,给予调节菌群失调的药物后患者未再腹泻。精神症状考虑与碳青霉烯类抗生素神经毒性有关。以上不良反应症状均表现轻微,给予相应的干预措施后均好转,不影响药物继续使用。总的来说相对于其他β-内酰胺类抗生素,碳青酶烯类抗生素不良反应发生率较低。
总之,亚胺培南西司他丁是一种具有广谱抗菌活性的药物,对治疗严重细菌感染安全、有效、耐酶的优点,同时临床上不良反应发生率低。本研究结论验证了通过延长亚胺培南西司他丁滴注时间可提高其临床疗效及杀灭细菌的能力,可以缩短患者住院时间,减少医疗费用,节约社会卫生资源。
[1] Nicolau DP.Carbapenems:a potent class of antibiotics[J].Expert Opinion on Pharmacotherapy,2008,9(1):23.
[2] Mouton J W,Dudley M N,Cars O,et al.Standardization of pharmacokinetic/pharmacodynamic(PK/PD) terminology for anti-infective drugs:an update[J].Int J Antimicrob Agents,2002,19(4):355.
[3] Craig WA.Basic pharmacodynamics of antibacterials with clinical applications to theuseofb-lactams,glycopeptides,andlinezolid[J].Infect Dis Clin N Am,2003;17(3):479.
[4] Krueger WA,Bulitta J,Kinzig-Schippers M,et al Evaluation by Monte Carlo simulation of the pharmacokinetics of two doses of meropenem administered in termittently or as a continuous infusion in healthy volun teers[J].Antimicrob Agents Chemother,2005,49(5):1881.
[5] Kasiakou SK,Lawrence KR,Choulis N,et al.Continuous versus intermittent intravenous administration of antibacterials with time dependent action:a systematic review of pharmacokinetic and pharmacodynamic parameters[J].D rugs,2005,5(17):2499.
[6] Mattoes H M,Kuti JL,Drusano G L,et al.Optimizing antimicrobial pharmacodynamics:dosage strategies for meropenem[J].Clinical Therapeutics,2004,26(8):1187.
[7] 王 辉,刘亚丽,陈民钧,等.2009-2010年中国六城市成人社区获得性呼吸道感染病原菌耐药性监测[J].中华结核和呼吸杂志,2012,35(2):113.
[8] Eylem Sercan¨O,Elif Sahin H,Kerem K,et al.Ventilatorassociated pneumonia due to extensive drug-resistant Acinetobacter baumannii:risk factors,clinical features,and outcomes[J].American Journal of Infection Control,2014,42(2):206.
[9] Uvizl R,Hanujik V,Husickova V,et al.Hospital-acquired pneumonia in ICU patients.Biomed Pap Med Fac Univ Palacky Olo-mouc Czech Repub,2011,155(4):373.
[10] 夏俊亭,李 凯,李贵珍,等.碳青霉烯类抗生素的研究紧张[J].广州化工,2009,37(4):65.
[11] 汪 复.实用抗感染治疗学[M].北京:人民卫生出版社,2005:73-75.
[12] Drusano G L.Prevention of resistance:a goal for dose selection for antimicrobial agents[J].Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America,2003,36(Suppl 1):S42.
