一起副溶血弧菌感染食物中毒病原学检测
2018-04-23姜大栋李琦
姜大栋 李琦
1 流行病学调查
2017年05月30日20时, 本疾控中心接到辖区某医院的电话, 称有两批不同旅行团人员在该医院就诊。本中心值班人员赶到医院发现, 分别为某内蒙旅行团(游客29人)及某湖北旅行团(游客35人), 共有患者15例, 患者均在2017年05月30日12时进食了由本辖区某旅游定点餐厅提供的食品,30日17时部分患者有恶心呕吐、头晕头痛、腹泻腹痛以及水样便等临床症状, 30日20时有以上中毒症状的患者15例。本次同时进餐有64人, 15例发病, 潜伏期时间在5~8 h, 发病症状相似, 采用抗生素、补充液体等治疗后病情好转明显,采集其标本并检测其中细菌性。
2 材料与方法
2.1 样品 采集疑似食物中毒患者的15份肛拭子、10份残余剩饭, 5份茶碗涂抹样, 标本共30份。
2.2 试剂与仪器 营养肉汤、3%氯化钠碱性冻水、GN增菌液等所用干粉培养基由北京路桥技术有限公司购买, API条由法国梅里埃公司生产, 法国科马嘉显色弧菌培养基, 反应预混液及模板tdh, trh均购自江苏硕世生物科技工程有限公司[1]。仪器温箱(上海新苗), 荧光定量PCR仪器(美国AB7500)。
2.3 检测方法 食品卫生微生物学检验方法《GB/T4789-2010》及副溶血性弧菌荧光定量PCR检验方法[2]。
2.4 质量控制 鼠伤寒沙门ATCC14028、副溶血性弧菌ATCC17802、大肠0157:H7 NCTC12900(南京宇微有限公司生产), PCR质控菌株O3:K18(江苏硕世生物科技工程有限公司 )[3]。
3 实验室检测过程及结果
3.1 样本共30份, 送至疾控检验室进行检测, 具体项目有沙门氏菌、致泻大肠埃希氏菌、副溶血性弧菌以及志贺氏菌[4]。
3.2 检测步骤及结果
3.2.1 增菌与分离培养 样品接种营养肉汤、3%氯化钠碱性冻水、革兰阴性杆菌增菌培养液(GN增菌液)、亚硒酸钠增菌液(SF增菌液), 志和菌增菌肉汤 , 经 37℃18~24 h增菌, 然后在普通营养琼脂平板、SS琼脂平板、科马嘉显色平板以及麦康凯平板上进行转种, 严格按照国家标准进行操作,对菌落的形态进行仔细观察, 同时选择可疑菌落进行革兰氏染色镜检。结果有13份样品在科马嘉显色平板上菌落呈现为隆起, 圆形, 淡紫色菌落, 镜检均为革兰阴性无芽孢短小杆菌, 疑似副溶血性弧菌。
3.2.2 副溶血弧菌生化 初步生化见表1。副溶血弧菌API生化鉴定见表2。
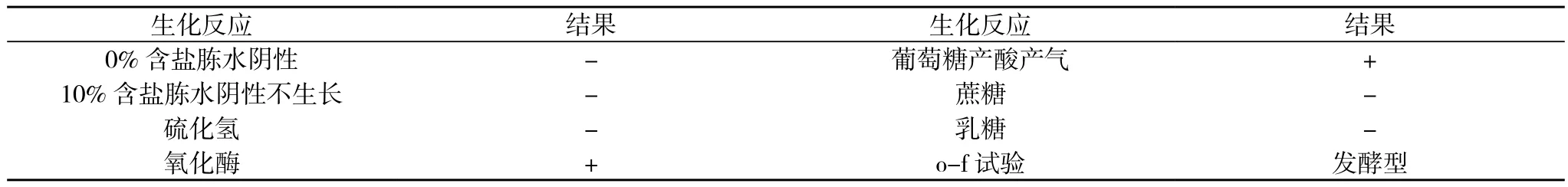
表1 副溶血弧菌生化检测结果
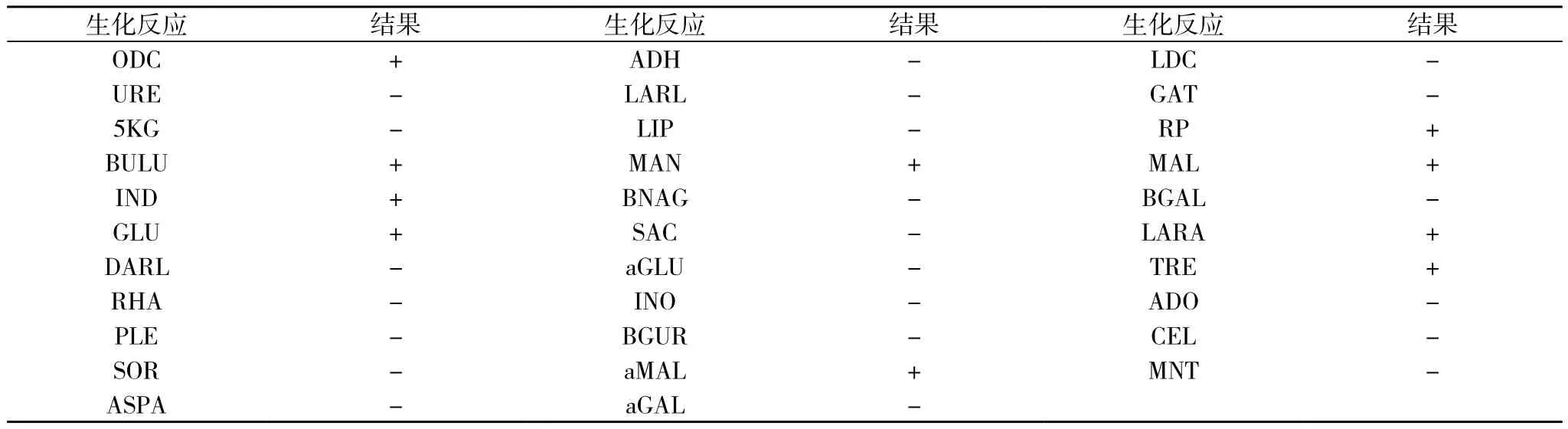
表2 副溶血弧菌API生化鉴定结果
3.3 血清学分型若菌株为副溶血性弧菌, 则采用营养琼脂37℃进行接种, 培养18~24 h, 培养物采用较浓3%食盐水,在100℃温度下进行煮沸, 进行(O)抗血清玻片凝集试验, 选择对照为使用无菌生理盐水, 在高盐血平板上接种13株副溶血性弧菌。结果高盐血平板上呈现透明溶血环, 为“神奈川现象”阳性, 凝集反应出现阳性, 为O3:K6。
3.4 荧光定量PCR检测副溶血性弧菌毒力基因tdh和trh
3.4.1 荧光PCR样品准备 将分离到的13株副溶血性弧菌划线接种弧菌显色培养基, 36℃培养18~24 h。取菌落于含1 ml生理盐水的1.5 ml离心管中制成菌悬液, 震荡混匀, 4000 转离心5 min弃上清, 于原管中加入1 ml无菌超纯水, 震荡混匀, 100℃加热15 min, 12000转离心10 min, 取上清-20℃保存, 作为PCR扩增模板备用。
3.4.2 荧光定量PCR体系检测 按说明书配制反应体系25 μl, 体系加入随机引物 1 μl。 PCR反应条件95℃预变性120 s, 45个循环[95℃变性20 s, 56℃退火28 s(检测荧光信号), 72℃延伸30 s]。tlh基因阳性记为副溶血性弧菌阳性。tdh、trh 任一基因阳性则应判定为副溶血性弧菌毒力基因阳性。于FAM通道检测荧光信号, CT≤35 循环为典型的S形扩增曲线为阳性。每次用质控菌株作阳性对照, 采用DEPC水作空白。
3.4.3 检测结果 13株菌株tlh、tdh基因均为阳性, trh基因均为阴性。见图1。

图1 13株副溶血性弧菌分离株tdh基因荧光定量PCR 检测结果
4 讨论
大连是一个沿海地区, 餐馆酒楼常会涉及到海产品的处理, 但是若厨具、生熟食品分开不及时, 容易造成交叉污染[5-7]。此次食物中毒事件中, 在同一饭店就餐不同旅行团的15例患者中的12份肛拭子标本中检测到副溶血性弧菌,同时在l份食品样品中检出了副溶血性弧菌且血清型同为O3:K6;神奈川(kanagawa)试验显示13株检出的副溶血性弧菌都有溶血现象, 说明这些菌株具有致病性;且全部13株菌的tdh基因呈阳性, 提示副溶血性弧菌的污染是本次食物中毒的致病因子。
近年来荧光定量PCR技术得到广泛应用, 该检测方法具有快速, 自动化程度高, 特异性强, 无需电泳, 污染性小的特点。副溶血性弧菌毒力基因的检测已成为重要的技术手段,tdh基因在患者标本中的检出率很高, 但在食品和环境中的检出较少, 而trh在患者和其它标本中的检出率更低, 提示其在食物中毒病原检测中的重要性[8-10]。通过此次事件发现该餐厅消毒设施较差, 本地区春夏季气温温暖, 容易造成海产品中弧菌滋生, 造成食物中毒。餐馆卫生需要卫生监督部门严格管理、监督, 及时有效对餐馆人员进行卫生教育宣传,增强执法力度。
[1] 姜大栋, 赵大磊.对2013年我辖区一起由两种菌混合感染的食物中毒的实验室检验分析.中国保健营养(下旬刊), 2014,24(1):472-473.
[2] 李博, 陈辉, 袁梦, 等.一起由副溶血性弧菌引起的食物中毒病原学分析.中国保健营养(下旬刊), 2012, 22(7):2229.
[3] 骆艳婷, 梁景涛, 陈爱贞 , 等.佛山市副溶血弧菌病原学与分子流行病学特征.热带医学杂志, 2016, 16(5):677-680.
[4] 张海央, 陈辉华, 王倩倩, 等.一起因同源进餐致疑似副溶血弧菌感染食物中毒事件调查.现代预防医学, 2015, 42(12):2170-2171.
[5] 李欣彤, 陈永军 , 刘迎春, 等 .副溶血弧菌TDH蛋白高效表达、免疫原性分析及初步应用.中国动物传染病学报, 2015,23(6):56-62.
[6] 董雪红.副溶血弧菌诱导的Notch分子参与天然免疫应答作用的初步研究.上海海洋大学, 2015.
[7] 冼钰茵.副溶血弧菌与溶藻弧菌毒力基因分布与抗生素耐药性分析.暨南大学, 2015.
[8] 孙海波.一起副溶血性弧菌引起的食物中毒调查.医学信息,2015(26):288.
[9] 徐秋芳, 童锐, 费琼, 等.一起副溶血性弧菌食物中毒的病原学检测与分析.上海交通大学学报(医学版), 2013, 33(3):377-379.
[10] 施新萍, 胡立群, 胡薇薇.一起副溶血性弧菌引起食物中毒的病原学鉴定.中国卫生检验杂志, 2011(6):1445-1447.
