几丁质酶对香菇多糖提取的影响
2018-04-21李俊峰张扬扬
李俊峰,张扬扬,李 明
(通化师范学院食品科学与工程学院,吉林通化 134001)
香菇为担子菌亚门,担子菌纲,伞菌目,侧耳科。香菇属真菌,因其口味鲜美、香味浓郁、营养丰富,有显著的药用及滋补作用而被誉为“蘑菇皇后”“抗癌新兵”“菌中之秀”[1]。香菇多糖是从香菇中分离出的一种高纯度、高分子结构的葡聚糖[2],在免疫调节[3]、抗肿瘤[4]、抗病毒和抗感染等方面有很强的活性,其疗效高、毒副作用小,具有很高的研究和开发价值。因此,香菇多糖被广泛应用于食品工业、发酵工业、医疗保健等领域[5-6]。目前,多糖的提取方法主要有热水浸提法、超声波提取法、稀酸稀碱浸提法、微波提取法、酶解法等几种方法[7]。传统的浸提法时间长、得率低、能耗大,为克服传统提取方法的缺点,许多学者研究了亚临界水提取法[8],超临界二氧化碳萃取技术与热水浸提法[9-10],超滤膜技术提取法[11]、纤维素酶协同超声波法[12]、响应面法优化热水浸提法[13]等。
研究显示,在香菇等真菌类食品原料中,活性多糖主要存在于由纤维素和几丁质构成的细胞壁中[14]。为了提取活性多糖,首先必须破坏纤维素和几丁质在细胞壁中构成的网络结构,从而将活性多糖释放出来,才能充分并有效地提取活性多糖。但是,在现有的酶法提取香菇多糖的试验中,主要研究纤维素酶、果胶酶和蛋白酶对香菇多糖提取的影响,而几丁质酶在香菇多糖的提取研究中还没有报道,而几丁质酶的存在可能会阻碍一部分活性多糖的释放,导致活性多糖不能被充分提取。
试验首次采用几丁质酶辅助提取香菇多糖,并与纤维素酶、果胶酶和木瓜蛋白酶进行对比,从而考查几丁质酶对酶法提取香菇多糖得率的影响。研究结果对补充香菇多糖提取的研究内容、促进香菇多糖的开发与应用具一定的意义。
1 材料与方法
1.1 试验材料
干香菇(市售);苯酚、浓硫酸、无水乙醇、葡萄糖等试剂均为分析纯;几丁质酶(活力≥200 U/g)、纤维素酶(活力≥400 U/mg)、果胶酶(活力≥50 U/g)、木瓜蛋白酶(活力≥800 U/mg),上海一基实业有限公司提供。
1.2 仪器与设备
FW-200型高速万能粉碎机,北京中兴伟业仪器有限公司产品;SY200型振动筛,新乡市特昌振动机械有限公司产品;TDL-40B型离心机,上海安婷科学仪器厂产品;RE-2000型旋转蒸发仪,郑州市煜城仪器有限公司产品;722S型可见分光光度计,上海精密科学仪器有限公司产品。
1.3 试验方法
1.3.1 香菇多糖的提取
(1)工艺流程。粉碎→过筛→称量→提取→抽滤→旋转蒸发→醇沉→离心→多糖。
(2) 香菇多糖的提取。将干香菇粉碎过80目筛,称取一定量香菇干粉,回流提取,将提取液进行抽滤,浓缩至1/3左右,用4倍体积的95%乙醇浸提12 h,离心后得到香菇多糖。1.3.2 热水浸提法单因素试验
(1)不同料液比对香菇多糖得率的影响。固定提取温度55℃,提取时间2 h,物料粒度80目,考查料液比为 1∶15,1∶20,1∶25,1∶30,1∶35时,对香菇多糖得率的影响。
(2)不同提取温度对香菇多糖得率的影响。固定料液比1∶25,提取时间2 h,物料粒度80目,考查温度为55,75,85,95,105℃时,对香菇多糖得率的影响。
(3)不同提取时间对香菇多糖得率的影响。固定料液比1∶25,提取温度55℃,物料粒度80目,考查提取时间为1.0,1.5,2.0,2.5,3.0 h时,对香菇多糖得率的影响。
(4)不同物料粒度对香菇多糖得率的影响。固定料液比1∶25,提取温度55℃,提取时间2 h,考查物料粒度为40,60,80,100,120目时,对香菇多糖得率的影响。
1.3.3 正交试验设计
选取料液比、提取时间、提取温度、原料粒度4个因素,进行四因素三水平正交试验,每组试验做3次平行。基于单因素试验结果,选择料液比分别为1∶25,1∶30,1∶35;提取时间分别为 1.5,2.0,2.5 h;粒度60,80,100目;提取温度分别为75,85,105℃进行正交试验。
正交试验设计见表1。
1.3.4 酶法辅助提取香菇多糖
将干香菇粉碎过80目筛,称取5.00 g香菇干粉,加入125 mL蒸馏水中,加入酶制剂,在一定条件下酶解,酶解后于85℃条件下提取2 h,将提取液进行抽滤,在浓缩至1/3左右,用4倍体积的95%乙醇浸提12 h,离心后得到香菇多糖。

表1 正交试验设计
1.3.5 检测方法
利用苯酚硫酸法[15]测定提取物中多糖含量,先制作葡萄糖标准曲线,然后在相同条件下测定样品吸光度,通过代入标准曲线换算出样品得率。

2 结果与分析
2.1 葡萄糖标准曲线的制作
以葡萄糖质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线如图1所示。标准曲线方程为Y=1.528 9X+0.054 4,R2=0.979 6。
葡萄糖标准曲线见图1。
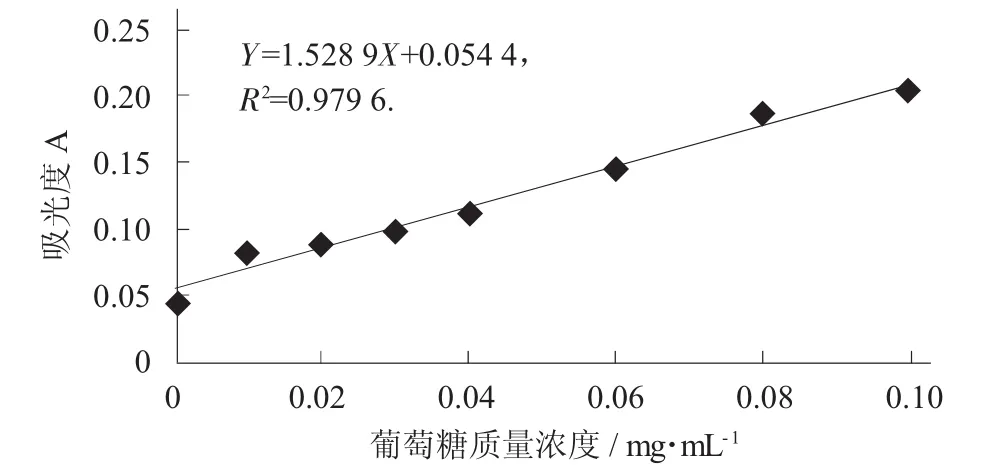
图1 葡萄糖标准曲线
2.2 单因素试验结果与分析
2.2.1 不同料液比对香菇多糖得率的影响
不同料液比对香菇多糖得率的影响见图2。
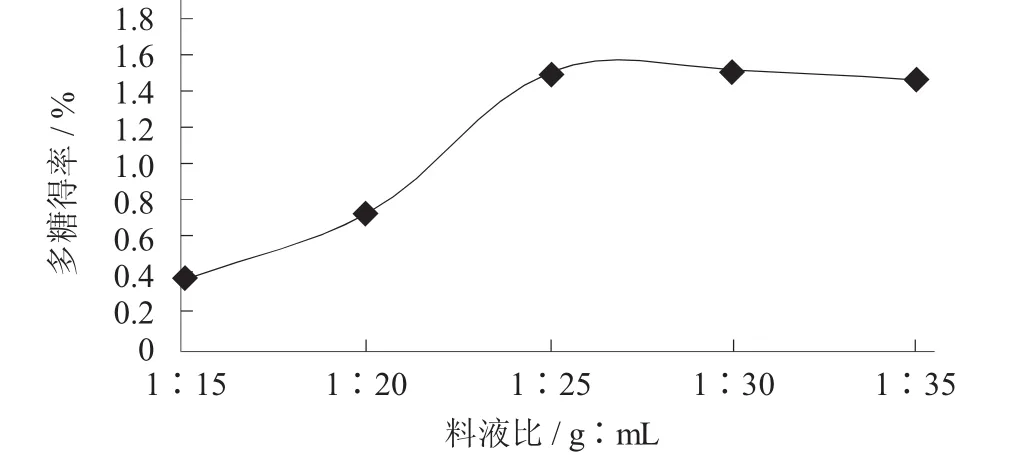
图2 不同料液比对香菇多糖得率的影响
由图2可知,提取过程中,料液比为1∶15~1∶25时,香菇多糖得率逐渐增高,可能是因为随着液料比的增加,提高了多糖从物料颗粒内部向溶剂扩散的传质效率,从而使多糖得率不断上升。当料液比在1∶25~1∶35时,得率的上升具有渐渐放缓的趋势。根据试验所得结果,同时考虑提取成本,选择为1∶25为最佳提取料液比。
2.2.2 不同提取温度对香菇多糖得率的影响
不同提取温度对香菇多糖得率的影响见图3。
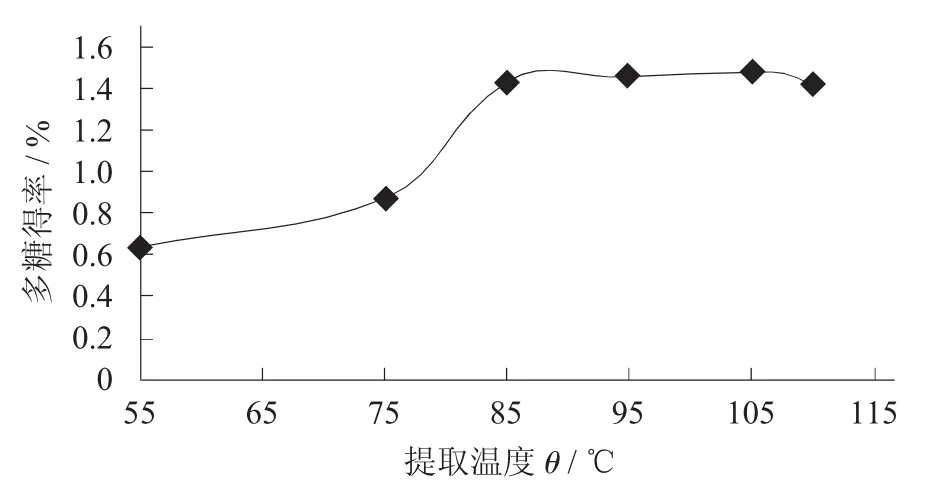
图3 不同提取温度对香菇多糖得率的影响
由图3可知,当提取温度为55~105℃时香菇多糖得率逐渐增高,之后放缓。当提取温度为105℃时达到最大值。这可能是由于温度的上升提高了多糖在水中的溶解度,从而提高了多糖的得率。但是,当提取温度高于85℃时,多糖得率的上升并不显著。因此,为了不增加提取过程的能耗,确定提取温度为85℃。
2.2.3 不同提取时间对香菇多糖得率的影响
不同提取时间对香菇多糖得率的影响见图4。
由图4可知,当提取时间在1~2 h时,随提取时间的增加,香菇多糖得率也随之增高。当提取时间为2 h时,香菇得率最高。当提取时间在2~3 h时,随提取时间的增加,香菇多糖得率降低。这可能是因为提取时间过长,香菇中的其他水溶性成分溶出增加,抑制了香菇多糖的溶出。因此,根据试验结果确定提取时间为2 h。
2.2.4 不同物料粒度对香菇多糖得率的影响
不同物料粒度对香菇多糖得率的影响见图5。
由图5可知,粒度为40~80目时,香菇多糖得率随物料粒度的增加而上升,当物料粒度为80目时,香菇多糖得率最高。当物料粒度在80~100目时,随物料粒度的增加,香菇多糖得率不断降低。这可能是因为粒度过低,在粉碎过程中破坏了香菇多糖的结构,导致多糖得率降低。因此,根据试验结果确定物料粒度为80目。
2.3 正交试验结果与分析
根据正交试验设计表,选取料液比、提取时间、提取温度、原料粒度4个因素,进行四因素三水平正交试验。
正交试验结果见表2。
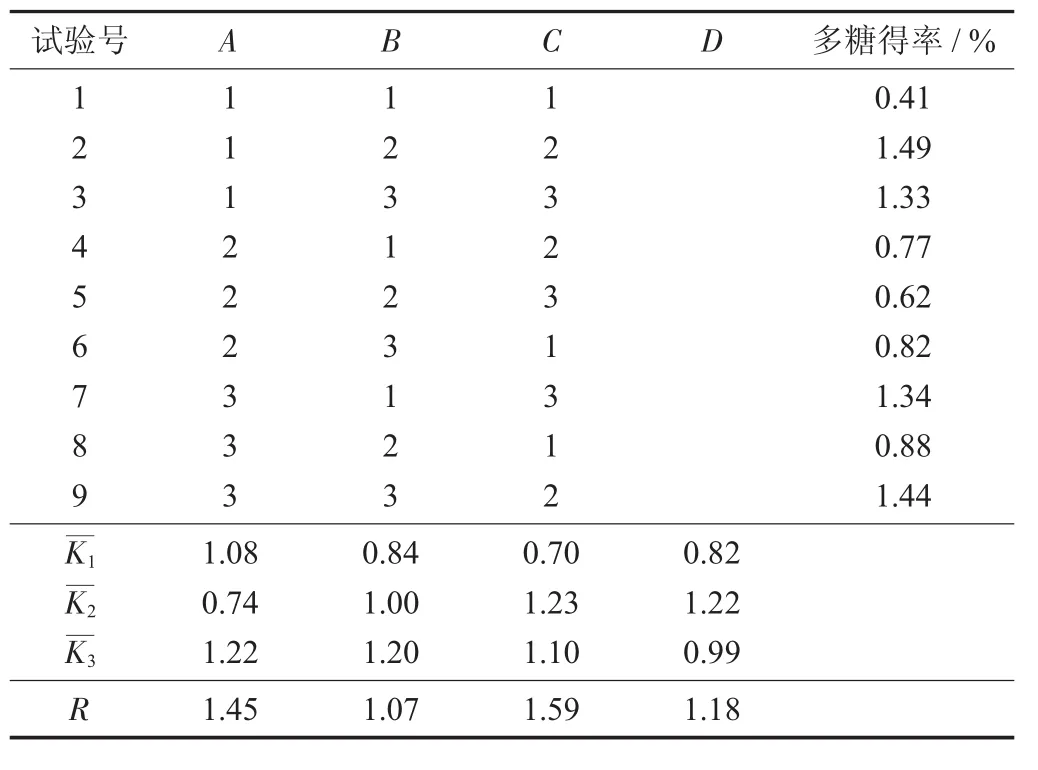
表2 正交试验结果
由表2可知,对香菇多糖得率影响因素由大到小为提取时间>料液比>物料粒度>提取温度。水平2的香菇得率最高,试验结果最好,试验水平组合为A1B2C2D2,而由K值可知,试验最佳组合为A3B2C2D2。验证试验结果为1.678%,得率高于A1B3C2D2。由正交试验可得,香菇多糖最佳提取工艺参数为料液比1∶35,提取温度105℃,提取时间2 h,物料粒度80目,香菇多糖得率为1.678%。
2.4 酶对香菇多糖得率的影响
为了得出几丁质酶对香菇多糖的影响,试验中将几丁质酶与木瓜蛋白酶、果胶酶、纤维素酶的酶法辅助提取结果进行了比较。
不同酶法辅助提取香菇多糖的结果见表3。
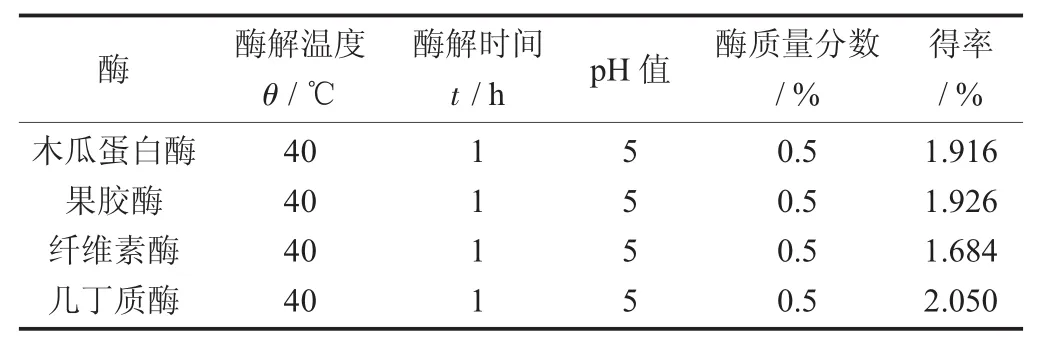
表3 不同酶法辅助提取香菇多糖的结果
通过查阅酶法提取香菇多糖的研究文献,归纳得出木瓜蛋白酶、果胶酶和纤维素酶的最佳酶解条件为酶解温度40℃左右,酶解pH值5左右,酶使用量0.5%左右。因此,为了将不同酶的提取结果进行比较,试验中将4种酶的酶解条件保持一致。
由表3可知,酶法辅助提取香菇多糖的得率都高于水提法,且几丁质酶辅助提取法的得率最高。这一结论说明,为了充分提取存在于香菇细胞壁中的活性多糖,必须破坏纤维素和几丁质在细胞壁中构成的网络结构,仅破坏纤维素、蛋白质和果胶还不足以充分提高多糖的得率。因此,研究结果证明,几丁质酶在提高香菇多糖的得率方面具有显著作用。
3 结论
通过单因素试验和正交试验,考查了不同料液比、提取温度、原料粒度和提取时间对香菇得率的影响,从而得出热水提香菇多糖最佳提取工艺参数为料液比1∶35,提取温度105℃,提取时间2 h,物料粒度80目,香菇多糖得率为1.678%。酶法提取试验得出,木瓜蛋白酶提取香菇多糖得率为1.916%,果胶酶提取香菇多糖得率1.926%,纤维素酶提取香菇多糖得率1.684%,几丁质酶提取香菇多糖得率2.05%。研究结果可以证明,几丁质酶对香菇多糖的提取具有显著的影响。
参考文献:
[1]于淑池,林泽平.香菇的营养保健及免疫调节作用 [J].承德民族师专学报,2003,23(2):82-83.
[2]王格林,林志彬.香菇多糖的药理作用及应用 [J].基础医学与临床,1993(3):79-80.
[3]王国佳,曹红.香菇多糖的研究进展 [J].解放军药学学报,2011,27(5):451-455.
[4]Suzuki M,Iwashiro M,Takatsuki F,et al.Reconstitution of anti-tumor effects of lentinan in nude mice:roles of delayed-type hypersensitivity reaction triggered by CD4-positive T cell clone in the infiltration of effector cells into tumor[J].Japanese journal of cancer research: Gann,1994 (4):1 349-7 006.
[5]胡桂娟,卢慧林,蔡锦源,等.香菇多糖提取方法研究进展 [J].轻工科技,2016,32(11):1-2.
[6]董彩霞,黄建华,祝勇,等.酶解法提取香菇多糖的探讨 [J].光谱实验室,2005(5):947-950.
[7]王文文,刘嘉俊,廖延智,等.高压热水-复合酶提取香菇多糖工艺研究 [J].食品与发酵科技,2015,51(3):27-30.
[8]娄冠群,张永忠,李振艳,等.亚临界水提取香菇多糖的工艺研究 [J].东北农业大学学报,2010,41(2):138-142.
[9]黄赫雁,韩春然,李煜,等.香菇多酚氧化酶活性测定方法的改进 [J].农产品加工,2016(21):32-37.
[10]何卫中,章子贵,张朝晖.超临界流体脱脂改进香菇蛋白多糖分离工艺 [J].食品与发酵工业,2010,36(6):157-160.
[11]李珺,钟耀广,刘长江.超滤膜技术在香菇多糖提取中的应用 [J].北方园艺,2009(1):123-125.
[12]廖伟玲,徐晓飞,冯金源,等.纤维素酶协同超声波法提取香菇多糖的研究 [J].湖南中医杂志,2008,24(6):87-89.
[13]魏桢元,钟耀广,刘长江.响应面优化法对香菇多糖提取的工艺研究 [J].辽宁农业科学,2010(2):11-14.
[14]刘国钧,陈绍业.食品微生物 [M].北京:高等教育出版社,1957:15-18.
[15]徐志祥,李刚,李宝健.苯酚-硫酸法测定灵芝多糖含量的条件研究 [J].食用菌,2000(3):6-8.◇
