三阴型、Luminal型、HER2阳性型乳腺癌瘤组织中FA/BRCA通路基因表达对比观察
2018-04-20马芸段文晶李姝墨董坚杨莹
马芸,段文晶,李姝墨,董坚,杨莹
(1昆明医科大学,昆明650500;2昆明医科大学第一附属医院;3昆明医科大学第三附属医院)
乳腺癌是20~59岁妇女常见的肿瘤相关死亡原因[1,2]。目前临床上参考分子亚型和免疫组化检查结果将乳腺癌划分为Luminal型、HER2阳性型(后简称HER2型)及三阴型三种亚型,而不同亚型乳腺癌的分子病理机制、临床特点、治疗方法及预后各不相同。研究发现有多个范科尼贫血(FA)基因(FA-A、B、C、D1、I、E、F、G、I、J、L、M、N)与乳腺肿瘤易感基因(BRCA)1、BRCA2组成一个复杂的FA/BRCA信号通路,该通路主要调控DNA双链断裂的同源重组修复,在细胞周期调控、细胞凋亡、基因转录与维持基因稳定性等过程中也发挥重要作用[3]。FA/BRCA通路相关蛋白被认为与许多肿瘤的发生发展有密切关系,如乳腺癌、卵巢癌、胰腺癌等[4]。有学者发现FA/BRCA通路的过度激活与肿瘤耐药发生有关,FA基因表达与恶性肿瘤发病及放疗治疗效果关系密切等[5~8]。虽然FA基因在乳腺癌发生发展中的作用已有报道,但关于FA/BRCA通路相关基因在不同亚型乳腺癌中表达情况的研究较少。本研究观察了不同亚型乳腺癌组织中FA/BRCA通路基因的表达差异,以期了解FA/BRCA通路基因表达与乳腺癌分子亚型的关系。
1 材料与方法
1.1 乳腺癌组织标本来源 昆明医科大学第一附属医院乳腺外科2013年5月~2017年9月手术切除的女性患者乳腺癌组织标本共93例份,均为浸润性导管癌,其中直接手术的三阴型乳腺癌、Luminal型乳腺癌、HER2型乳腺癌各20例,行新辅助化疗后的三型乳腺癌分别为11、13、9例。除不同分型的新辅助化疗患者在生育次数方面有统计学差异外,其余各组数据差异均无统计学意义(详见表1)。而生育次数与乳腺癌的相关性报道较少,因此我们认为各组患者资料具有一定可比性。乳腺癌组织和正常组织(距离肿瘤灶>5 cm)手术取材后立即保存于-80 ℃超低温冰箱,随后转入液氮中冻存,用于后续检测。
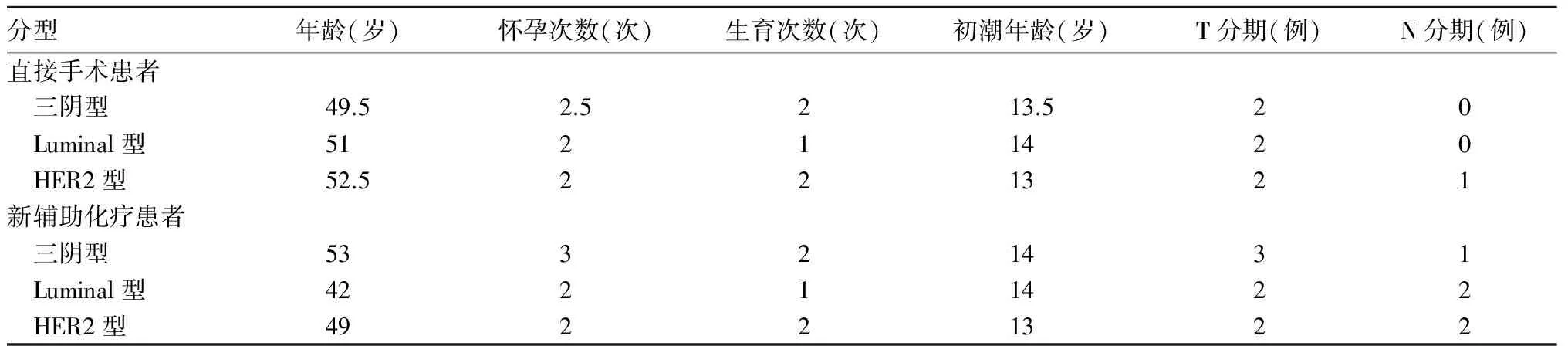
表1 乳腺癌组织来源患者基本资料比较(M)
1.2 三种亚型乳腺癌组织中FA/BRCA通路基因检测 以GAPDH为内参。采用real-time PCR法检测不同分型乳腺癌组织中的FA/BRCA通路基因(FANCA、FANCD2、FANCF、FANCI、BRCA1、BRCA2)。相关引物序列见表2。总RNA提取按照TRIzol试剂说明书进行。逆转录反应参照All-in-OneTMFirst-Strand cDNA Synthesis Kit试剂盒说明书操作。PCR反应条件:95 ℃ 10 s,56 ℃ 20 s,72 ℃ 30 s,40个循环,72 ℃ 10 min。以2-ΔΔCt表示目的基因相对表达量。
1.3 统计学方法 采用Gaphpad Prism6.0进行统计分析。计量资料多组间比较采用LSD法,两两比较采用非配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 直接手术的三种亚型乳腺癌患者肿瘤组织中FA/BRCA通路基因表达情况 对于直接手术的患者,HER2型乳腺癌组织中BRCA1、FANCI、FANCD2基因相对表达量高于对应正常组织,三阴型乳腺癌组织中FANCD2、FANCI基因相对表达量高于相应的正常组织,三阴型、Luminal型、HER2型乳腺癌组织中FANCF基因相对表达量均低于相应正常组织(P均<0.01);HER2型乳腺癌组织中BRCA1、BRCA2、FANCD2、FANCI基因表达量均高于三阴型和Luminal型,Luminal型乳腺癌组织中FANCA基因表达量高于HER2型和三阴型(P均<0.05)。详见表3。
2.2 新辅助化疗的不同分型乳腺癌患者肿瘤组织中FA/BRCA通路基因表达情况 新辅助化疗后的三阴型乳腺癌组织中除FANCF外其余5个基因表达量均非常低,FANCD2在乳腺癌组织中的表达水平低于正常组织,Luminal型和HER2型乳腺癌组织中BRCA1表达水平高于正常组织(P均<0.05);新辅助化疗后的Luminal型乳腺癌组织中BRCA1、BRCA2、FANCA、FANCI基因表达均高于三阴型和HER2型(P均<0.05)。详见表4。

表2 待测基因引物序列
2.3 直接手术组与新辅助化疗组乳腺癌患者肿瘤组织中FA/BRCA通路基因表达比较 新辅助化疗的三阴型和HER2型乳腺癌组织中BRCA1、BRCA2、FANCD2、FANCI基因表达量低于直接手术者(P均<0.05)。新辅助化疗后的三个亚型乳腺癌组织中FANCF的表达水平高于直接手术者(P均<0.05)。详见表5。
3 讨论
大量研究报道FA/BRCA通路蛋白与多种肿瘤的发生发展、治疗反应、耐药性产生等有关。Dai等[9]的研究提示FANCL在顺铂诱导的DNA损伤修复过程中扮演了重要角色。BRCA1和BRCA2(FANCD1)已被证实是乳腺癌遗传易感基因,能够调控基因转录和细胞周期,诱导细胞凋亡,修复DNA损伤并维护基因组的完整性。BRCA1的突变与乳腺癌、卵巢癌的发生密切相关[10]。体外实验发现上调BRCA1表达可提高卵巢癌SKOV-3细胞的顺铂抗性[11],在乳腺癌HBL100细胞中下调BRCA1表达可增加细胞对顺铂的敏感性[12]。有学者[13]认为RRM1和BRCA1可作为评估肺癌患者预后的指标。

表3 直接手术的不同分型乳腺癌患者肿瘤组织中FA/BRCA通路基因表达比较

表4 新辅助化疗的不同分型乳腺癌患者肿瘤组织中FA/BRCA通路基因表达比较

表5 直接手术与新辅助化疗的不同分型乳腺癌患者肿瘤组织中FA/BRCA通路基因表达比较
FANCD2和FANCI在DNA修复途径中处于重要地位,FA/BRCA途径的核心事件是FANCI-FANCD2(ID)蛋白复合物的单泛素化。研究[14]发现FANCI蛋白与FANCD2蛋白可形成复合体,该复合体经过泛素化修饰后,被招募到发生DNA链交联的位点,与其他分子共同完成修复过程。有学者[15]成功解析了FANCI-FANCD2复合体的晶体结构。我国研究者[16]发现FANCD2表达与乳腺癌TNM分期呈负相关,认为FANCD2可能参与了乳腺癌的发生。Komatsu等[17]发现肝癌组织中FANCD2表达上调,且FANCD2表达水平较高的患者其肿瘤直径大,侵袭性强、预后差,FANCD2表达水平可作为预测治疗效果的指标。
FANCF作为FA核心复合体的衔接蛋白,对复合体的正确组装和稳定起重要作用[18],同时FANCF作为关键因子参与FANCD2泛素化激活过程,其功能破坏可引起多种实体肿瘤的发生。Yao等[19]研究发现在阿霉素耐药的白血病细胞中FANCF和泛素化的FANCD2蛋白表达上调,同时耐药细胞株与敏感细胞相比,其DNA损伤程度降低,结果提示FA通路蛋白可通过提高DNA损伤修复水平来增加细胞对阿霉素的耐药性。也有学者[20]认为FANCF是卵巢癌治疗中的一个潜在靶点。乳腺癌相关研究发现,在乳腺癌细胞株MCF-7、MDA-MB-435S中敲低FANCF表达可导致细胞增殖速率减慢,细胞周期紊乱并诱导细胞凋亡,细胞迁移和侵袭能力减弱;此外,FANCF敲低导致乳腺癌细胞对阿霉素的敏感性升高,FANCF可能是乳腺癌治疗的潜在靶点[21]。
乳腺癌的分型与肿瘤致病危险因素、疾病进程、预后和治疗方案的选择密切相关。目前普遍认为Luminal型乳腺癌所占比例最高,其次是三阴型,HER2型最少。患者的预后以三阴型最差,其次为HER2型,Luminal型预后最好。研究表明FA/BRCA通路蛋白可能参与了乳腺癌的发生和耐药形成,但该通路相关蛋白在不同亚型乳腺癌组织及治疗后组织中的表达情况尚不清楚。因此,本研究通过对比观察3种亚型乳腺癌组织中FA/BRCA通路基因的表达情况,探讨FA/BRCA通路基因在三种乳腺癌发生发展中的可能作用。本研究发现,对于直接手术的患者,HER2型乳腺癌组织中BRCA1、BRCA2、FANCD2、FANCI基因相对表达量高于三阴型和Luminal型,提示FA/BRCA通路基因在HER2型乳腺癌与其他两亚型乳腺癌中作用差异较大。结合临床上HER2型乳腺癌病例数最少,我们推测FA/BRCA通路基因可能在HER2型乳腺癌的发生中有一定作用。新辅助化疗后的三阴型乳腺癌组织与正常组织中除FANCF外其余5个基因表达量均非常低,新辅助化疗后的Luminal型乳腺癌组织中BRCA1、BRCA2、FANCA、FANCI基因表达均高于三阴型和HER2型。鉴于Luminal型乳腺癌是三种亚型患者中预后效果最好的,提示我们FA/BRCA通路中的BRCA1、BRCA2、FANCA、FANCI基因高表达可能与Luminal型乳腺癌患者新辅助化疗预后有关。新辅助化疗后的三阴型和HER2型乳腺癌组织中BRCA1、BRCA2、FANCD2、FANCI基因表达量低于直接手术者,表明新辅助化疗在一定程度上影响BRCA1、BRCA2、FANCD2、FANCI的表达。新辅助化疗后的3种亚型乳腺癌组织中FANCF的表达水平高于直接手术者,提示FANCF在新辅助化疗过程中表达上调,这种改变可能与患者对药物的敏感性变化有关。
综上所述,三种亚型乳腺癌组织中FA/BRCA通路基因表达差异性较大;对于直接手术的患者,HER2型乳腺癌组织中BRCA1、BRCA2、FANCD2、FANCI基因相对表达量高于三阴型和Luminal型,提示FA/BRCA通路基因在HER2型乳腺癌与其他两亚型乳腺癌中作用差异较大。新辅助化疗后的Luminal型乳腺癌组织中BRCA1、BRCA2、FANCA、FANCI基因表达均高于三阴型和HER2型,提示BRCA1、BRCA2、FANCA、FANCI基因高表达可能与Luminal型乳腺癌患者新辅助化疗预后有关。新辅助化疗可在一定程度上影响BRCA1、BRCA2、FANCD2、FANCI的表达。FANCF表达改变可能与乳腺癌细胞对化疗药物的敏感性有关。
参考文献:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Aloraifi F, Boland MR, Green AJ, et al. Gene analysis techniques and susceptibility gene discovery in non-BRCA1/BRCA2 familial breast cancer[J]. Surg Oncol, 2015,24(2):100-109.
[3] Palovcak A, Liu W, Yuan F, et al. Maintenance of genome stability by Fanconi anemia proteins[J]. Cell Biosci, 2017,7:8.
[4] Sumpter R Jr, Sirasanagandla S, Fernández F, et al. Fanconi anemia proteins function in mitophagy and immunity[J]. Cell, 2016,165(4):867-881.
[5] Haitjema A, Mol BM, Kooi IE, et al. Coregulation of FANCA and BRCA1 in human cells[J]. Springerplus, 2014,3:381.
[6] Hess J, Unger K, Orth M, et al. Genomic amplification of Fanconi anemia complementation group A (FancA) in head and neck squamous cell carcinoma (HNSCC): Cellular mechanisms of radioresistance and clinical relevance[J]. Cancer Lett, 2017,386: 87-99.
[7] Bakker ST, van de Vrugt HJ, Visser JA, et al. Fancf-deficient mice are prone to develop ovarian tumours[J]. J Pathol, 2012,226(1):28-39.
[8] Abdul-Sater Z, Cerabona D, Potchanant ES, et al. FANCA safeguards interphase and mitosis during hematopoiesis invivo[J]. Exp Hematol, 2015,43(12): 1031-1046.
[9] Dai CH, Li J, Chen P, et al. RNA interferences targeting the Fanconi anemia/BRCA pathway upstream genes reverse cisplatin resistance in drug-resistant lung cancer cells[J]. J Biomed Sci, 2015,22:77.
[10] Moghadasi S, Meeks HD, Vreeswijk MP, et al. The BRCA1 c. 5096G>A p.Arg1699Gln (R1699Q) intermediate risk variant: breast and ovarian cancer risk estimation and recommendations for clinical management from the ENIGMA consortium[J]. J Med Genet, 2018,55(1):15-20.
[11] Mullee LI, Morrison CG. Centrosomes in the DNA damage response-the hub outside the centre[J]. Chromosome Res, 2016,24(1):35-51.
[12] Ojima T, Nakamori M, Nakamura M, et al. Expression of BRCA1, a factor closely associated with relapse-free survival, in patients who underwent neoadjuvant chemotherapy with docetaxel, cisplatin, and fluorouracil for squamous cell carcinoma of the esophagus[J]. Surg Today, 2017,47(1):65-73.
[13] 赵美玲,杨海虹,何建行.吉西他滨治疗RRM1阴性晚期难治非小细胞肺癌患者1例[J].中国肺癌杂志,2011,14(6):550-553.
[14] Nepal M, Che R, Ma C, et al. FANCD2 and DNA Damage[J]. Int J Mol Sci, 2017,18(8). pii: E1804.
[15] Jayabal P, Ma C, Nepal M, et al. Involvement of FANCD2 in Energy Metabolism via ATP5α[J]. Sci Rep, 2017,7(1):4921.
[16] Zhang P, Mourad R, Xiang Y, et al. A dynamic time order network for time-series gene expression data analysis[J]. BMC Syst Biol, 2012,6(Suppl 3):S9.
[17] Komatsu H, Masuda T, Iguchi T, et al. Clinical Significance of FANCD2 Gene Expression and its Association with Tumor Progression in Hepatocellular Carcinoma[J]. Anticancer Res, 2017, 37(3):1083-1090.
[18] Moghadam AA, Mahjoubi F, Reisi N, et al. Investigation of FANCA gene in Fanconi anaemia patients in Iran[J]. Indian J Med Res, 2016,143(2):184-196.
[19] Yao C, Du W, Chen H, et al. Involvement of Fanconi anemia genes FANCD2 and FANCF in the molecular basis of drug resistance in leukemia[J]. Mol Med Rep, 2015,11(6): 4605-4610.
[20] He M, Sun HG, Hao JY, et al. RNA interference-mediated FANCF silencing sensitizes OVCAR3 ovarian cancer cells to adriamycin through increased adriamycin-induced apoptosis dependent on JNK activation[J]. Oncol Rep, 2013,29(5):1721-1729.
[21] Zhao L, Li N, Yu JK, et al. RNAi-mediated knockdown of FANCF suppresses cell proliferation, migration, invasion, and drug resistance potential of breast cancer cells[J]. Braz J Med Biol Res, 2014,47(1):24-34.
