瘤周水肿区扩散张量成像定量参数在胶质瘤分级中的诊断价值
2018-04-19龚军伟罗天友吴少平张竹程润田蒋佩伶
龚军伟,罗天友,吴少平,张竹,程润田,蒋佩伶
瘤周水肿区扩散张量成像定量参数在胶质瘤分级中的诊断价值
龚军伟1,罗天友1*,吴少平2,张竹1,程润田1,蒋佩伶1
1.重庆医科大学附属第一医院放射科,重庆 400016; 2.成都医学院第一附属医院放射科,四川成都 610500;
探讨胶质瘤瘤周水肿区近、中、远不同区域扩散张量成像(DTI)中相对各向异性分数(rFA)值及相对表观扩散系数(rADC)值鉴别诊断胶质瘤分级的价值。回顾性分析经病理证实的48例胶质瘤患者的DTI资料,其中高级别组30例,低级别组18例。取轴位水肿径线最大层面,测量瘤周水肿区近、中、远不同区域FA值和ADC值及对侧半球镜像正常白质区的FA值和ADC值,然后计算瘤周水肿区不同区域rFA值(rFA1、rFA2、rFA3)和rADC值(rADC1、rADC2、rADC3),比较其变化情况及在高、低级别胶质瘤中的差异。高级别组胶质瘤瘤周水肿区rFA1、rFA2、rFA3低于低级别组,差异有统计学意义(<0.05);高级别组胶质瘤瘤周水肿区rADC1、rADC2、rADC3高于低级别组,差异有统计学意义(<0.05)。ROC曲线分析显示,rFA1、rFA2、rFA3、rADC1、rADC2和rADC3鉴别高、低级别胶质瘤的曲线下面积分别为0.972、0.893、0.854、0.743、0.761、0.694,rFA1与rFA2、rFA3的ROC曲线下面积差异有统计学意义(0.05),rFA2与rFA3的ROC曲线下面积差异无统计学意义(>0.05);rADC1、rADC2和rADC3的ROC曲线下面积两两比较,差异无统计学意义(>0.05);rFA1或rFA2与rADC1、rADC2、rADC3的ROC曲线下面积差异有统计学意义(0.05);rFA3与rADC1、rADC2的ROC曲线下面积差异无统计学意义(>0.05)。瘤周水肿区近、中、远不同区域DTI定量参数rFA值和rADC值鉴别诊断胶质瘤高、低级别均有一定的价值,但rFA值的诊断效能明显优于rADC值。
神经胶质瘤;磁共振成像;扩散张量成像;诊断,鉴别
胶质瘤是颅内最常见的原发恶性肿瘤,预后较差,其治疗方案的选择及预后评估与其级别高低密切相关[1-2]。因此,胶质瘤术前分级及恶性程度判断尤为重要。Lin等[3]研究发现,瘤周水肿区脑血流量梯度可作为有效参数鉴别高级别胶质瘤和颅内单发转移瘤。对高、低级别胶质瘤瘤周水肿区各向异性分数(FA)和表观扩散系数(ADC)的研究已较多[4-7];但其在鉴别胶质瘤高、低级别中的价值尚未达成共识,且其测量感兴趣区(ROI)均位于肿瘤周围,而关于瘤周水肿区不同区域及离瘤灶边缘不同距离扩散张量成像(DTI)定量参数的研究鲜有报道。本研究将高、低级别胶质瘤瘤周水肿区分为1~4个方向和近、中、远3个不同距离(不同区域)进行测量,探讨其DTI的相对FA(relative FA,rFA)值及相对ADC(relative ADC,rADC)值是否存在差别,及其在胶质瘤高、低级别鉴别中的价值,为临床诊疗及预后评估提供依据。
1 资料与方法
1.1 研究对象 收集2013年11月-2017年3月于重庆医科大学附属第一医院行常规MRI和DTI扫描,资料完整且经手术病理证实的胶质瘤患者76例,根据常规MRI轴位T1WI、T2WI、T2-FLAIR及轴位T1WI增强扫描图像分析,排除其中瘤周水肿不明显或仅有轻度水肿(最大范围径线≤10 mm)且与肿瘤实质分界不清的28例,最终纳入48例。其中男21例,女27例;年龄13~79岁,平均(46.1±15.5)岁。所有患者行MRI检查前均未接受任何治疗,主要临床症状:头痛或头晕15例,肢体抽搐或伴意识障碍14例,肢体乏力或伴意识障碍7例,头痛、头晕伴呕吐或肢体乏力或抽搐6例,记忆力减退3例,肢体麻木伴其他3例。根据2007版WHO中枢神经系统肿瘤分类[8]分为高级别组30例,其中WHO III级17例,IV级13例;瘤体直径(40.3±11.7)mm,瘤周水肿直径(30.0±11.2)mm;低级别组18例,其中WHO I级4例,II级14例;瘤体直径(47.4±15.6)mm,瘤周水肿直径(19.0±5.3)mm。
1.2 仪器与方法 采用GE Signa HDxt 3.0T MR扫描仪,头部专用8通道相控阵线圈。所有患者均行常规MRI和DTI扫描。常规MRI扫描包括平扫和增强扫描,序列为,轴位T1-FLAIR:TR 1650 ms,TE 23.7 ms,TI 720 ms;FSE T2WI:TR 2860 ms,TE 119.2 ms,T2-FLAIR:TR 6880 ms,TE 150 ms,TI 1850 ms;层厚5 mm,层间距1.5 mm,轴位扩散加权成像(DWI),b值取1000 s/mm2;轴位、矢状位及冠状位T1WI增强扫描,轴位参数:TR 1913 ms,TE 21.2 ms,TI 860 ms;矢状位参数:TR 1967 ms,TE 24.1 ms,TI 720 ms;冠状位参数:TR 2405 ms,TE 21.9 ms,TI 750 ms。对比剂采用钆喷替酸葡甲胺(Gd-DTPA,4 mmol/L),用量0.2 mmol/kg,使用专用高压注射器(Spectris Solaris EP)经肘静脉注射,注射速度2~3 ml/s,然后以相同速度注射20 ml生理盐水冲管。DTI扫描在增强扫描前进行,参数:TR 8000 ms,TE 87.6 ms,矩阵128×130,视野24 cm×24 cm,1次采集,b值=0、1000 s/mm2,扩散敏感梯度方向为30 s/mm2,层厚5 mm,层间距0 mm,扫描时间4 min 16 s。
1.3 数据后处理 将采集的数据传至GE ADW 4.6工作站,使用Functool软件行后处理,获得FA伪彩图和ADC伪彩图,然后确定瘤周水肿区ROI,每个ROI均取相同的面积(26 mm2),具体方法如下:①在瘤周水肿区范围径线最大的层面,定义紧邻瘤体的水肿区为近,紧邻看似正常白质的水肿区为远,近和远的中心区域为中,近、中、远3个ROI的连线原则上与瘤体边缘切线垂直,根据瘤周水肿分布的具体情况,在水肿区选择1~4个方向进行测量(其中1个方向测量11例,2个方向16例,3个方向12例,4个方向9例),各个方向上ROI不交叉;②计算各个方向上相同距离(近、中、远)ROI所对应的平均FA值(简称FA1、FA2、FA3)和平均ADC值(简称ADC1、ADC2、ADC3);③测量对侧镜像正常白质区的FA值和ADC值,计算获得瘤周水肿区近、中、远不同区域的rFA值和rADC值(水肿区/镜像白质区),分别为rFA1、rFA2、rFA3和rADC1、rADC2、rADC3。
1.4 统计学方法 采用SPSS 23.0软件,胶质瘤高、低级别组中符合正态分布的参数采用成组资料检验,不符合正态分布的参数采用秩和检验,<0.05表示差异有统计学意义;将组间差异有统计学意义的各参数行受试者工作特性(ROC)曲线分析,获取各参数的最佳界值及对应的敏感度和特异度。
2 结果
2.1 两组胶质瘤瘤周水肿区DTI参数比较 两组胶质瘤瘤周水肿区不同距离FA值均低于对侧镜像区,差异有统计学意义(<0.05);高级别组近、中、远rFA值分别低于低级别组,差异均有统计学意义(<0.05);rFA值由近及远呈逐渐升高趋势。两组胶质瘤瘤周水肿区不同距离ADC值均高于对侧镜像区,差异有统计学意义(<0.05);高级别组胶质瘤近、中、远rADC值分别高于低级别组,差异均有统计学意义(<0.05);高级别组19例、低级别组12例瘤周水肿区rADC值由近及远呈逐渐降低趋势。见图1~4。
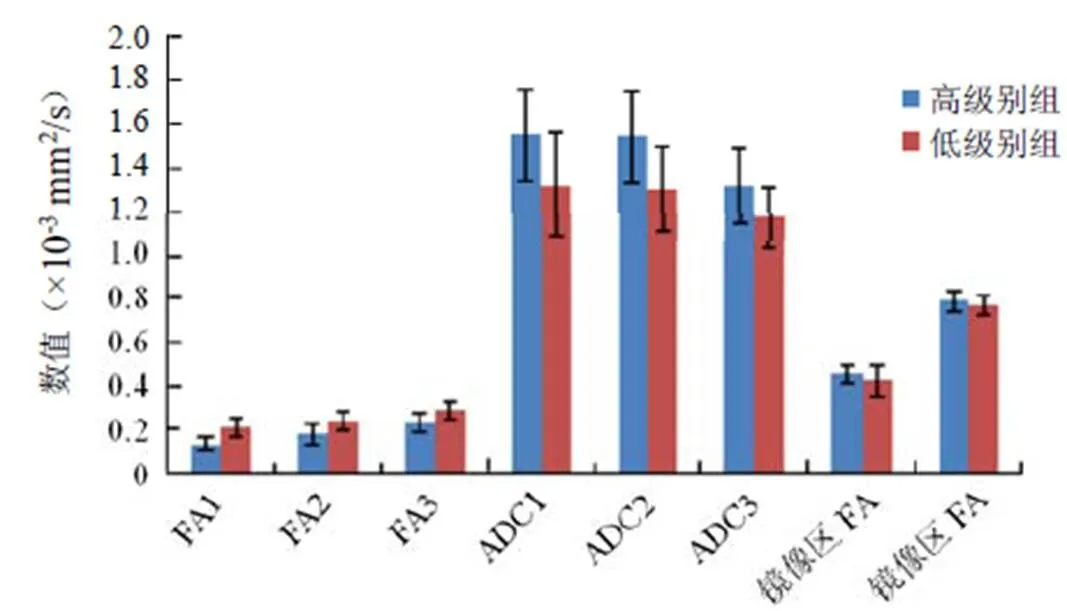
图1 两组胶质瘤瘤周水肿区及镜像区DTI参数。ADC1、ADC2、ADC3及镜像区ADC
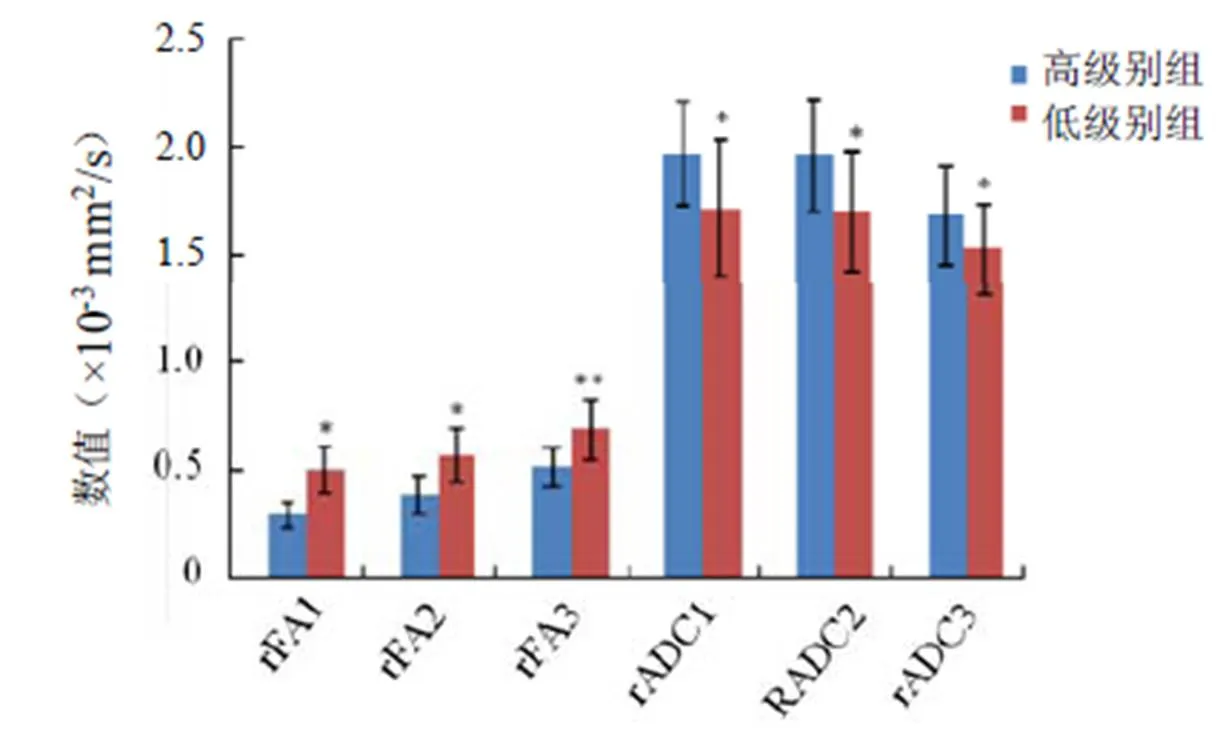
图2 两组胶质瘤瘤周水肿区DTI参数相对值比较。与高级别组DTI参数相对值比较,*P<0.05
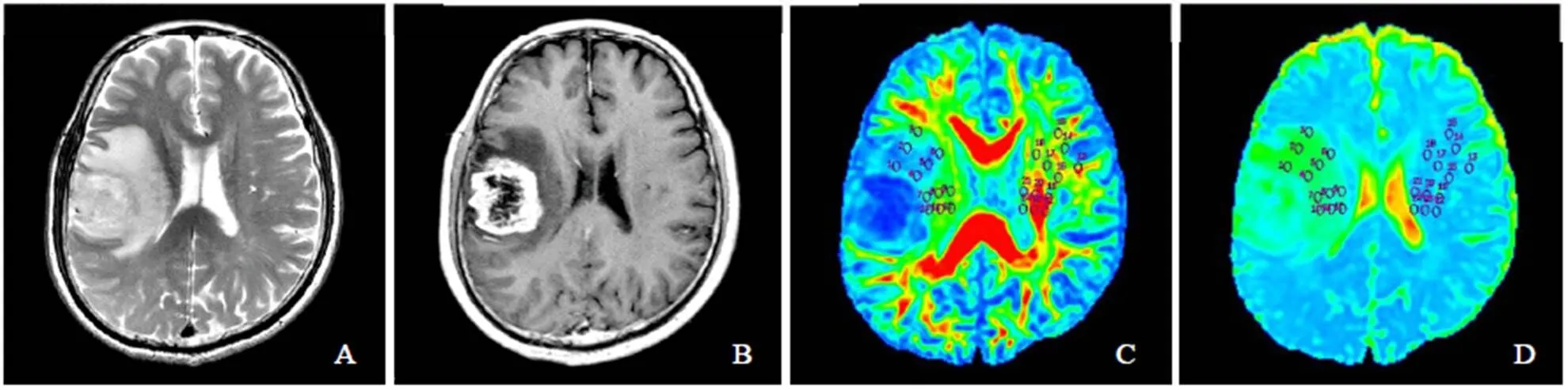
图3 男,69岁,多形性胶质母细胞瘤IV级。T2WI示右侧颞顶叶不均匀较高混杂信号瘤灶伴瘤周大片高信号水肿区(A);增强扫描瘤灶呈不规则明显厚环状强化(B);FA伪彩图(C)和ADC伪彩图(D)示测量瘤周水肿区及对侧镜像正常白质区4个方向上近、中、远不同区域FA值和ADC值
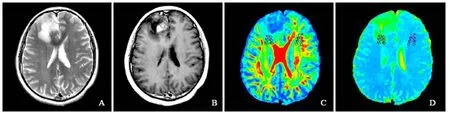
图4 男,37岁,星形细胞瘤II级。T2WI示右侧额叶不均匀稍高混杂信号瘤灶伴片状高信号水肿区(A);增强扫描病灶呈不均匀结节样强化(B);FA伪彩图(C)和ADC伪彩图(D)示测量瘤周水肿区及对侧镜像正常白质区2个方向上近、中、远不同区域FA值和ADC值
2.2 两组胶质瘤瘤周水肿区DTI参数的ROC曲线分析 除rADC3外,其余各参数曲线下面积(AUC)均>0.70;且rFA1的诊断效果最佳,见表1。rFA1、rFA2、rFA3、rADC1、rADC2和rADC3的AUC两两比较发现,rFA1与rFA2、rFA3差异有统计学意义(0.05),rFA2与rFA3差异无统计学意义(>0.05);rADC1、rADC2和rADC3两两间差异无统计学意义(>0.05);rFA1或rFA2与rADC1、rADC2、rADC3差异有统计学意义(0.05);rFA3与rADC1、rADC2差异无统计学意义(>0.05)。
表1两组胶质瘤瘤周水肿区DTI参数的ROC曲线分析
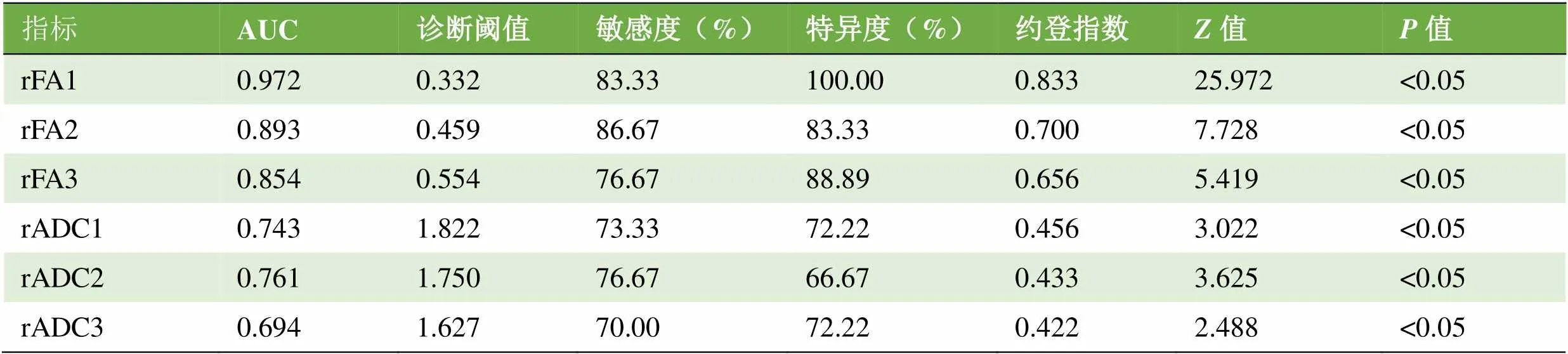
指标AUC诊断阈值敏感度(%)特异度(%)约登指数Z值P值 rFA10.9720.33283.33100.000.83325.972<0.05 rFA20.8930.45986.6783.330.7007.728<0.05 rFA30.8540.55476.6788.890.6565.419<0.05 rADC10.7431.82273.3372.220.4563.022<0.05 rADC20.7611.75076.6766.670.4333.625<0.05 rADC30.6941.62770.0072.220.4222.488<0.05
3 讨论
DTI能检测活体组织水分子的扩散程度与方向,FA值和ADC值是DTI常用的2个参数,FA值主要与组织细胞密度、细胞核分裂方式、白质纤维束排列、髓鞘形成等因素有关,ADC值主要反映水分子各个方向的扩散情况,因此FA值和ADC值可用于反映肿瘤的病理特征[9]及肿瘤周围的浸润情况[10],进而提高其在胶质瘤分级中的价值。
近年来,采用FA值和ADC值对胶质瘤高、低级别进行鉴别的研究较多,多数认为瘤周水肿区FA值和(或)ADC值有一定的鉴别诊断价值[5,11],也有研究认为意义不大[6-7,12]。除研究对象、成像设备、扫描参数等客观因素的影响外,多数研究的瘤周水肿区DTI参数测量的ROI均采用随机放置于瘤灶附近的方法。鉴于胶质瘤瘤周浸润的不均质性,本研究根据瘤周水肿的范围,采用在瘤周水肿区不同方向及距瘤灶边缘近、中、远不同距离选择ROI进行测量的方法,并与对侧镜像正常白质区的测值进行比较,计算rFA和rADC值,以尽量避免测量盲目性导致的抽样误差和个体差异,同时也可以观察上述测值在距离瘤灶边缘近、中、远不同区域可能存在的差别。
本研究发现,高级别及低级别胶质瘤的瘤周水肿区FA值均有降低(<0.05),而ADC值均有升高(<0.05),与El-Serougy等[11]的研究结果一致。本研究还发现,距离瘤灶边缘无论远近,高级别组瘤周水肿区rFA值均明显低于低级别组,而rADC值均明显高于低级别组,差异均有统计学意义(0.05),提示瘤周水肿区不同区域rFA值和rADC值的测量均有助于鉴别诊断高、低级别胶质瘤。高级别胶质瘤瘤周水肿区上述DTI参数与低级别胶质瘤不同,可能与其以下病理学基础有关[13-15]:①瘤周水肿区肿瘤细胞浸润的数量和密度增多、变大,故细胞外间隙减小,水分子不易扩散,水分子定向扩散趋势增加,因此rFA值增大、rADC值减小;②瘤周肿瘤细胞浸润程度更明显,白质纤维破坏、崩解更严重,故rFA值减小;③血-脑屏障破坏程度加重,瘤周血管源性水肿更突出,故瘤周水肿区纤维束密度降低,水分子易扩散,从而导致rFA值减小、rADC值增大;④瘤周出现反应性胶质增生更明显,故rFA值增大;⑤瘤周浸润的胶质瘤细胞分泌胶原酶IV对正常组织的溶解更明显,致水分子易扩散,故rADC值增大。
此外,本研究中两组胶质瘤瘤周水肿区rFA值由近及远呈逐渐升高趋势,而rADC值由近及远多数呈逐渐降低趋势,提示越靠近瘤体,瘤周FA值和ADC值改变越明显。这种表现与瘤周水肿区的病理变化趋势一致,也与瘤周脑血流量梯度变化的研究发现一致[3]。
ROC曲线分析表明,在胶质瘤瘤周水肿区,除rFA3外,rFA1和rFA2的诊断效能明显优于rADC,靠近瘤灶的瘤周水肿区的rFA诊断效能最高。鉴于瘤周水肿区DTI参数改变的不均质性和近、中、远不同区域的变化趋势,为更真实地反映变化情况,建议在参数测量时应注意:①尽量在不同方向上多选择几个ROI进行测量;②在避免误测瘤灶本身的前提下,ROI应尽量放置于靠近瘤灶的近侧区域。对于高级别胶质瘤,在尽量保留或保护邻近重要功能区脑组织的前提下,瘤周切除范围或放疗靶区应广泛一些,rFA值和rADC值的变化情况可作为参考依据之一。
总之,瘤周水肿区不同区域DTI定量参数rFA值和rADC值的测量对鉴别诊断高、低级别胶质瘤具有一定的临床应用价值,且有助于高级别胶质瘤治疗方案的制订。但因本研究样本量较小,仅将胶质瘤分为高级别和低级别,尚未严格按照WHO分级标准进行分组,且缺乏影像数据测量与病理标本一一对照等不足,今后将进一步深入研究。
[1] Zonari P, Baraldi P, Crisi G. Multimodal MRI in the characterization of glial neoplasms: the combined role of single-voxel MRspectroscopy, diffusion imaging and echo-planar perfusion imaging. Neuroradiology, 2007, 49(10): 795-803.
[2] 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断和治疗指南(2015). 中华医学杂志, 2016, 96(7): 485-509.
[3] Lin L, Xue Y, Duan Q, et al. The role of cerebral blood flow gradient in peritumoral edema for differentiation of glioblastomas from solitary metastatic lesions. Oncotarget, 2016, 7(42): 69051-69059.
[4] Hoefnagels FW, Hamer PD, Sanz-Arigita E, et al. Differentiation of edema and glioma infiltration: proposal of a DTI-based probability map. J Neurooncol, 2014, 120(1): 187-198.
[5] Piyapittayanan S, Chawalparit O, Tritakarn SO, et al. Value ofdiffusion tensor imaging in differentiating high-grade from low-grade gliomas. J Med Assoc Thai, 2013, 96(6): 716-721.
[6] Server A, Graff BA, Josefsen R, et al. Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T. Eur J Radiol, 2014, 83(3): e156-e165.
[7] Van Cauter S, Veraart J, Sijbers J, et al. Gliomas: diffusion kurtosis MR imaging in grading. Radiology, 2012, 263(2): 492-501.
[8] 占传家, 朱文珍, 王承缘. 2007年世界卫生组织对于中枢 神经系统肿瘤的分类. 放射学实践, 2008, 23(2): 29-35.
[9] Yuan J, Liu L. Brain glioma growth model using reaction-diffusion equation with viscous stress tensor on brain MR images. MagnReson Imaging, 2016, 34(2): 114-119.
[10] 全冠民, 高云云, 袁涛, 等. 近瘤周区DTI对高级别胶质 瘤与转移瘤鉴别诊断的研究. 临床放射学杂志, 2014, 33(4): 484-488.
[11] El-Serougy L, Abdel Razek AA, Ezzat A, et al. Assessment ofdiffusion tensor imaging metrics in differentiating low-grade from high-grade gliomas. Neuroradiol J, 2016, 29(5): 400-407.
[12] 姜亮, 孙军, 刘文, 等. 3.0T扩散张量成像定量参数在脑 胶质瘤分级中的应用. 中国医学影像学杂志, 2015, 2(4): 250-254, 259.
[13] Wang S, Kim SJ, Poptani H, et al. Diagnostic utility of diffusion tensor imaging in differentiating glioblastomas frombrain metastases. Am J Neuroradiol, 2014, 35(5): 928-934.
[14] Toh CH, Wei KC, Ng SH, et al. Differentiation of tumefactivedemyelinating lesions from high-grade gliomas with the useof diffusion tensor imaging. Am J Neuroradiol, 2012, 33(5): 846-851.
[15] Toh CH, Wei KC, Ng SH, et al. Differentiation of brain abscesses from necrotic glioblastomas and cystic metastatic brain tumors with diffusion tensor imaging. Am J Neuroradiol,2011, 32(9): 1646-1651.
(本文编辑 周立波)
Diffusion Tensor Imaging Quantitative Parameters in the Diagnosis of Peritumoral Edema Area in the Glioma Grading
, LUO Tianyou, WU Shaoping, ZHANG Zhu, CHENG Runtian,
To investigate the value of relative fractional anisotropy (rFA) and relative apparent diffusion coefficient (rADC) in diffusion tensor imaging (DTI) of different regions of glioma around the near, middle and distal regions in its high and low level identification.The DTI data of 48 patients (30 cases of high grade, and 18 cases of low grade) with gliomas confirmed by pathology were analyzed retrospectively. Taking the axis of the largest level of edema line, the value of FA and ADC of the peritumoral edema in near, middle and far regions from the tumors and the FA value as well as ADC value of the normal white matter region of the contralateral hemisphere mirror were measured. The rFA values (rFA1, rFA2, rFA3) and rADC values (rADC1, rADC2, rADC3) in different regions of the peritumoral edema area were calculated, their changes and differences in high and low-grade gliomas were analyzed.The rFA1, rFA2 and rFA3 in the edema area of the high-grade group were lower than those of the low-grade group (<0.05). The rADC1, rADC2 and rADC3 in the edema area of the high-grade group were higher than those of the low-grade group (<0.05). ROC analysis showed the area under the curveof rFA1, rFA2, rFA3, rADC1, rADC2 and rADC3 were 0.972, 0.893, 0.854, 0.743, 0.761 and 0.694, respectively. There were significantly statistical differences between rFA1 and rFA2, and between rFA1 and rFA3 (<0.05), while there was no difference between rFA2 and rFA3 (>0.05). There was no significantly statistical difference between rADC1, rADC2 and rADC3 (>0.05). There was statistically significant difference between rFA1 or rFA2 and rADC1, rADC2, rADC3 (<0.05).There was no difference between rFA3 and rADC1, rADC2 (>0.05).In the near, middle and far regions of peritumoral edema area, quantitative parameters of DTI, rFA value and rADC value in the differential diagnosis of gliomas have a certain value, but the diagnostic efficiency of rFA value is significantly better than that of rADC.
Glioma; Magnetic resonance imaging; Diffusion tensor imaging; Diagnosis, differential
R445.2;R739.41
10.3969/j.issn.1005-5185.2018.02.002
2017-07-03
2017-11-15
国家临床重点专科建设项目(国卫办医函[2013]544号)

Chinese Journal of Medical Imaging, 2018, 26 (2): 86-89, 93
