Kasabach-Merritt现象的治疗研究进展
2018-04-19郭磊王亮李静宋丹刘婷
郭磊,王亮,李静,宋丹,刘婷
Kasabach-Merritt现象的治疗研究进展
郭磊*,王亮,李静,宋丹,刘婷
济南市儿童医院介入血管瘤科,山东济南 250000;
Kasabach-Merritt综合征;血管瘤;治疗;外科手术;药物疗法;化学栓塞,治疗性;注射,病灶内;综述
Kasabach-Merritt现象(Kasabach-Merritt phenomenon,KMP)是好发于婴幼儿的一种罕见的血管瘤,Kasabach等[1]于1940年首次报道1例1岁男婴,表现为左大腿巨大血管瘤、广泛皮肤紫癜合并血小板减少及凝血功能紊乱。此后,将这类在脉管性病变基础上伴发一系列凝血功能异常的疾病统称为Kasabach-Merritt综合征[2],为更好地诊断、鉴别和治疗,Sarkar等[3]提出用KMP描述此类症状,认为其与婴幼儿血管瘤无关。血管造影可见KMP病灶与单纯血管瘤表现完全不同[4]:血管瘤造影可见粗大的供血动脉、明显的肿瘤染色团及回流静脉,且供血动脉与瘤体大小成比例;而KMP病灶造影通常表现为正常的动脉分出无数细小的供血动脉,肿瘤供血动脉非常纤细,与病灶大小不成比例。组织学上主要表现为卡波西型血管内皮细胞瘤(Kaposi form hemangioendothelioma,KHE)或丛状血管瘤(tufted angiomas,TA)。尽管TA与KHE的病理学描述不同,但差异很小,临床症状相似。有学者认为两者很可能是同一肿瘤的不同表现形式或不同阶段[5]。但KHE导致KMP的几率明显高于TA[6],临床上常见的伴发KMP患儿多以KHE为主。同时,KHE更易向深部浸润,病灶中央呈卡波西样增生的血管在D2-40染色中为阳性,周围扩张的淋巴管为阴性[7],但不表达Glut1[8];TA则相反,周围扩张的淋巴管在D2-40染色中为阳性,中央呈炮弹样分布的毛细血管丛为阴性[7],但强烈表达Glut1[8]。
目前对于KHE/TA基础上发生KMP的病理机制尚不清晰,目前普遍认可的是由于KMP病灶通常表现为从大的血管腔直接分出无数弯曲盘绕的毛细血管网,巨大的血流变化更易形成涡流,导致血小板活化和聚集[6]。血小板被异常增殖的内皮细胞所捕获,促使血小板黏附、聚集和活化,激活局部凝血级联反应,使纤维蛋白大量沉积形成微血栓,包括血小板在内的血液成分大量潴留,最终导致血小板和多种凝血因子的消耗。也有研究者认为可能是血小板被用来当作血管瘤内皮层,单核-巨噬细胞系统吞噬血小板作用加强,产生血小板抗体,破坏血小板,而血管瘤中血管异常也使血小板凝聚、受伤而裂解等,进一步加重病情。
KMP多在新生儿期或婴儿期发病,在婴幼儿血管瘤患者中发病率仅为0.3%[9]。约50%的病例于生后即可诊断,90%的病例于生后1年内诊断[10],发病最早的患儿于生后17 h即出现症状。瘤体可发生于体表任何部位,好发于胸腹部和颌面部[11],主要表现为体表巨大血管性肿瘤,可在短期内迅速增大并向周围扩散,表面紫红、温热,质硬有触痛,局部有瘀斑,具有血小板减少、纤维蛋白降低、D-二聚体升高等特点,但凝血酶原时间和部分凝血酶原时间可正常,可发生出血、贫血,严重时常导致全身弥散性血管内凝血,危及生命。当肿瘤位于内脏,尤其是无皮肤病灶表现的病例往往诊断较困难,故患儿出现无法解释的血小板减少症和凝血功能障碍时应考虑KMP的可能[12]。KMP起病较急,病死率可高达30%[11],主要死因包括弥散性血管内凝血、呼吸衰竭、高输出性心力衰竭等。
目前有多种治疗KMP的方案,包括手术治疗、药物治疗、介入治疗、注射治疗、支持治疗等,但国内外尚无标准的治疗方案。临床医师主要采用经验性治疗,治疗原则主要是去除瘤体以及针对低凝血状态、出血等症状给予支持治疗。
1 手术治疗
手术切除是治疗体表血管瘤的有效方式,尤其是对早期、瘤体较小且解剖结构清楚,邻近无重要组织结构的KMP患者,能顺利进行外科切除是最彻底的治疗方法[13]。对于无法完全切除、病变范围大的KMP患者,也可通过手术减瘤,术后辅以药物治疗,亦可有效抑制残余病灶。但KMP患者往往存在血小板减少、凝血功能障碍、合并出血倾向等,同时病灶具有高浸润性,界限不清,常累及重要的血管、神经甚至内脏器官,手术风险较大。对于药物治疗无效或起效前即出现病危的患者,行手术姑息切除仍不失为一种有效手段,术前通过应用激素冲击、丙种球蛋白、血制品输注等,使瘤体相对缩小或提高患儿的耐受程度[14],术中往往采用部分切除肿瘤联合U型缝合减少肿瘤的血供,术后给予长春新碱化疗以预防残留肿瘤扩大[15]。此外,输注血小板后血小板被瘤体捕获使半衰期缩短,恶化出血症状,因此仅在急性出血和外科手术前可输注血小板[16]。
2 药物治疗
2.1 雷帕霉素 雷帕霉素包括西罗莫司及其衍生物依维莫司[17]等,是一种哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)受体抑制剂,可作用于PI3/AKT/mTOR细胞通路来抑制淋巴上皮细胞和血管内皮细胞增殖[18]。Blatt等[19]报道给予多种治疗无效的KMP危重患儿口服雷帕霉素0.1 mg/(kg·d),并维持血药浓度8~15 ng/ml具有显著效果,2周后血小板计数明显上升,病灶稳定并随用药时间延长而逐渐消退。Schroeder等[20]报道西罗莫司应用于KHE合并KMP取得良好的疗效。Kai等[21]报道口服西罗莫司的平均起效时间仅5.3 d,治疗持续时间取决于血管瘤缩小程度,多数疗程为55个月。Matsumoto等[17]荟萃分析了15例应用雷帕霉素治疗多种治疗无效的危重KMP患儿,均取得显著疗效,其中7例患儿出现不同程度的并发症,包括口腔炎、肝功受损、皮疹、血脂异常等。但目前尚缺乏大样本临床数据和长期随访研究,雷帕霉素对KMP患儿的具体疗效及其对婴幼儿生长发育的影响尚需评估。
2.2 糖皮质激素 糖皮质激素是目前治疗KMP的一线药物,其有效率为11%~66%[22]。糖皮质激素能有效抑制血管内皮细胞增殖,诱导细胞凋亡,阻止纤维蛋白溶解及血栓形成,同时可刺激骨髓造血及血小板释放并拮抗血小板抗体[23]。多数患儿对糖皮质激素敏感,有效率为81%[24],病情较容易得到控制。常用的激素有泼尼松、甲泼尼龙及地塞米松等,其换算比例为5∶4∶0.75[25],每天口服泼尼松2~3 mg/kg,服用2~4周,2周后无效需联合其他手段。对于血小板显著下降的患儿,可静滴大剂量地塞米松冲击,起始量为0.75 mg/(kg·d),2次/d。对于多数激素治疗敏感的患儿,在使用激素第2天即可监测到血小板计数显著上升。对于部分因接受不规范治疗导致激素不敏感的患儿,可逐渐加大地塞米松剂量,直至血小板显著上升,最大用量可至2 mg/(kg·d)。激素冲击及对症治疗可短期促使血小板上升,皮下出血点消退,瘤体也可稍微缩小。一旦降低激素用量或停用激素,大部分患儿在一段时间后会出现病情加重,且长期反复的激素治疗可诱导机体出现激素治疗抵抗现象或导致严重并发症。对于类固醇激素耐药的患儿,可给予联合治疗方案,包括长春新碱、干扰素(IFN)等。
2.3 长春新碱 长春新碱治疗血管瘤的主要机制为抑制内皮细胞增殖,用于儿童恶性肿瘤、特发性血小板减少性紫癜、血栓形成性血小板减少性紫癜等多种疾病[12]。长春新碱可抑制微管蛋白的聚合而影响纺锤体微管的形成,使有丝分裂停止于中期,也能使瘤细胞和血管内皮细胞凋亡[14]。Wang等[26]报道每周给予1~1.5 mg/m2或0.05~0.065 mg/kg长春新碱较为安全有效,且常在1~3周内取得显著疗效。Haisley-Royster等[27]回顾性分析了15例接受长春新碱治疗的KMP患儿(其中6例单独用药,9例联合用药),所有患者的血小板计数均明显升高,瘤体明显缩小。Thomson等[28]应用长春新碱与糖皮质激素联合治疗4例KMP患儿,取得明显疗效,且未发生明显不良反应。Garcia-Monaco等[8]使用长春新碱治疗KMP患儿取得一定的疗效,表明长春新碱可作为长期控制KMP的有效药物。此外,患者对长春新碱耐受性较好,主要不良反应为神经毒性,通常引起短暂性外周神经病变,其中最常见的是出现外周混合性感觉和运动神经病变,使得深部反射丧失。长春新碱亦可导致自主神经性病变致腹痛、便秘和肠梗阻,因此采用长春新碱治疗时需密切监测患者的血细胞水平、电解质、肝功能等指标的变化[29]。
2.4 IFN 对激素不敏感的患者,可应用/联用IFN作为KMP的治疗药物。IFN可通过抑制bFGF的表达而抑制血管细胞的增生和增殖[30]。Acharya等[31]研究发现皮下给予3×106U/(m2·d)IFN-2b治疗KMP患儿取得良好的疗效。IFN起效比类固醇激素慢,给予标准剂量3×106U/(m2·d)IFN治疗1~2周起效,但需连续用药1个月以上[12]。IFN治疗的副作用主要包括发热、流感样症状、中性粒细胞减少症、贫血、肝功能受损等,甚至可引起婴儿痉挛性双侧瘫痪。
2.5 普萘洛尔 2008年,Léauté-Labrèze等[32]报道了在法国Bordeaux儿童医院应用普萘洛尔治疗婴儿血管瘤的重大发现,迅速引起各国学者开展普萘洛尔治疗婴幼儿血管瘤的相关研究,也有关于普萘洛尔治愈KMP的病例报道[33]。但Chiu等[11]回顾性分析了11例使用普萘洛尔治疗KHE和TA患儿,仅3例对单独用药敏感,1例联合激素有效。尽管普萘洛尔对婴幼儿血管瘤有良好的疗效,但KHE/TA与婴幼儿血管瘤在组织学和临床表现上差异显著,决定了其对KHE/TA的疗效有限,目前对于普萘洛尔治疗KMP的效果存在较大争议。
2.6 其他药物 己酮可可碱是合成的黄嘌呤衍生物,具有抗血小板聚集活性,可改善血管瘤的血流减少、血栓形成,改变红细胞的流变学,降低血液黏滞度。De La Hunt[34]报道对多种治疗无效的KMP患儿给予己酮可可碱治疗可快速有效、持续改善KMP患儿的症状,具有较快速和稳定的疗效,停药后肿瘤无复发。Fernandez-Pineda等[35]应用长春新碱-阿司匹林-噻氯匹定联合治疗KMP也取得较好的治疗效果。
3 介入治疗
介入手术主要采用硬化剂和栓塞剂栓塞瘤体供血动脉,使瘤体缺血、变性及坏死,缩小瘤体体积,使血小板在瘤体内被捕获、破坏减少,甚至可完全消除瘤体,达到根治的效果,是KMP安全有效的治疗方式。回顾我院近1年来收治的行介入治疗的8例KMP患儿,均取得显著效果,术后血小板迅速提升至正常范围,瘤体明显变小或消失,皮下瘀斑减退(图1)。介入治疗可以避免外科手术中的大出血,但栓塞不当可损伤重要器官及组织血供,有时也可引起瘤体坏死感染,甚至引起脓毒血症[12]。Ryan等[36]报道对10例激素治疗不敏感的KMP患儿进行多次介入栓塞,其中9例取得良好的效果。周少毅等[29]采用经导管动脉血管硬化栓塞术成功治疗58例KMP患儿,术后血小板计数和纤维蛋白原水平均显著升高,血管瘤由增殖转为消退,均达到临床治愈。常用的术式为经导管动脉硬化栓塞术,造影可见瘤体供血小动脉往往数量较多,供血小动脉不仅未增粗反而较正常分支更纤细、纡曲。相应的超选择性插管时要尽可能超选到每一根供血分支,并且要尽可能越过正常分支。栓塞硬化治疗时应尽量减缓瘤体中的血流速度,四肢病灶可使用止血带[2]。术后患儿血小板计数逐渐恢复正常,瘤体颜色由鲜红色转为暗红色,表面皮肤出现皱褶,局部温度下降,均提示治疗有效[2]。
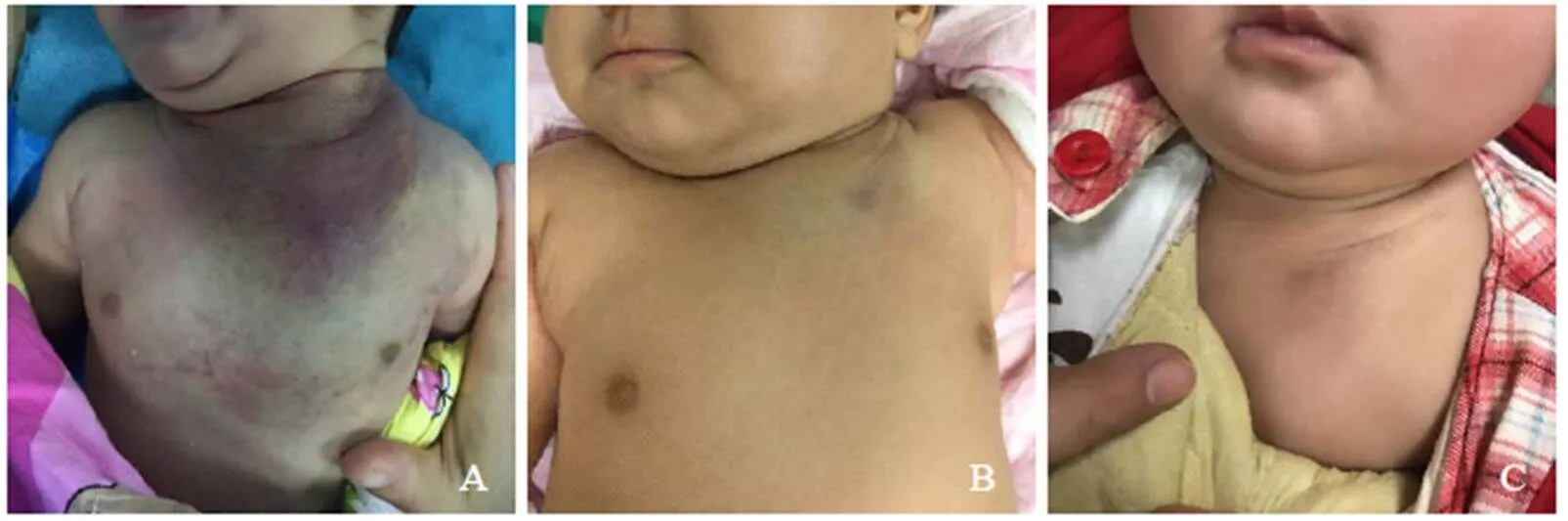
图1 男,1个月16 d,左胸壁KMP。术前血小板16×109/L,瘤体周边伴有广泛皮下瘀血(A);介入治疗术后1个月,瘤体明显缩小,边界清楚,血小板恢复至272×109/L(B);介入治疗术后3个月,瘤体基本消失,皮肤表面仅见部分色素沉着(C)
4 注射治疗
对于瘤体较大、不易手术切除且内科治疗无效的患儿可考虑采用病灶局部注射治疗,常用药物为平阳霉素、糖皮质激素等,以提高直接作用于瘤体的药物浓度,减少全身吸收并缩短起效时间。对于极低体重或血管条件极差的患者,无法行经导管动脉硬化栓塞术,也可以选择此方式。平阳霉素治疗血管瘤的机制是抑制DNA合成和切断DNA链,局部注射后可破坏内皮细胞结构、抑制异常内皮细胞增生,促使血管瘤发生变性、坏死而退化[12],主要副作用有发热、食欲不振、皮疹、过敏性休克、局部坏死性溃疡、色素沉着等。以长效糖皮质激素进行瘤内注射,可增加瘤体内肥大细胞的数量,从而促进血管瘤内皮细胞凋亡,不良反应有生长迟缓、局部多毛和皮肤菲薄,严重程度与用药剂量及疗程呈正相关,停药后一般可恢复[7]。欧阳天祥等[37]报道于瘤体内注射无水乙醇栓塞其回流静脉后再注入得宝松,单次注射7 d后血小板恢复正常,瘤体逐渐消退。推测为栓塞硬化剂随回流静脉闭塞肿瘤内的异常通道,减少血管瘤对血小板的过滤捕获作用,使激素在局部作用持久[2]。
5 支持治疗
及时的支持治疗是避免危重患儿发展为弥散性血管内凝血的关键,其方法包括输注血制品和丙种球蛋白[2]。KMP患儿因血小板不断被消耗减少,导致广泛皮下出血,继而激活内源性凝血级联反应,并消耗血液中的多种凝血因子,导致血液呈低凝状态,加重出血倾向,易形成恶性循环。因此,在诊治过程中要密切监测血小板计数及凝血功能,并根据实验室检查结果及时调整KMP治疗方案。对于出现病灶内出血、广泛出血或在侵入性治疗前凝血时间延长的患儿,建议给予新鲜冰冻血浆15 ml/kg代替消耗的凝血因子;严重的低纤维蛋白原血症不能由新鲜冰冻血浆单独纠正时考虑给予冷沉淀剂5~10 ml/kg支持治疗[12]。对于大剂量激素治疗不敏感的患儿,可输注机器采集血小板后立即进行介入手术治疗。但由于KMP患儿输注血小板后,血小板计数仅能短暂性维持正常,2 d内会迅速降低,且临床治疗发现输注血小板可促进KMP患者瘤体生长,因此不能把输注血小板作为KMP的常规治疗手段,仅用于急性出血或术前准备。部分临床研究提示丙种球蛋白可以提高KMP患儿的血小板数量[30],其作用机制可能与丙种球蛋白的免疫调节作用及KMP患儿输注血小板后产生抗血小板抗体有关[14]。
6 其他
KMP的其他治疗方法如放射治疗,采用放射线照射可使瘤体组织缩小。Watanabe等[38]报道采用低剂量放射治疗成功治疗长春新碱耐药的KMP患儿。但由于放射治疗可引起局部生长障碍、晚期皮肤损害、骨组织破坏、诱发恶变等,并可能继发其他肿瘤,故通常在危重患者或其他治疗方案无效时才考虑[12]。同时,加压包扎法对于治疗KMP也有一定的疗效[12],可以作为其辅助治疗方法之一。
综上所述,KMP是一种罕见的婴幼儿血管瘤,但其发展迅速,死亡率高达20%~30%。目前尽管有手术切除、药物治疗以及介入手术等多种治疗方法,但对于KMP的临床治疗主要是经验性治疗,尚无统一有效的治疗方案,需要进一步研究与探讨。
[1] Kasabach HH, Merritt KK. Capillary hemangioma with extensive purpura-report of a case. Am J Dis Child, 1940, 59(5): 1063-1070.
[2] 徐苗, 欧阳天祥. 伴Kasabach-Merritt现象的卡波西样血管内皮瘤和丛状血管瘤的研究进展. 中华整形外科杂志, 2015, 31(5): 396-400.
[3] Sarkar M, Mulliken JB, Kozakewich HP, et al. Thrombocytopenic coagulopathy (Kasabach-Merritt phenomenon) is associated with Kaposiform hemangioendothelioma and not with common infantile hemangioma. Plast Reconstr Surg, 1997, 100(6): 1377-1386.
[4] 张靖, 谭小云, 周少毅, 等. 对《新生儿卡-梅综合征介入治疗方法选择及疗效观察》一文的看法. 中华放射学杂志,2016, 50(3): 239-244.
[5] Croteau SE, Liang MG, Kozakewich HP, et al. Kaposiform hemangioendothelioma: atypical features and risks of Kasabach-Merritt phenomenon in 107 referrals. J Pediatr, 2013, 162(1): 142-147.
[6] Lyons LL, North PE, Mac-Moune Lai F, et al. Kaposiform hemangioendothelioma: a study of 33 cases emphasizing its pathologic, immunophenotypic, and biologic uniqueness from juvenile hemangioma. Am J Surg Pathol, 2004, 28(5): 559-568.
[7] Lee JJ, Lin LY, Hsieh SW, et al. Successful treatment of Kasabach-Merritt phenomenon with intralesional corticosteroid injections: a case series. Ann Plast Surg, 2012, 69(6): 627-632.
[8] Garcia-Monaco R, Giachetti A, Peralta O, et al. Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon: successful treatment with embolization and vincristine in two newborns. J Vasc Interv Radiol, 2012, 23(3): 417-422.
[9] Freeman I, Ganesan K, Emmerson AJ. Kasabach-Merritt syndrome in a term neonate. Arch Dis Child Fetal Neonatal Ed, 2012, 97(2): F139-F140.
[10] 柏露, 张乐萍. Kasabach-Merritt现象. 中国小儿血液与肿瘤杂志, 2015, 20(2): 57-59.
[11] Chiu YE, Drolet BA, Blei F, et al. Variable response to propranolol treatment of Kaposiform hemangioendothelioma, tufted angioma, and Kasabach-Merritt phenomenon. Pediatr Blood Cancer, 2012, 59(5): 934-938.
[12] 周少毅. Kasabach-Merritt综合征治疗研究新进展. 中华小儿外科杂志, 2012, 33(12): 948-950.
[13] 谭小云, 张靖, 周少毅, 等. 经导管动脉硬化栓塞术联合长春新碱治疗激素抵抗型婴幼儿Kasabach-Merritt综合征. 中华放射学杂志, 2014, 48(11): 934-937.
[14] 龚毓宾, 孙斌, 雷红召, 等. Kasabach-Merritt现象的研究进展和治疗. 中华实用儿科临床杂志, 2014, 29(10): 789-791.
[15] Shen W, Cui J, Chen J, et al. Kasabach-Merritt syndrome with partial resection of tumor, reduction of tumor blood, and vincristine chemotherapy. J Craniofac Surg, 2010, 21(1): 215-216.
[16] 苏刚. 卡梅综合征和卡梅现象. 中国小儿血液与肿瘤杂志, 2015, 20(1): 1-5.
[17] Matsumoto H, Ozeki M, Hori T, et al. Successful everolimus treatment of Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon: clinical efficacy and adverse effects of mTOR inhibitor therapy. J Pediatr Hematol Oncol, 2016, 38(8): e322-e325.
[18] 张朝霞, 刘嵘, 李君惠, 等. 婴儿血管瘤合并Kasabach-Merritt综合征1例报告并文献复习. 中国医刊, 2016, 51(8): 83-86.
[19] Blatt J, Stavas J, Moats-Staats B, et al. Treatment of childhood Kaposiform hemangioendothelioma with sirolimus. Pediatr Blood Cancer, 2010, 55(7): 1396-1398.
[20] Schroeder U, Lauten M, Stichtenoth G, et al. Laryngomalacia and complicated, life-threatening mTOR-positive Kaposiform hemangioendothelioma cured by supraglottoplasty and sirolimus. Klin Padiatr, 2014, 226(6/7): 362-368.
[21] Kai L, Wang Z, Yao W, et al. Sirolimus, a promising treatment for refractory Kaposiform hemangioendothelioma. J Cancer Res Clin Oncol, 2014, 140(3): 471-476.
[22] Yadav D, Maheshwari A, Aneja S, et al. Neonatal Kasabach-Merritt phenomenon. Indian J Med Paediatr Oncol, 2011, 32(4): 238-241.
[23] Greenberger S, Boscolo E, Adini I, et al. Corticosteroid suppression of VEGF-a in infantile hemangioma-derived stem cells. N Engl J Med, 2010, 362(11): 1005-1013.
[24] 燕丽, 徐哲, 孙玉娟, 等. 婴儿Kasabach-Merritt综合征16例临床回顾性分析. 实用皮肤病学杂志, 2015, (4): 257-259.
[25] Jiang RS, Hu R. Successful treatment of Kasabach-Merritt syndrome arising from Kaposiform hemangioendothelioma by systemic corticosteroid therapy and surgery. Int J Clin Oncol, 2012, 17(5): 512-516.
[26] Wang ZP, Li K, Yao W, et al. Steroid-resistant Kaposiform hemangioendothelioma: a retrospective study of 37 patients treated with vincristine and long-term follow-up. Pediatr Blood Cancer, 2015, 62(4): 577-580.
[27] Haisley-Royster C, Enjolras O, Frieden IJ, et al. Kasabach-merritt phenomenon: a retrospective study of treatment with vincristine. J Pediatr Hematol Oncol, 2002, 24(6): 459-462.
[28] Thomson K, Pinnock R, Teague L, et al. Vincristine for the treatment of Kasabach-Merritt syndrome: recent New Zealand case experience. N Z Med J, 2007, 120(1249): U2418.
[29] 周少毅, 张靖. 经导管动脉硬化栓塞术治疗Kasabach-Merritt综合征. 中国介入影像与治疗学, 2014, (7): 415-418.
[30] 雷红召, 黄静, 孟小分, 等. 药物联合手术治疗Kasabach-Merritt综合征. 中华整形外科杂志, 2013, 29(2): 104-108.
[31] Acharya S, Pillai K, Francis A, et al. Kasabach Merritt syndrome: management with interferon. Indian J Dermatol, 2009, 55(3): 281-283.
[32] Léauté-Labrèze C, Dumas De La Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy. N Engl J Med, 2008, 358(24): 2649-2651.
[33] Yogangi MD, Catherine SD, Mcnamara J, et al. Congenital Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon successfully treated with low-dose radiation therapy. Pediatr Dermatol, 2014, 31(5): 595-598.
[34] De La Hunt MN. Kasabach-Merritt syndrome: dangers of interferon and successful treatment with pentoxifylline. J Pediatr Surg, 2006, 41(1): e29-e31.
[35] Fernandez-Pineda I, Lopez-Gutierrez JC, Chocarro G, et al. Long-term outcome of vincristine-aspirin-ticlopidine (VAT) therapy for vascular tumors associated with Kasabach-Merritt phenomenon. Pediatr Blood Cancer, 2013, 60(9): 1478-1481.
[36] Ryan C, Price V, John P, et al. Kasabach-Merritt phenomenon: a single centre experience. Eur J Haematol, 2010, 84(2): 97-104.
[37] 欧阳天祥, 邢新, 李军辉, 等. 栓塞硬化联合激素注射治疗K-M综合征. 第二军医大学学报, 2002, 23(6): 676-677.
[38] Watanabe Y, Onuma M, Looi CY, et al. Vincristine-resistant Kasabach-Merritt phenomenon successfully treated with low-dose radiotherapy. Int J Hematol, 2011, 93(1): 126-128.
(本文编辑 张春辉)

2017-09-02
2018-01-16
R732.2
10.3969/j.issn.1005-5185.2018.02.020
