豚鼠近视模型中屈光度眼轴长度及巩膜Ⅰ型胶原纤维变化的研究
2018-04-19
在全球屈光性疾病中,近视的发病率居首,且常见于学龄儿童及青少年。在亚洲及东南亚地区的城市中,青少年受近视的困扰最甚。这不仅给青少年带来苦恼,也增加了全球负担[1-2]。我国近视发病率已位居世界第二,仅次于日本,占世界近视总人数的33%[3-4],但目前近视的发病机制仍不是十分清楚。因此,对近视发病机制的研究是亟待解决的医学难题。
以往的研究[5]认为,新生动物或人眼正视化进程有赖于眼的各部分相互协调和精确调控,早期适宜的视觉经验对眼球的正常生长与正视化进程非常重要。在动物发育早期,如剥夺其形觉视觉以干扰正视化视觉依赖性反馈机制,将导致眼轴过度延长,产生近视,即形觉剥夺性近视[6]。研究[7]显示,巩膜重塑在近视的发生发展进程中起到至关重要的作用。巩膜中含量最多的是胶原纤维,占巩膜净重的90%,Ⅰ型胶原纤维在巩膜中占75%以上[8]。早期研究[9]表明,形觉剥夺性近视可导致玻璃体腔扩大,巩膜组织结构也发生变化,特别是后极部。本研究通过面罩遮盖豚鼠单眼制作形觉剥夺性近视(form deprivation myopia,FDM)模型,对实验组和两组对照组进行屈光度和眼轴长度的测量,并观察后极部巩膜中Ⅰ型胶原纤维的变化,现报道如下。
1 材料与方法
1.1伦理学声明实验程序依照《实验动物管理与使用指南》[10]。本研究方案经安徽医科大学实验动物伦理委员会审查批准(LLSC20150115)。
1.2动物形觉剥夺模型的建立和分组选用出生7 d,体质量为100~140 g的健康新生有色豚鼠75只,采用带状光检影法排除有先天性近视及其他全身疾病的豚鼠,在安徽医科大学附属省立医院实验动物中心室内12 h自然照明和12 h黑暗环境下(以每天上午8时为起始时间),并给予水、富含维生素的豚鼠饲料及新鲜蔬菜等饲养,室内温度为22℃。将75只豚鼠采用完全随机分组方法分为空白对照组(共25只,分为5组,每组5只)和FDM模型组(50只,分为5组,每组10只)。豚鼠(诱导前、诱导后2、4、6周及诱导4周去诱导1周)FDM组佩戴头套,具体方法:采用6号半透明乳胶气球套住豚鼠头部,将对照眼、鼻唇部及耳部气球剪去并暴露,左眼气球保留遮盖,用订书机将气球头套于颈部对折固定,防止眼罩滑落及旋转。遮盖眼为形觉剥夺组,对侧未遮盖眼为自身对照组,空白对照组不做任何处理。
1.3观察指标及方法
1.3.1屈光度及眼轴长度将豚鼠标记、编号,分别于诱导前0 周、诱导后2周、4周、6周及诱导4周去诱导1周(4/-1周),托吡卡胺充分扩瞳,在暗室内采用带状光检影(六六,中国)验光,取其平均值,并精确到0.01 D;结膜囊滴用0.5%盐酸丙美卡因表面麻醉药物后,A超(TOMEY AL-100,日本)测定双眼眼轴长度(取角膜顶点到眼球后极部玻璃体视网膜界面的距离),以手动模式连续测量3次,取其平均值,精确到0.01 mm,由2名熟练的技师采用双盲法分别测量。
1.3.2后极部巩膜Ⅰ型胶原的免疫组化检测所有豚鼠均使用过量的1%戊巴比妥钠处死,摘除眼球放在提前备好的冰块上,去除眼前节。在以视神经为中心,直径为6 mm的范围内,切除巩膜组织,并剔除视神经部分。然后将巩膜组织放入40%二聚甲醛溶液中,4℃保存。组织脱水, 石蜡包埋、切片作HE染色及免疫组化染色。一抗:Ⅰ型胶原,稀释度1∶150。阴性对照以磷酸盐缓冲液(phosphate buffered solution,PBS)替代一抗,其余步骤相同。结果判定:Ⅰ型胶原在胞质中表达,呈棕黄色。随机选取后极部巩膜各10个部位进行图像扫描,遵循双盲原则测量Ⅰ型胶原的相对蛋白表达量。

2 结果
2.1眼球屈光度出生后1周左右,豚鼠双眼呈远视状态,3组中豚鼠的屈光度两两相比,差异无统计学意义。随着遮盖时间的不断延长,FDM组的屈光状态逐渐由远视变成近视。空白对照组和自身对照组远视度数略有减低,两组间在每个时间点的差异均无统计学意义。除实验前,FDM组眼屈光状态和空白对照组及自身对照组各时间点的差异均有统计学意义(P<0.05)。见表1、2 。
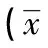
表1 FDM组与空白对照组在造模前后不同时间点屈光度比较±s,D)
注:F分组是FDM组与空白对照组间总体的比较;F时间是不同时间点与各自时间点空白对照组总体比较,与各自时间点空白对照组比较,aP<0.05(两因素方差分析,LSD-t检验)
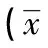
表2 自身对照组与FDM组不同时间点屈光度值比较±s,D)
2.2眼轴长度遮盖前,空白对照组、自身对照组及FDM组的豚鼠眼球的眼轴长度两两相比,差异无统计学意义(P>0.05)。随着遮盖时间的不断延长,FDM组的眼轴长度逐渐延长。空白组对照组和自身对照组眼轴长度略有延长,各时间点两组间的差异均无统计学意义(P>0.05)。FDM组眼屈光状态和自身对照组及空白对照组比较,除遮盖前,其余时间点的差异均有统计学意义(P<0.05)。见表3、4。
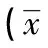
表3 空白对照组与FDM组不同时间点眼轴长度比较±s,mm)
注:F分组是FDM组与空白对照组间总体的比较;F时间是不同时间点与各自时间点空白对照组总体比较,与各自时间点空白对照组比较,bP<0.05(两因素方差分析,LSD-t检验)
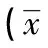
表4 自身对照组与FDM组不同时间点眼轴长度比较±s,mm)
注:FDM为形觉剥夺性近视
2.3FDM组屈光度与眼轴长度之间的相关性分析FDM组中,豚鼠眼球的屈光度发生了明显的变化,随着遮盖时间的不断延长,由遮盖前的远视眼逐渐演变为近视眼,且屈度数不断增加,同时,眼轴长度也不断增长,两者之间存在显著的负相关(r=-0.997,P<0.05)。
2.4巩膜中Ⅰ型胶原纤维的变化在遮盖前0周时,FDM组与两组对照组的Ⅰ型胶原纤维无明显差别;FDM组遮盖2周、4周、4/-1周及6周的亚组中,Ⅰ型胶原纤维随着遮盖时间的延长,表达量逐渐下降;而空白对照组及自身对照组的Ⅰ型胶原纤维却无明显变化。见表5、6,图1。
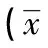
表5 空白对照组与FDM组Ⅰ型胶原蛋白的相对表达量比较±s,ug/L)
注:F分组是FDM组与空白对照组间总体的比较;F时间是不同时间点与各自时间点空白对照组总体比较,与各自时间点空白对照组比较,cP<0.05(两因素方差分析,LSD-t检验);FDM为形觉剥夺性近视
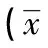
表6 自身对照组与FDM组不同时间点Ⅰ型胶原蛋白相对表达量比较±s,ug/L)
注:FDM为形觉剥夺性近视

图1 豚鼠后极部巩膜型胶原纤维的变化(×400)
注:A为FDM组未遮盖;B为FDM组遮盖2周;C为FDM组遮盖4周;D为FDM组遮盖4周去遮盖1周;E为FDM组遮盖6周;F为空白对照组未遮盖;G为空白对照组遮盖2周;H为空白对照组遮盖4周;I为空白对照组遮盖4周去遮盖1周;J为空白对照组遮盖6周;K为自身对照组未遮盖;L为自身对照组遮盖2周;M为自身对照组遮盖4周;N为自身对照组遮盖4周去遮盖1周;O为自身对照组遮盖6周
3 讨论
本实验是在利用半透明面罩来遮盖豚鼠,从而使视网膜模糊成像,结果显示,豚鼠形觉剥夺性近视的形成过程中伴随着眼球近视度数逐渐增加和眼轴长度不断增长,表明成功构建了形觉剥夺性近视动物模型。本实验采用12 h/12 h昼夜交替遮盖,从而避免在黑暗条件下无法顺利形成近视。研究结果与杨蓓等[11]的研究相符合,他们也是利用相似手段,从而构建豚鼠近视模型,观察短期豚鼠形觉剥夺性近视的屈光状态、眼轴及后极部巩膜的改变。实验显示,随着时间的延长,实验组豚鼠逐渐变为近视,同时,眼轴长度也不断延长。在实验前(0周)时,FDM组与空白对照组及自身对照组的屈光度及眼轴长度无明显区别,差异无统计学意义,随着遮盖时间的延长,FDM组与两组对照组间以后每个时间点所测屈光度及眼轴长度差异均有统计学意义(P<0.05),但空白对照组与自身对照组在每个时间点的屈光度及眼轴长度差异均无统计学意义。FDM组除遮盖4周去遮盖1周与遮盖4周两亚组间的屈光度及眼轴长度差异无统计学意义,其余各亚组间的差异均有统计学意义(P<0.05)。以上结果表明,形觉剥夺法可成功构建近视动物模型,另外,从遮盖4周去遮盖1周的豚鼠亚组的实验结果可知,一旦形觉剥夺的诱导去除,豚鼠的近视进展便会基本停止。FDM组各个亚组的屈光度及眼轴长度间呈高度的负相关,说明在一定程度内,随着近视度数进展,眼轴长度逐渐延长[10]。
Rada等[12]认为,大多数近视是通过延长眼球的玻璃体腔产生的。高度近视的特征在于巩膜变薄和后巩膜的局部扩张。巩膜作为眼睛的外涂层十分致密,由纤维状的粘弹性结缔组织及不规则排列的胶原纤维薄片组成,其间填充蛋白聚糖和非胶原糖蛋白。巩膜成纤维细胞位于巩膜片层之间,并且负责合成它们所在的细胞外基质。巩膜细胞外基质重塑是近视发生发展的重要环节。在实验的两组对照组的后极部巩膜中可以观察到,Ⅰ型胶原纤维无明显变化,但在FDM组各亚组豚鼠的后极部巩膜中,Ⅰ型胶原纤维的表达量在不断降低,这与Harper等[13]的研究相符合。从而可以进一步说明,在豚鼠出生早期进行形觉剥夺,可以很快使巩膜出现病理改变,且这种改变会随着遮盖时间的延长表现的越来越明显。Jonas等[14]的研究认为,在近视进展中,形态学的改变先于生物学, 在近视早期,巩膜通过代偿调节,当调节失代偿后,才会出现生物学改变。本实验的结果并未完全支持这种结论,这可能是本研究分组的时间点设置较长导致。
综上所述,使用形觉剥夺法顺利成功构造了近视动物模型,对于出生不久的豚鼠,在遮盖不久后便出现屈光度及眼轴长度的变化,在一定程度内,随着遮盖时间的不断延长,这种变化会越来越明显,且两者的变化呈高度的负相关性。本研究只是对动物近视模型中屈光度、眼轴长度及巩膜Ⅰ型胶原纤维变化进行初步研究,对于其确切机制还有待进一步的深入研究。
[1]GUO L,YANG J,MAI J,et al.Prevalence and associated factors of myopia among primary and middle school-aged students: a school-based study in Guangzhou[J]. Eye (Lond),2016,30(6):796-804.
[2]FOSTER P J, JIANG Y. Epidemiology of myopia[J]. Eye (Lond),2014,28(2):202-208.
[3]JIANG B,WU Z Y,ZHU Z C,et al.Expression and role of specificity protein 1 in the sclera remodeling of experimental myopia in guinea pigs[J].Int J Ophthalmol,2017,10(4):550-554.
[4]唐磊,廖荣丰.有晶状体眼后房型人工晶体植入矫正高度近视合并散光研究进展[J].安徽医学,2016,37(9):1185-1188.
[5]ROBBINS R A,MAURER D,HATRY A,et al.Effects of normal and abnormal visual experience on the development of opposing aftereffects for upright and inverted faces[J].Dev Sci,2012,15(2):194-203.
[6]MISHRA M,RENTSCH M,KNUST E.Crumbs regulates polarity and prevents light-induced degeneration of the simple eyes of Drosophila,the ocelli[J].Eur J Cell Biol,2012,91(9):706-716.
[7]朱子诚,吴章友,温跃春,等.AG490抑制STAT3信号通路活性对豚鼠形觉剥夺性近视巩膜重塑的调控[J].中华实验眼科杂志,2015,33(6):493-499.
[8]GENTLE A,LIU Y,MARTIN J E,et al.Collagen gene expression and the altered accumulation of scleral collagen during the development of high myopia[J].J Biol Chem,2003,278(19):16587-16594.
[9]MCBRIEN N A, CORNELL L M, GENTLE A. Structural and ultrastructural changes to the sclera in a mammalian model of high myopia.[J]. Invest Ophthalmol Vis Sci, 2001, 42(10):2179.
[10]姜波,吴章友,朱子诚,等.豚鼠进展性近视眼巩膜中Smad3和Ⅰ型胶原的动态表达变化[J].中华实验眼科杂志,2017,35(6):491-497.
[11]杨蓓,刘桂香.豚鼠短期形觉剥夺性近视屈光度眼轴及巩膜改变[J].国际眼科杂志,2009,9(10):1871-1875.
[12]RADA J A,SHELTON S,NORTON T T.The sclera and myopia[J].Exp Eye Res,2006,82(2):185-200.
[13]HARPER A R,SUMMERS J A.The Dynamic Sclera: Extracellular Matrix Remodeling in Normal Ocular Growth and Myopia Development[J].Exp Eye Res,2015, 133:100-111.
[14]JONAS J B,XU L.Histological changes of high axial myopia[J].Eye,2014, 28(2):113-117.
