百里香抑菌物质的提取工艺优化及活性研究
2018-04-17王娣柯春林曹珂珂李妍
王娣,柯春林,曹珂珂,李妍
(蚌埠学院 生物与食品工程系,安徽 蚌埠 233030)
超高压技术是指常温下用100~1000 MPa的流体静压力作用于物料,瞬间的升、降压差会使活性成分渗出细胞进入提取液中[1-3]。超高压提取(UHPE)具有效率高、能耗低等优点,可用于食品灭菌及淀粉、蛋白质变性等,也可对精油、多酚类、黄酮类等活性成分进行提取[4-12]。
百里香(Thyme)为唇形科,主要分布在长江流域以北地区,例如甘肃、陕西等省[13,14]。在我国古代著作《嘉祜本草》、《御制本草品汇精要》等中均有记载[15,16],百里香是一种天然调味品,常用于烹饪时除腥提鲜,有较高的食用价值。本文利用超高压提取百里香活性成分,采用响应面法对百里香抑菌物质的提取工艺进行优化;研究百里香提取物对3种常见食品污染菌的抑菌作用;对百里香超高压提取物进行成分分析,为深入研究百里香生物活性功能、西北百里香资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
百里香(Thyme):产于陕西省吴起县,低温烘干,粉碎过60目筛备用。
金黄色葡萄球菌(S.aureus):编号29213,广州微生物研究所;大肠杆菌(E.coli):学校食品学院微生物实验室保藏;单增李斯特菌(L.monocytogenes):编号1.10753,中科院微生物所;芦丁标准品、没食子酸标准品:中国生物制品检定所;百里香酚标准品:绿叶制药集团有限公司;乙醇、苯酚、硫酸、葡萄糖(分析纯):中国医药(集团)上海化学试剂公司;胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA):海博生物技术有限公司。
HPP.L2B-600/0.6超高压设备天津华泰森淼生物工程技术有限公司;MZKR022-R高速冷冻离心机德国Hettich公司;RE200B旋转蒸发仪巩义市予华仪器有限责任公司;CHR-ST冷冻干燥机德国Christ公司;WGZ-2XJ细菌浊度分析仪上海昕瑞仪器仪表有限公司;DDBJ-350电导率仪杭州齐威仪器有限公司; TU-1901紫外分光光度计北京普析通用仪器有限责任公司;GC9790气相色谱仪浙江福立分析仪器;LDR0026-07蒸汽发生器上海华征热能设备有限公司;DHP030恒温培养箱上海实验仪器有限公司。
1.2 百里香抑菌成分的提取、分析及抑菌作用研究
百里香→粉碎→超高压提取→离心→旋转蒸发→真空冷冻→低温避光保存→抑菌活性试验。
1.2.1超高压提取百里香抑菌成分最佳条件的确定
以大肠杆菌(Escherichiacoli)的相对电导率作为百里香提取物质抑菌作用大小的指标。电导率是衡量溶液离子强度高低的参数,当微生物遇到抑菌剂时细胞膜会遭到破坏,细胞膜的渗透性会增强,细胞内部的电解质会外泄,使电导率上升,因此菌液电导率的变化可以反映细胞膜通透性的变化[17,18]。参照改进Kong等的方法[19],将对数期的大肠杆菌在4 ℃,5000 r/min离心15 min,用5%的葡萄糖溶液反复清洗,直到获得等渗细胞,其电导率与5%的葡萄糖溶液相同,将菌体悬浮至OD600=0.4,加入百里香超高压提取物(5 mg/mL),测定、计算相对电导率。

式中:L1为加入百里香提取物的等渗细胞菌悬液初始时电导率;L2为加入百里香提取物的等渗细胞菌悬液于37 ℃培养3 h的电导率;L0为等渗细胞菌悬液在沸水中加热5 min的电导率。
1.2.1.1百里香预处理
将百里香粉碎过筛(60目),得百里香粉。准确称取百里香粉于聚乙烯袋中,加入乙醇溶液,真空密封,放入超高压设备中进行提取, 4000 r/min 离心 5 min,旋转蒸发,真空冷冻干燥,冷藏备用。
1.2.1.2单因素试验
研究压力(100,200,300,400,500 MPa)、料液比[1∶20,1∶30,1∶40,1∶50,1∶60 (g/mL)]、乙醇浓度(50%,60%,70%,80%,90%)、保压时间(2,4,6,8,10 min)对超高压百里香抑菌成分提取的影响。
1.2.1.3超高压提取工艺响应面试验
根据Box-Behnken试验设计原理,利用Design-Expert 8.0软件进行3因素3水平试验,试验因素和水平表见表1。
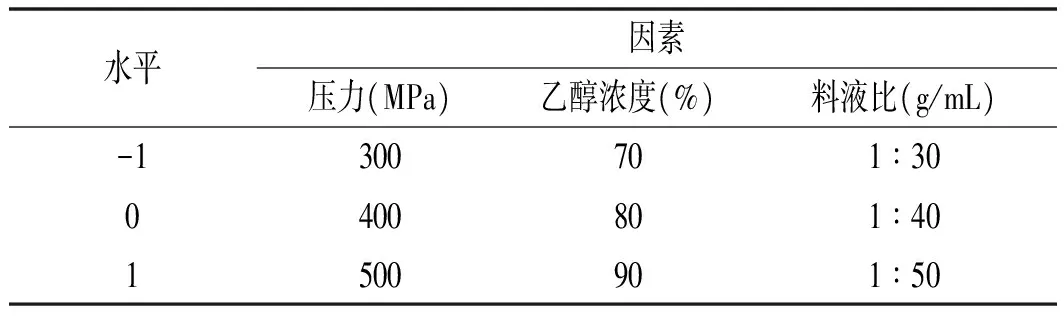
表1 响应面试验因素Table 1 Factors and levels of response surface methodology
1.2.2百里香超高压提取物抑菌作用研究
1.2.2.1最低抑菌浓度(MIC)的测定
采用试管倍半稀释法测定最低抑菌浓度[20]。用营养肉汤培养基稀释S.aureus,E.coli,用TSB稀释L.monocytogenes至菌悬液为1×106cfu/mL。取10支无菌试管,每管各加5 mL液体培养基,在第1支试管内加入5 mL用相同培养液溶解的百里香提取物,混匀后吸取5 mL至第2管,以此类推,从第10管吸取5 mL弃去,做空白对照,加入100 μL 菌悬液,37 ℃培养24 h,观察,菌不生长的最低浓度即对该菌的MIC 值。
1.2.2.2百里香超高压提取物对3种细菌生长曲线的影响
将百里香提取物加到S.aureus,L.monocytogenes及E.coli的培养基中,使终浓度为MIC和1/2MIC,120 r/min 37 ℃培养,每2 h取样测定600 nm处的吸光度值,探讨其对细菌生长曲线的影响。
1.2.2.3百里香超高压提取物对3种细菌细胞内容物泄露的影响
在Cooper等实验基础上稍做改动[21],采用上清液在260 nm测定细菌胞内核酸成分泄露量。用磷酸盐缓冲溶液(PBS,pH 7.4)悬浮对数生长期的S.aureus、L.monocytogenes及E.coli细胞至1×106cfu/mL,将百里香提取物加到菌悬液中,使终浓度为MIC和2MIC,做空白对照,120 r/min,37 ℃培养0~3 h,0.22 μm滤膜过滤,260 nm处测吸光度,以评估细胞中核酸泄漏量。
1.2.3百里香提取物成分分析
研究发现,百里香中黄酮、多酚及水、醇提取物对大肠杆菌、金黄色葡萄球菌等细菌有一定抑制作用[22,23]。本文对在超高压最优条件下得到的百里香提取物进行黄酮、多酚等活性物质含量分析。
1.2.3.1总黄酮含量检测
准确称取芦丁标准品、30%的乙醇溶解定容。吸取0,1.0,2.0,3.0,4.0,5.0 mL标准溶液于10 mL容量瓶中,加5%的NaNO2溶液0.3 mL还原6 min,10%的Al(NO3)3溶液0.3 mL络合6 min,1 mol/L的NaOH溶液4 mL定容显色15 min,510 nm处测吸光度,得芦丁标准曲线,将百里香超高压提取物溶解稀释后按上述方法检测黄酮含量。
1.2.3.2总多酚含量检测
采用福林酚法进行测定。精确称取没食子酸标准品,蒸馏水溶解定容制备2 mg/L标准液。吸取标准溶液1.0,2.0,3.0,4.0,5.0 mL于50 mL容量瓶中,加FC试剂6.0 mL,摇匀,加10% Na2CO3溶液24.0 mL,定容,30 ℃避光2 h,760 nm处测吸光度,得没食子酸标准曲线,将百里香超高压提取物溶解稀释后按上述方法检测总多酚含量。
1.2.3.3总多糖含量检测
采用苯酚-硫酸法测定多糖的含量。准确称取制备100 mg/L的葡萄糖标准溶液,吸取0,0.1,0.2,0.3,0.4,0.5,0.6 mL标准溶液于试管中,补水至2 mL,加入6%苯酚溶液1.0 mL,迅速滴加5.0 mL浓硫酸摇匀,显色冷却,490 nm处测吸光度得标准曲线,将百里香超高压提取物溶解稀释后按上述方法检测总多糖含量。
1.2.3.4百里香酚含量检测
精密称取百里香酚0.010 g,乙醇溶解稀释成20,40,60,80,100 μg/mL的标准液。GC条件:色谱柱:石英毛细管柱(30 m×0.25 mm,0.25 μm);检测器:300 ℃;进样器:230 ℃;辅助I:230 ℃;柱温箱:70 ℃,以25 ℃/min升温至130 ℃保持5 min,再以4 ℃/min升温至155 ℃保持2 min,最后以35 ℃/min升温至270 ℃保持3 min,得百里香酚的线性方程,将百里香超高压提取物稀释后用0.45 μm超滤膜过滤,气相色谱检测百里香酚含量。
2 结果与分析
2.1 超高压单因素试验结果
2.1.1压力对百里香抑菌成分超高压提取的影响

图1 压力对百里香抑菌物质提取的影响Fig.1 Effects of pressure on the extraction of thyme antibacterial substances
由图1可知,随着压力的升高,相对电导率呈现“增加-下降”的变化趋势,确定百里香最适提取压力为400 MPa。压力越大,溶剂越容易渗透进细胞,越有助于抑菌物质的提取,但压力过大可能会使抑菌成分受到破坏,引起抑菌作用下降。
2.1.2料液比对百里香抑菌成分超高压提取的影响
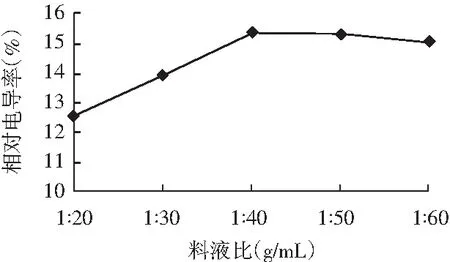
图2 料液比对百里香抑菌物质提取的影响Fig.2 Effects of solid to liquid ratio on the extraction of thyme antibacterial substances
由图2可知,随着乙醇用量的增大,相对电导率出现先增后降的趋势,因此确定1∶40为百里香抑菌物质的最适提取料液比。
2.1.3乙醇浓度对百里香抑菌成分超高压提取的影响

图3 乙醇浓度对百里香抑菌物质提取的影响Fig.3 Effects of ethanol concentration on the extraction of thyme antibacterial substances
由图3可知,随着乙醇体积分数的增加,相对电导率先增加后减小,因此确定80%为百里香抑菌物质的最适提取乙醇浓度。
2.1.4保压时间对百里香抑菌成分超高压提取的影响
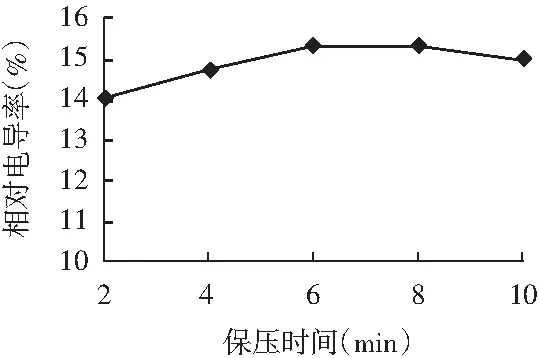
图4 保压时间对百里香抑菌物质提取的影响Fig.4 Effects of holding time on the extraction of thyme antibacterial substances
由图4可知,随着时间的延长,相对电导率先缓慢增加后趋于平稳并略有下降,由于在4 min和6 min处相对电导率无显著差异(P>0.05),表明保压时间对提取影响较小,所以在响应面优化设计中不再考虑保压时间。
2.2 响应面优化试验与结果
2.2.1响应面结果与分析
响应面试验设计及结果见表2。
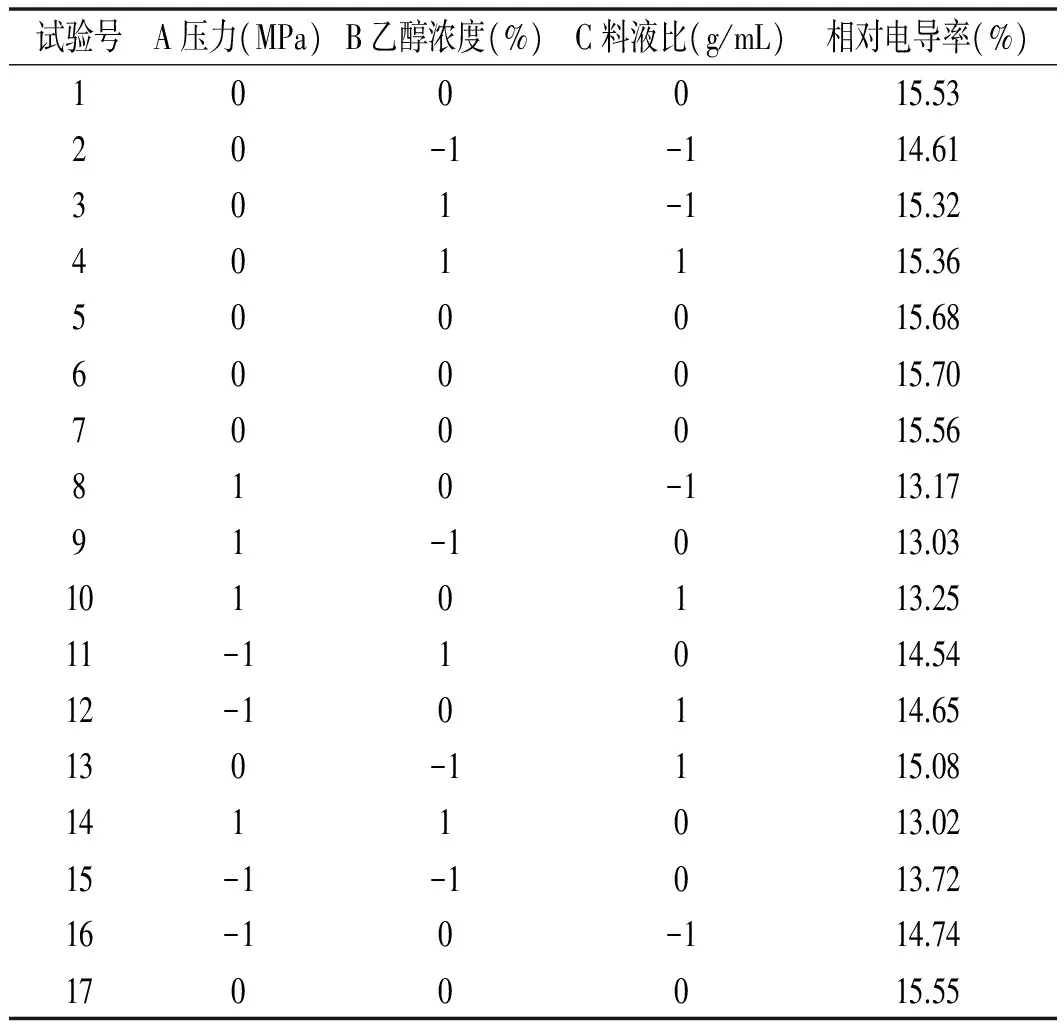
表2 响应面试验设计及结果Table 2 The experimental design and results of response surface methodology
2.2.2回归模型的建立与显著性分析
采用Design-Expert V8.0软件对数据进行分析,得到模拟方程为:Y=15.60-0.65A+0.23B+0.062C-1.58A2-0.44B2-0.068C2-0.21AB+0.042AC-0.11BC,该方程抛物面开口向下,具有极大值点。对该模型进行方差分析,结果见表3。
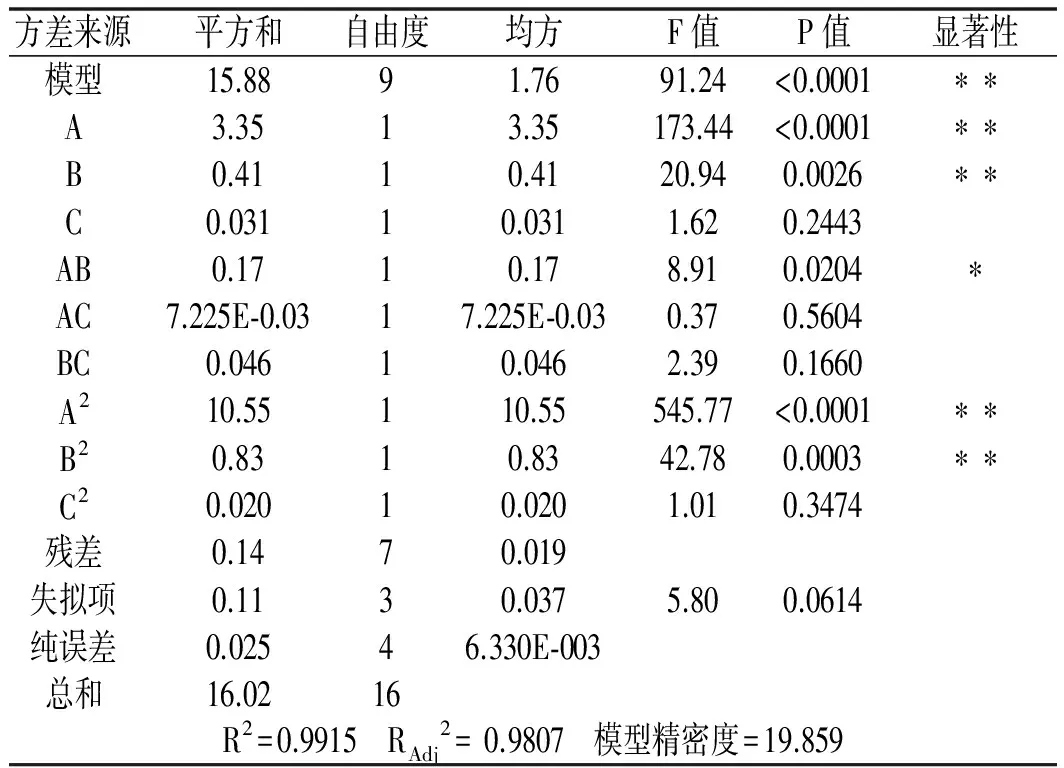
表3 回归模型方差分析Table 3 Regression model variance analysis
注:*,P<0.05,表示差异显著;**,P<0.01,表示差异极显著。
由表3可知,该模型的P<0.0001,说明二次多项回归模型为极显著。失拟项P值为0.0614,不显著(P>0.05),说明该模型与实际情况拟合较好。该模型R2=0.9915,说明该回归方程代表性较好;模型校正相关系数为RAdj2=0.9807,较好;变异系数为0.88%,说明试验结果重复性较好;模型精密度为25.235,说明该模型是可行的[24]。由表3中F值的大小可判断各因素对提取影响的强弱,F值越大,影响作用越强[25]。各个因素影响程度次序为:A(压力)>B(乙醇浓度)>C(料液比)。其中A和B对包埋效率的影响显著(P<0.05)。
由于C(料液比)对相对电导率无显著影响,固定料液比1∶40,可得A(压力)和B(乙醇浓度)对百里香抑菌物质提取影响的等高线和响应面图,见图5。
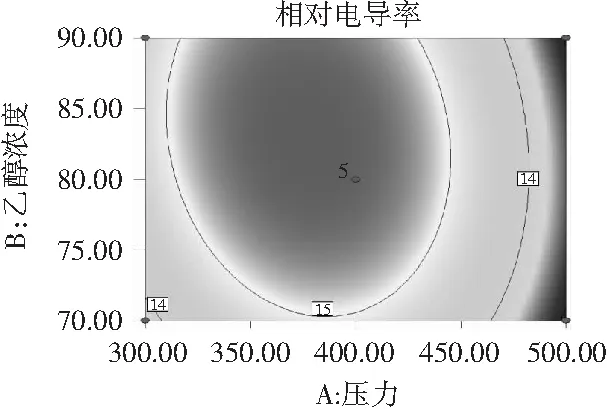
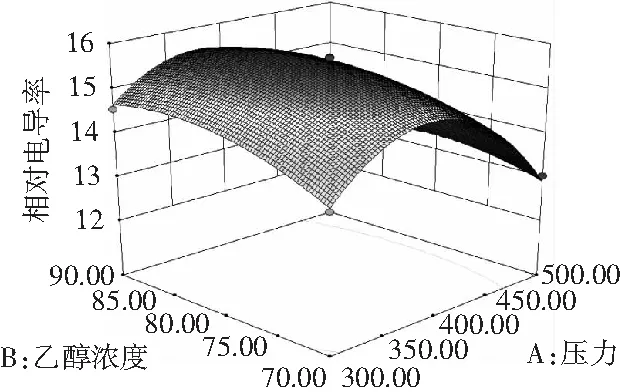
图5 压力和乙醇浓度对百里香抑菌物质提取的影响Fig.5 Effects of ethanol concentration and ultra high pressure on the extraction of the extracts from thyme
等高线能直观反映两因素交互作用的显著程度。由图5可知,响应面开口向下,有最大值。当料液比为0水平时,固定乙醇浓度不变时,相对电导率随超高压的压力增加出现先增后降;当固定压力不变时,相对电导率随乙醇浓度的增加出现先增后降的趋势,但前者曲面坡度陡峭明显大于后者,这与表3分析结果吻合。
2.3 验证试验
软件分析得到百里香抑菌物质最佳提取工艺为:压力377.9 MPa,乙醇浓度82.87%,料液比1∶41.63,相对电导率最大为15.7128%。考虑到实际操作,确定提取条件为:压力380 MPa,乙醇浓度83%,料液比1∶42,在此条件下,相对电导率最大为15.69%±0.21%。
2.4 百里香提取物抑菌试验结果
2.4.1百里香超高压提取物对3种细菌的最低抑菌浓度(MIC)

表4 百里香提取物抗菌活性Table 4 Antibacterial activities of the extracts from thyme
注:“+”表示长菌;“-”表示无菌生长。
由表4可知,百里香提取物对S.aureus,L.monocytogenes及E.coli3种细菌均有抑制作用,其中对S.aureus的抑制作用最强,其次是L.monocytogenes,对E.coli抑菌效果最小,可能百里香提取物对革兰氏阳性菌的抑制作用要强于革兰氏阴性菌,这和樊明涛等的研究结果相同。对S.aureus,L.monocytogenes及E.coli菌的最低抑菌浓度为0.188,0.375,3 mg/mL。
2.4.2百里香超高压提取物对3种细菌生长曲线的影响
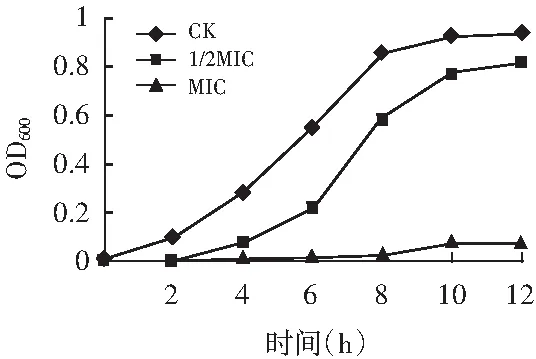
图6 金黄色葡萄球菌生长曲线Fig.6 Growth curve of S.aureus

图7 单增李斯特菌生长曲线Fig.7 Growth curve of L.monocytogenes
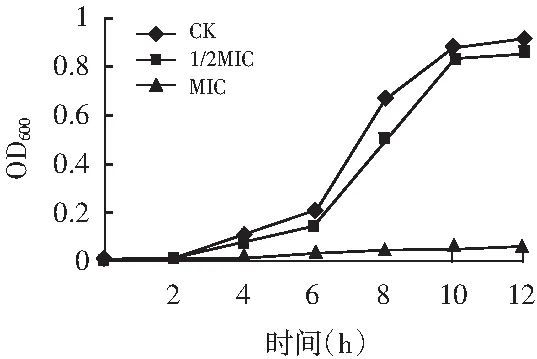
图8 大肠杆菌生长曲线Fig.8 Growth curve of E.coli
由图6可知,经过百里香提取物作用,S.aureus,L.monocytogenes及E.coli菌的生长曲线均产生明显变化,且随着百里香超高压提取物浓度的增加,生长曲线的变化也越大。在12 h内,对照组的细菌繁殖较快,菌体数量不断增加,当菌液中含有1/2MIC百里香提取物时,迟滞期延长,尤其是S.aureus和L.monocytogenes菌生长明显缓慢,增长的细菌数始终低于对照组;而当菌液中百里香提取物浓度为MIC时,菌液OD值基本未增加,这表明百里香超高压提取物对3种细菌的生长具有明显的抑制作用。
2.4.3百里香提取物对3种细菌细胞内容物泄露的影响
Chen 和Cooper的研究表明:260 nm 吸光物的释放与抑菌剂的杀菌活性有关。百里香超高压提取物对S.aureus,L.monocytogenes及E.coli菌作用后的菌悬液随时间的变化情况(A260)见图9~图11。

图9 百里香提取物对金黄色葡萄球菌紫外吸光度变化的影响Fig.9 Effects of extracts from thyme on the UV absorption of S.aureus
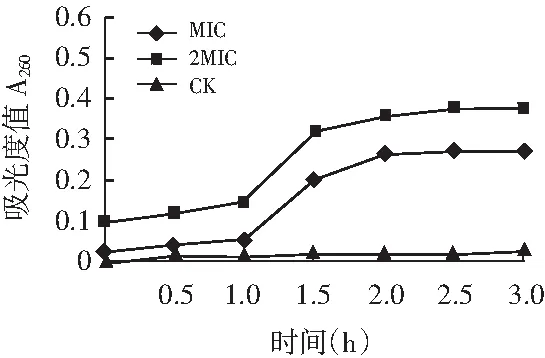
图10 百里香提取物对大肠杆菌紫外吸光度变化的影响Fig.10 Effects of extracts from thyme on the UV absorption of E.coli

图11 百里香提取物对单增李斯特菌紫外吸光度变化的影响Fig.11 Effects of extracts from thyme on the UV absorption of L.monocytogenes
试验结果显示:菌悬液的紫外吸收值随着百里香提取物浓度的增加而增加,这说明百里香超高压提取物的浓度越高,对细菌细胞膜的完整性破坏越严重。由于革兰氏阳性菌的S.aureus,L.monocytogenes没有细菌外膜[26],和革兰氏阴性菌E.coli的试验结果不同,阳性菌变化更快,S.aureus菌悬液的A260在1 h内快速增长达到平稳期(见图9),其次是L.monocytogenes,其A260在1.5 h内快速增长达到平稳期(见图10);而大肠杆菌A260在1~2 h 才有明显的增长(见图11)。
2.5 百里香提取物成分检测
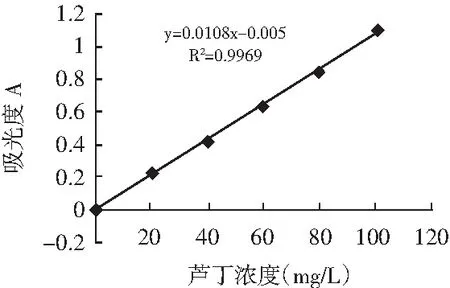
图12 芦丁标准曲线Fig.12 The standard work curve of rutin

图13 没食子酸标准曲线Fig.13 The standard work curve of gallic acid
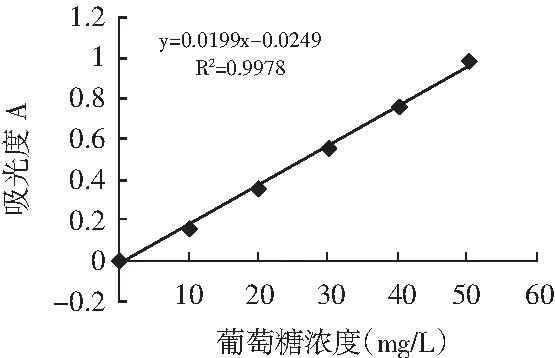
图14 葡萄糖标准曲线Fig.14 The standard work curve of glucose
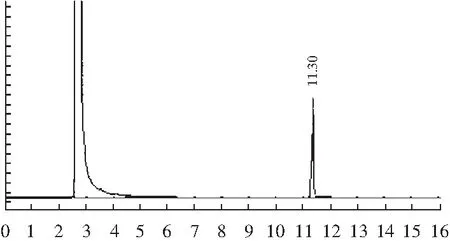
图15 40 μg/L百里香酚气相食色谱标准曲线Fig.15 The gas chromatography of 40 μg/L thymol
制备得到的芦丁标准曲线(见图12)为:Y=0.0108X-0.005(R2=0.9969);没食子酸标准曲线(见图13)为:Y=0.1122X-0.022(R2=0.9971);葡萄糖标准曲线(见图14)为:Y=0.0199X-0.0249(R2=0.9978);百里香酚(GC)标准曲线(见图15)为:Y=12519X-14535(R2=0.9993),均具有良好的线性关系。检测结果表明每1 g百里香超高压提取物中含黄酮0.189 mg、多酚0.162 mg、多糖0.085 mg、百里香酚0.134 mg。
3 结论
响应面试验优化确定百里香最佳提取条件为:压力380 MPa,乙醇浓度83%,料液比1∶42,在此条件下,相对电导率最大为15.69%±0.21%;百里香提取物对S.aureus,L.monocytogenes及E.coli菌的最低抑菌浓度(MIC)为0.188,0.375,3 mg/mL;百里香提取物处理后的细菌生长曲线变化很大,菌体数量:对照组>1/2MIC组>MIC组;百里香提取物处理后的细菌细胞膜通透性增加,A260核酸泄露量明显增加,表明百里香提取物对金黄色葡萄球菌、大肠杆菌及单增李斯特菌生长均具有一定抑制作用。检测发现每1 g百里香超高压提取物中含黄酮0.189 mg、多酚0.162 mg、多糖0.085 mg、百里香酚0.134 mg,由于百里香提取物具有良好抑菌活性,下一步将对百里香提取物的活性成分进行分离纯化,研究纯品对细菌的抑制活性和机理,更好地对百里香资源进行开发利用。
参考文献:
[1]白永亮,袁根良,杜冰,等.复合酶解结合超高压技术制备香蕉汁的工艺优化[J].农业工程学报,2013,29(2):273-279.
[2]武艳梅,陈芹芹,甘芝霖,等.超高压提取富含诺卡酮柚皮精油工艺的研究[J].高压物理学报,2013(5):785-792.
[3]凌庆枝,李晓,魏兆军,等.桑叶多糖超高压提取工艺研究[J].食品与机械,2008,24(2):50-52.
[4]王娟,央金卓嘎,黄惠华.茶树花精油超高压、超声波与微波辅助萃取工艺优化[J].食品与机械,2014,30(2):146-148.
[5]徐成,卢虹玉,章超桦,等.超高压法提取牡蛎中牛磺酸的工艺研究[J].食品工业科技,2016,37(19):192-195.
[6]付尽国,班甲,李浩洋,等.酶法辅助超高压均质技术提取裂殖壶菌油脂[J].食品科技,2017,42(4):16-19.
[7]周林燕,关云静,毕金峰,等.超高压均质技术在鲜榨果蔬汁加工中应用的研究进展[J].高压物理学报,2016,30(1):78-88.
[8]Samarasinghe Nalin,Fernando Sandun,Lacey Ronald,et al.Algal cell rupture using high pressure homogenizationas a prelude to oil extraction[J].Renewable Energy,2012,48:300-308.
[9]范金波,蔡茜彤,冯叙桥,等.牛蒡根多酚和黄酮超高压提取工艺优化及体外抗氧化活性[J].食品科学,2015,36(6):69-75.
[10]郭晓晖,方国姗,明建,等.超高压处理对草莓汁香气成分的影响[J].食品科学,2012,33(11):39-43.
[11]谭俊峰,林智,吕海鹏,等.超高压处理对茶多酚提取率和抗DPPH自由基活性的影响[J].食品科学,2009,30(18):92-95.
[12]杨小兰,袁娅,郭晓晖,等.超高压处理对不同品种猕猴桃浆多酚含量及其抗氧化活性的影响[J].食品科学,2013,34(1):73-77.
[13]赵汝能.甘肃中草药资源志(上册)[M].兰州:甘肃科学技术出版社,2004:821-823.
[14]李舂龙,贾云钗.百里香多糖提取工艺研究[J].化学世界,2016(9):549-553.
[15](宋)掌禹锡.嘉祐本草辑复本[M].北京:中医古籍出版社,2009:272.
[16](明)刘文泰.御制本草品汇精要[M].上海:上海科技出版社,2005.
[17]Anja Klancnik,Sasa Piskernik,Barbara Jersek,et al.Evaluation of diffusion and dilution methods to determine the antibacterial activity of plant extracts[J].Journal of Microbiological Methods,2010,81(2):121-126.
[18]赵淑艳,呼世斌,吴焕利,等.山茱萸提取物抑菌活性成分稳定性的研究[J].食品科学,2008,29(1):98-101.
[19]Kong M,Chen X,Liu C S,et al.Antibacterial mechanism of chitosan microspheres in a solid dispersing system againstE.colicolloids and surfaces[J].Biointerfaces,2008,65(2):197-202.
[20]冯亚净,张媛媛,王瑞鑫,等.五味子木脂素对大肠杆菌的抑菌机理及效果[J].食品与发酵工业,2016,42(2):72-76.
[21]Chen C Z,Cooper S L.Interactions between dendrimer biocides and bacterial membranes[J].Biomaterials,2002,23:3359-3368.
[22]樊明涛,陈锦屏.百里香提取物抑菌特性的研究[J].微生物学报,2001,41(4):499-504.
[23]寇文龙.百里香口含片制备工艺及初步药效研究[D].咸阳:陕西中医学院,2013.
[24]韩爱芝,蒋卉,贾清华,等.响应面试验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J].食品科学,2016,37(10):82-87.
[25]Sutaphanit P,Chitprasert P.Optimisation of microencapsulation of holy basil essential oil in gelatin by response surface methodology[J].Food Chemistry,2014,150(7):313-320.
[26]谢强,林玉桓,苗淑萍,等.香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响[J].食品工业科技,2014,35(23):54-58.
