miR-489通过打靶PAK5抑制黑色素瘤的迁移
2018-04-13郭冰玉回蔷常鹏陶凯
郭冰玉,回蔷,常鹏,陶凯
(沈阳军区总医院整形外科,沈阳 110840)
黑色素瘤是较为常见的皮肤肿瘤,虽然早期发现可以通过手术的方法进行治疗,但是黑色素瘤极易发生转移,通常发现时就已经累及多个器官,一旦发生转移患者预后极差[1-4]。
PAK5是丝氨酸/苏氨酸蛋白激酶家族的成员之一,在胰腺癌、胃癌、肠癌、乳腺癌等多种肿瘤中发挥重要作用,在黑色素瘤中也有一定的促癌作用[5]。miR-489在诸如膀胱癌、前列腺癌、乳腺癌等多种肿瘤中都被发现具有低表达的现象,体外实验[6-8]证实其可以在一定程度上抑制肿瘤细胞的生长和迁移能力,但是在黑色素瘤中鲜有报道。
本研究拟探讨miR-489通过打靶PAK5来抑制黑色素瘤的迁移功能的方式,旨在为黑色素瘤的治疗提供新的靶点。
1 材料与方法
1.1 材料
人黑色素瘤细胞系A375 (我科实验室冻存) ,DMEM培养基 (美国HyClone公司) ,胎牛血清 (天津市灏洋生物制品科技有限责任公司) ,miR-489 拟似物 (CATGAGGGCAGAAACCGATGCAA) ,miR-489抑制物 (GTTGCATCGGTTTCTGCCCTCATG) (广州锐博生物科技有限公司),台盼蓝 (上海碧云天生物技术有限公司) 。
1.2 方法
1.2.1 细胞培养:使用含10 %胎牛血清的DMEM培养基培养人黑色素瘤细胞A375,置于37 ℃ 5%CO2培养箱中。
1.2.2 荧光素酶报告基因:在使用lipo2000转染PAK5 WT和PAK5 MUT (突变PAK5与miR-489的结合位点) 后,分别将空白对照、miR-489和miR-489的反义链转染到细胞中。实验所有质粒购自上海吉玛制药有限公司。转染24 h后使用荧光素酶报告基因实验测得荧光值。
1.2.3 Transwell实验:将对数生长期细胞以1×105/孔的密度接种于Transwell小室中,终体积200 μ L,下室加入600 μ L无血清培养基,12 h后更换培养基,将细胞共分3组,分别为空白对照组,miR-489拟似物组和miR-489抑制物组,每组设3个复孔。通过lipo2000转染到细胞中。转染24 h后,棉签擦去上层细胞,95%乙醇固定20 min,0.4%台盼蓝染色20 min。200倍显微镜下观察。
1.2.4 Western blotting:不同因素处理细胞24 h后收集细胞通过裂解得到蛋白。取等量蛋白进行SDSPAGE电泳。90~110 V电泳2 h、4 ℃下100 V转膜1 h,洗膜,5 %脱脂奶粉室温封闭1 h,对应一抗4 ℃晃动孵育过夜,洗膜后二抗室温孵育1 h,洗膜后ECL发光仪发光。PAK5和GAPDH抗体以及相关二抗均购自美国SANTA公司。
1.2.5 实时PCR:不同因素处理细胞24 h后,1 mL Trizol裂解细胞,加0.2 mL氯仿,振摇15 s,室温静置2~3 min。离心15 min。吸取上层水相,加入0.5 mL异丙醇,混匀。离心10 min弃上清。加入75 %乙醇,振摇。离心5 min干燥后,用DEPC处理水溶解沉淀,55~60 ℃孵育10~15 min。将得到的RNA反转录成cDNA,进行实时PCR反应。反应程序为95℃ 10 min,95℃ 15 s,60℃ 1 min,进行40个循环。所用引物为PAK5,F (5’-3’) :TCTGGACCTCTGAGACCATG,R(5’-3’) :GTGTTCAAAGTTGGACGGGC;GAPDH,F(5’-3’) :CTCTGCTCCTCCTGTTCGAC,R (5’-3’) :GCGCCCAATACGACCAAATC。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,数据的比较采用成组设计t检验分析,P< 0.05为差异有统计学意义。
2 结果
2.1 miR-489对A375细胞迁移的影响
在A375细胞中过表达miR-489或者将miR-489下调后,使用Transwell的方法检测miR-489对A375细胞的迁移影响。结果发现,miR-489过表达后可以显著抑制A375细胞的迁移作用,反之,当miR-489下调后,A375细胞的迁移受到促进,见图1。
2.2 miR-489对PAK5的靶向作用
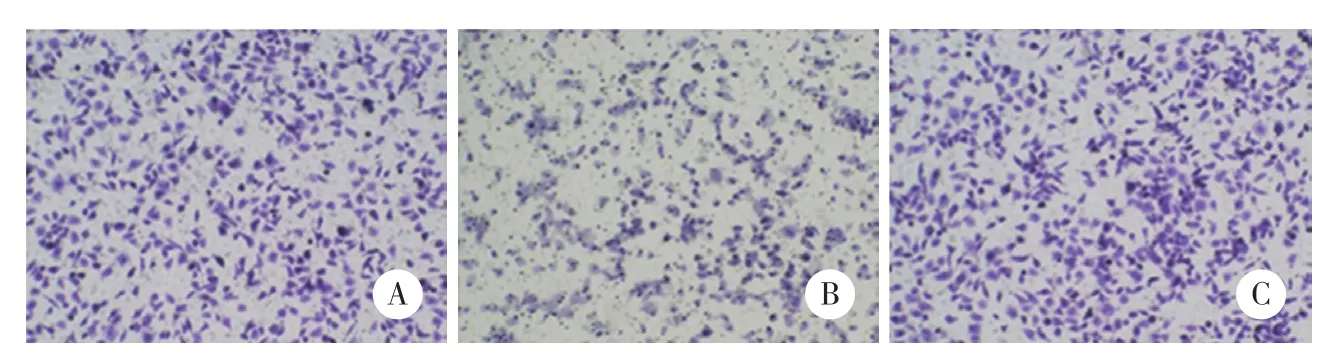
图1 miR-489对A375细胞迁移的影响 ×200Fig.1 Effect of miR-489 on migration of A375 cells ×200
通过荧光素酶报告实验证实,miR-489可以打靶A375细胞中PAK5并抑制其表达,见图2。
2.2 miR-489对PAK5的影响
在A375细胞中分别将miR-489过表达或者抑制miR-489表达24 h后,通过Western blotting检测发现,miR-489过表达可以显著抑制A375细胞中PAK5的表达,反之,当miR-489受到抑制后,PAK5的表达有所上升,见图3。
随后通过实时PCR实验检测了当miR-489过表达或受到抑制后,PAK5的mRNA水平的变化情况。结果发现,miR-489过表达可以显著抑制PAK5的表达,反之,当miR-489受到抑制后,PAK5的表达有所上升,见图4。
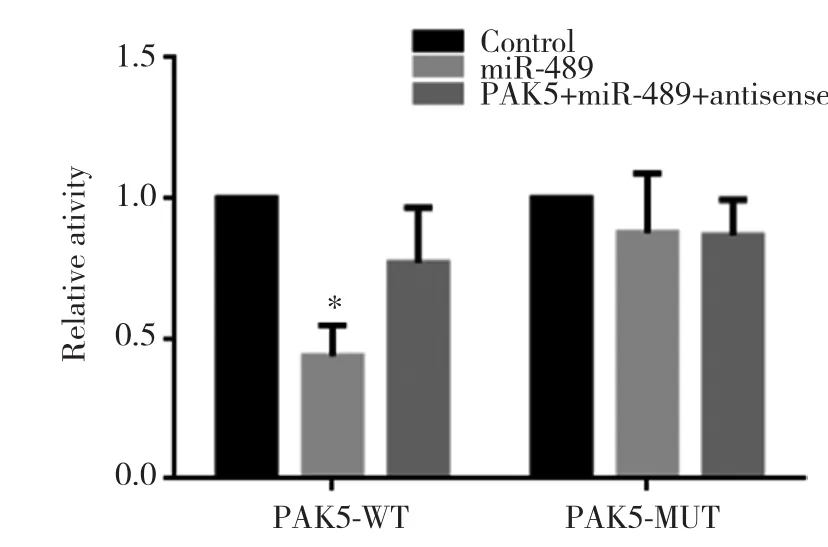
图2 miR-489可以打靶PAK5Fig.2 miR-489 can target PAK5
3 讨论
miR-489在多种肿瘤中被报道存在低表达的现象,它可以通过抑制AKT的表达来抑制卵巢癌的进程;可以通过打靶PTPN11来抑制口腔内膜癌细胞的生长迁移;也具有抑制膀胱癌、胃癌和肠癌细胞的存活与侵袭的能力。由此可见,miR-489也可能对黑色素瘤细胞的生物学功能有一定影响[7-9]。

图3 Western blotting检测miR-489对A375细胞中PAK5蛋白水平的影响Fig.3 PAK5 expression in A375 cells after treatment with miR-489 mimic /inhibitor detected by Western blotting

图4 实时 PCR检测miR-489对A375细胞PAK5 mRNA水平的影响Fig.4 PAK5 expression in A375 after treatment with miR-489 mimic /inhibitor detected by real-time PCR
PAK5在多数癌症,如结肠癌、前列腺癌以及口腔鳞状细胞癌中均有普遍的基因扩增现象存在。研究[10]发现,PAK5激酶在胃癌、肝癌、前列腺癌、黑色素瘤、胆囊癌和绒毛膜癌等多达78%的肿瘤组织或细胞中过表达。PAK5通常通过对信号通路和细胞外基质的调节与控制来实现对肿瘤细胞侵袭转移的多样化调控。在信号通路方面,PAK5可通过HGF/LIMK1/cofilin通路、MEK-1/ERK1/2/MMP2通路等来影响肿瘤细胞的侵袭迁移[10],由此可见,PAK5的靶向治疗对肿瘤的防治具有重要意义。
本研究首先发现miR-489具有抑制黑色素瘤迁移的功能,这一发现预示着miR-489可能参与黑色素瘤的发生发展,可能会成为黑色素瘤治疗的潜在靶点。随后通过荧光素酶报告基因实验证实,miR-489可以显著抑制PAK5的活性,由此推断miR-489对黑色素瘤细胞迁移功能的抑制可能在一定程度上是由于其抑制PAK5活性导致的。进一步通过蛋白水平和RNA水平的实验证实了miR-489可以显著抑制PAK5的表达。因此推断miR-489可能通过打靶PAK5来抑制黑色素瘤细胞的迁移。
本研究指出,miR-489可以通过抑制PAK5蛋白的表达来实现抑制黑色素瘤细胞迁移的作用,这为黑色素瘤的治疗提供了新的方向。
参考文献:
[1] WANG Y,OU Z,SUN Y,et al. Androgen receptor promotes melanoma metastasis via altering the miRNA-539-3p/USP13/MITF/AXL signals [J]. Oncogene,2017,36 (12) :1644-1654. DOI:10.1038/onc.2016.330.
[2] CAO HH,CHENG CY,SU T,et al. Quercetin inhibits HGF/c-Met signaling and HGF-stimulated melanoma cell migration and invasion[J]. Mol Cancer,2015,14:103. DOI:10.1186/s12943-015-0367-4.
[3] BE TU PT,NGUYEN BC,TAWATA S,et al. The serum/PDGF-dependent “melanogenic” role of the minute level of the oncogenic kinase PAK1 in melanoma cells proven by the highly sensitive kinase assay [J]. Drug Discov Ther,2017,10 (6) :314-322. DOI:10.5582/ddt.2016.01062.
[4] RUSSO A,CALTABIANO R,LONGO A,et al. Increased levels of miRNA-146a in serum and histologic samples of patients with uveal melanoma [J]. Front Pharmacol,2016,7:424. DOI:10.3389/fphar.2016.00424.
[5] NICHOLAS NS,PIPILI A,LESJAK MS,et al. PAK4 suppresses PDZ-RhoGEF activity to drive invadopodia maturation in melanoma cells [J]. Oncotarget,2016,7 (43) :70881-70897. DOI:10.18632/oncotarget.12282.
[6] KOMINA A,PALKINA N,AKSENENKO M,et al. Antiproliferative and pro-apoptotic effects of MiR-4286 inhibition in melanoma cells[J]. PLoS One,2016,11 (12) :e0168229. DOI:10.1371/journal.pone.0168229.
[7] LI J,QU W,JIANG Y,et al. miR-489 Suppresses Proliferation and invasion of human bladder cancer cells [J]. Oncol Res,2016,24 (6) :391-398. DOI:10.3727/096504016X14666990347518.
[8] WU H,XIAO Z,ZHANG H,et al. MiR-489 modulates cisplatin resistance in human ovarian cancer cells by targeting Akt3[J]. Anticancer Drugs,2014,25 (7) :799-809. DOI:10.1097/CAD.0000000000000107.
[9] KIKKWA N,HANAZAWA T,FUJIMURA L,et al. miR-489 is a tumour-suppressive miRNA target PTPN11 in hypopharyngeal squamous cell carcinoma (HSCC) [J]. Br J Cancer,2010,103 (6) :877-884. DOI:10.1038/sj.bjc.6605811.
[10] GAO J,HA BH,LOU HJ,et al. Substrate and inhibitor specificity of the typeⅡp21-activated kinase,PAK6 [J]. PLoS One,2013,8 (10) :e77818. DOI:10.1371/journal.pone.0077818.
