英夫利西单抗治疗中重度活动性克罗恩病的疗效及安全性
2018-04-13兰雨桐刘威宇邢俊伟来爽杨慧珊李虹邓秋萍刘维新
兰雨桐,刘威宇,2,邢俊伟,3,来爽,杨慧珊,李虹,邓秋萍,刘维新
(1. 中国医科大学附属第一医院消化内科,沈阳 110001;2. 辽宁省人民医院消化二科,沈阳 110013;3. 营口市中心医院消化内科,辽宁 营口115003)
克罗恩病 (Crohn’s disease,CD) 是病因和机制尚未十分明了的消化道慢性炎症反应。临床症状主要表现为腹痛、腹泻、体质量下降等,可累及口腔至肛门的全消化道任何部位,造成肠壁全层损伤,发病部位常位于末段回肠及右半结肠,合并外周关节炎、结节性红斑、肛周病变等肠外病变,部分患者以肛周病变、瘘管为首发症状。主要发病于青春后期及成年初期,男性发病率略高于女性,在中国发病率呈上升趋势。目前大多数CD患者采用糖皮质激素、免疫抑制剂等药物进行传统治疗,但大部分患者临床疗效不佳,且治疗周期长,病情缓解后仍反复发作。以往研究[1-2]表明,CD患者的肠黏膜、血液及粪便中有高于正常浓度的抗肿瘤坏死因子,在CD炎症反应的发生发展过程中起重要作用。抗肿瘤坏死因子的单克隆抗体英夫利西单抗 (infliximab,IFX)可以抑制肠道炎症反应,在国外用于CD的治疗已近20年,对活动性及瘘管型CD有明显疗效[3-5]。IFX在我国应用的时间近10年,国内也有研究探讨该药物治疗CD的效果。本研究回顾分析了42例应用传统药物疗效差或复发的CD患者应用IFX治疗的临床资料,对其症状改善、黏膜愈合及促进肛瘘闭合等方面的疗效和药物的安全性进行评估。
1 材料与方法
1.1 研究对象
选择2012年3月至2016年9月于中国医科大学附属第一医院消化内科住院治疗的42例传统药物疗效差或再次复发的活动性CD患者,均应用IFX治疗至少3次。其中男性26例,女性16例,平均年龄(28.86±11.26) 岁,合并肛瘘者7例。
1.2 纳入及排除标准
1.2.1 纳入标准: (1) 年龄15岁及以上; (2) 临床表现及内镜、病理结果均符合2012年我国炎症性肠病诊断与治疗的共识意见[6]的CD患者; (3) 传统药物(包括氨基水杨酸制剂、糖皮质激素) 规范治疗后无明显缓解或缓解后再次复发; (4) 初次治疗前CD活动指数 (CD active index,CDAI) 评分>220分。
1.2.2 排除标准: (1) 年龄<15岁; (2) 有活动性感染如结核病、肝炎及其他潜在感染患者; (3) 患有严重心脏器质性疾病、肝功异常及恶性肿瘤患者。
1.3 治疗方法
在第0、2、6周分别予患者以5 mg/kg IFX静脉滴注进行诱导治疗,之后每8周静脉滴注1次进行维持治疗,滴注前常规予抗过敏药物。
1.4 效果评定
1.4.1 CDAI评分:CDAI评分<150分为静止期,≥150分为活动期,151~220分为轻度,221~450分为中度,>450分为重度。如果患者经过治疗后CDAI评分下降≥70分或下降≥原总分的25%视为有效,CDAI下降至<150视为缓解。
1.4.2 血清学指标评价:观察患者应用IFX前以及用药后第14周、第38周血红蛋白浓度 (hemoglobin,HGB) 、血小板 (platelet,PLT) 、血沉 (erythrocyte sedimentation rate,ESR) 、C反应蛋白 (C-reactive protein,CRP) 、血清白蛋白 (serum albumin,ALB) 变化。
1.4.3 肛瘘疗效评估:根据SANDS的瘘管治疗疗效评估标准。完全缓解,瘘管消失;部分缓解,瘘管开口有所缩小或瘘管口渗出液量减少50%以上;无缓解,瘘管口未见缩小、渗出液量无明显减少或出现新发瘘管。本研究将完全缓解及部分缓解视为IFX治疗有效,并记录缓解时间。
1.4.4 肠黏膜愈合程度评估:目前CD内镜严重程度指数和CD简化评分常被用评估CD镜下严重程度。但由于本研究中肠镜检查由不同医生完成,尤其是IFX治疗前的肠镜结果来自多家医院,且有些患者当时肠道炎症较重未完成全结肠检查,难以对患者应用IFX前后的肠镜结果做出客观、准确的评分,所以本研究未对肠镜结果做出评分,但对肠镜结果给出简要说明。
1.5 药物安全性评估
观察患者在IFX治疗及随访期间发生的不良反应,从而评估药物安全性。
1.6 统计学分析
应用SPSS 22.0统计学软件进行分析,计量资料以±s表示,2组间的比较采用t检验,计数资料用频数(百分比)表示,2组间的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
42例患者中,男26例,女16例,最大年龄42岁,最小年龄15岁,平均年龄 (28.86±11.26) 岁,CDAI评分均>235分。消化道出血5例,合并肛瘘7例,2例合并类风湿性关节炎。
2.2 药物应用情况
2.2.1 IFX应用情况:根据IFX药品说明书,予5 mg/kg剂量静点,42例患者均用药至少3次,其中21例患者用药达到6次。统计治疗14周和治疗38周时的HGB、PLT、ESR、CRP、ALB及CDAI。
2.2.2 合并用药情况:IFX治疗前应用5-氨基水杨酸、激素、硫唑嘌呤的患者例数分别为38、31、4例,IFX治疗过程中合并应用5-氨基水杨酸、激素、硫唑嘌呤的患者例数分别为32、28、26例。
2.3 治疗效果评估
2.3.1 临床症状:42例患者接受IFX治疗后腹痛、腹泻、发热症状均缓解,治疗第6周后患者体温均恢复正常。治疗14周后CDAI评分由253.5±51.7下降至131.4±34.6,39例患者达到临床有效,其中34例患者达到临床缓解。5例消化道出血患者中3例好转,1例患者第14周出现下消化道大出血并行肠镜下止血后停药,1例患者第22周因着凉再发腹痛、腹泻、发热及消化道间断出血,合并肺部感染逐渐加重,出现消化道大出血,病情较危重无法耐受内镜止血及外科手术,因失血性休克死亡。21例患者应用IFX达到6次,均临床有效,CDAI评分由299.4±60.8下降至107.3±33.9,症状改善均未复发,生活质量得到明显提高。见表1。

表1 42例CD患者IFX治疗前后症状的变化[n(%) ]Tab.1 Changes in symptoms before and after treatment with infliximab in 42 patients diagnosed with Crohn’s disease[n(%) ]
2.3.2 血清学指标:42例患者经IFX治疗14周后,CRP、ESR、PLT均明显下降,ALB明显上升,差异有统计学意义 (P< 0.05) 。HGB升高,但差异无统计学意义 (P> 0.05) 。见表2。

表2 42例CD患者IFX治疗前与治疗后14周血清学指标的比较Tab.2 Changes in blood indices before and 14 weeks after treatment with infliximab in 42 patients diagnosed with Crohn’s disease
21例患者应用IFX治疗38周,治疗后CRP、PLT均明显降低,HGB、ALB均明显上升,差异均有统计学意义 (P< 0.05) 。见表3。
2.3.3 肛瘘的治疗效果:第14周时7例肛瘘患者中3例完全缓解,瘘管消失,无渗出液渗出,另外4例部分缓解,瘘管口较前缩小,渗出液也明显减少;第38周时4例部分缓解的患者中有1例完全缓解,另外3例患者应用IFX未足6次,其中1例死亡,另2例肛瘘未闭合。

表3 21例CD患者IFX治疗前与治疗后38周时血清学指标的比较Tab.3 Changes in blood indices before and 38 weeks after treatment with infliximab in 21 patients diagnosed with Crohn’s disease
2.3.4 肠黏膜愈合程度:15例患者经IFX治疗前后均行内镜检查,其中9例为结肠型,6例为小肠结肠型。15例中8例复查肠镜的时间为IFX治疗后14~38周间;另外7例患者复查的时间超过1年 (已停用IFX) 。肠镜结果提示未复发,既往溃疡病灶面积缩小、消失或被瘢痕替代,有些患者肠黏膜上见大量的炎性息肉,见图1。
2.4 安全性评价
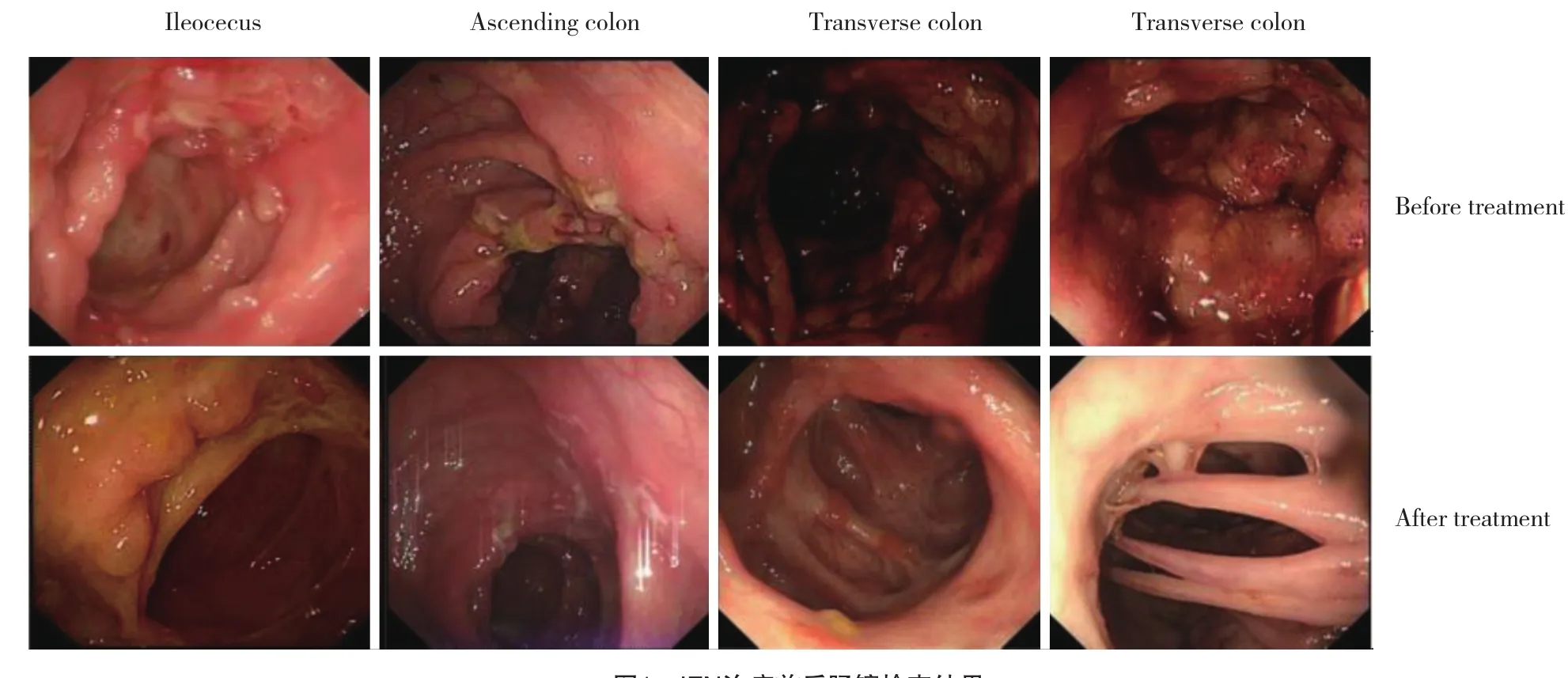
图1 IFN治疗前后肠镜检查结果Fig.1 Results of endoscopic examination performed before and 38 weeks after treatment with infliximab
42例患者在治疗过程中共发生5次不良反应。2例患者分别于第3次和第4次滴注IFX过程中出现呼吸困难、血压下降、皮疹等过敏表现,经静推肾上腺素、补液等治疗后好转。1例患者在第3次滴注IFX后出现血小板减少,遂停药,患者出院后一直口服升血小板药物对症治疗,但未对血小板缺乏的原因进一步确诊,现已随访患者13个月,化验提示血小板已升至正常。2例患者在用药期间出现了肺部感染,其中1例出现在第3次滴注IFX后,抗炎治疗后好转,另外1例在IFX治疗第5次后1个月出现消化道大出血而死亡。未观察到活动性肺结核、心衰、肝功能和肾功能损伤、神经脱髓鞘等不良反应。
3 讨论
IFX是首个经美国食品与药品管理局批准上市的抗肿瘤坏死因子α (tumor necrosis factor α,TNF-α)生物制剂,TNF-α是重要的炎性因子,主要由活化的单核—巨噬细胞及T细胞产生,可促进中性粒细胞的吞噬作用。在活动性CD患者的病变黏膜组织、血液、粪便中均发现较高浓度的TNF-α,该因子与肠黏膜的病变相关[7]。研究[8]表明,IFX除了可以与TNF-α特异性结合缓解炎症反应外,还可以修复活动期CD患者被破坏的肠道黏膜屏障,诱导单核—巨噬细胞以及T细胞的凋亡,降低肠黏膜内白细胞水平。
本研究结果显示,对于经传统药物治疗效果不佳及复发的活动性CD患者,IFX具有较好的效果,可快速缓解症状,促进病变肠黏膜愈合及瘘管的恢复。本研究中患者用药后第2天症状即可缓解,治疗第6周患者体温均恢复正常,腹痛、腹泻症状明显改善。患者治疗后14周CRP、ESR、PLT均较前下降,说明炎症程度减轻,而HGB和ALB的升高说明患者的消耗状态减轻。
有研究[9]表明IFX可以减少患者激素用量。本研究中42例患者在初次接受IFX治疗时有28例患者仍接受激素治疗,截至第14周均脱离激素治疗,且未再次应用。本研究中21例患者在应用3次IFX后因病情好转由IFX过度为硫唑嘌呤治疗,经随访得知这21例患者已应用硫唑嘌呤半年至三年余,均未复发。国外及国内均有研究[10]表明在患者接受IFX治疗期间,应用免疫抑制剂对其进行联合治疗可以取得更好的效果,且免疫抑制剂治疗CD起效缓慢,可以应用IFX使患者病情得到缓解后改为免疫抑制剂进行维持治疗。
大约1/3的CD患者合并肛周病变且需手术治疗。本研究表明,IFX治疗可以促进瘘管的闭合。而且研究总结出IFX药物剂量与瘘管愈合率呈正比[11],IFX配合肠内营养可提高瘘管愈合率[12],术后继续应用IFX可改善远期预后[13]。
本研究中7例合并肛瘘的患者经IFX治疗均有效,部分患者虽经IFX治疗,仍需进一步外科手术。有荟萃分析显示,经IFX治疗的患者手术治疗后血栓事件、败血症、吻合口瘘的风险有所增加[14]。
值得注意的是,部分CD患者对IFX的治疗反应差,即所谓的失应答,分为原发性失应答、继发性失应答及停药后再次使用失应答[15]。原发性失应答即治疗初始即无效,本研究中有3例患者治疗应用IFX第14周CDAI评分显示无效。继发性失应答是指IFX的维持治疗期间,疾病出现复发,本研究中出现消化道出血死亡的病例即可归于此类。停药后再次使用失应答指一些患者因各种原因停用IFX治疗一段时间后原本缓解的病情出现了复发,但再次使用IFX却出现失应答。有研究[16]表明以下因素提示患者对IFX具有良好的应答:年轻、不吸烟、病程短、病变局限在结肠等。
IFX疗效较确切,但安全性同样需要关注。常见不良反应有输液反应、感染、恶性肿瘤或淋巴瘤。本研究所有患者滴注IFX前均肌注地塞米松。其中有2例患者出现过敏反应,表现为面色苍白、皮疹、呼吸困难、血压下降,静推肾上腺素及补液后快速缓解。2例患者在治疗期间出现肺部感染,1例抗炎治疗后好转,1例死亡。随访期内未发现恶性肿瘤发病。1例患者治疗期间出现血小板减少而停药,是否与IFX相关尚不能证实。
综上,应用IFX治疗中重度CD疗效确切,不良反应少,安全性高。但仍需进一步长期随访以明确远期疗效和并发症的发生。
参考文献:
[1] DING NS,HART A,DE CRUZ P. Systematic review:predicting and optimising response to anti-TNF therapy in Crohn’s disease-algorithm for practical management [J]. Aliment Pharmacol Ther,2016,43 (1) :30-51. DOI:10.1111/apt.13445.
[2] NICHOLLS S,STEPHENS S,BRAEGGER CP,et al. Cytokines in stools of children with inflammatory bowel disease or infective diarrhea [J]. J Clin Pathol,1993,46 (8) :757-760.
[3] SCHNITZLER F,FIDDER H,FERRANTE M,et al. Long-term outcome of treatment with infliximab in 614 patients with Crohn’s disease:results from a single-centre cohort [J]. Gut,2009,58 (4) :492-500. DOI:10.1136/gut.2008.155812.
[4] RICART E,PANACCIONE R,LOFTUS EV,et al. Infliximab for Crohn’s disease in clinical practice at the Mayo Clinic:the first 100 patients [J]. Am J Gastroenterol,2001,96 (3) :722-729.
[5] KONSTANTINOS P,CHEIFETZ AS. Defining and predicting deep remission in patients with perianal fistulizing Crohn’s disease on anti-tumor necrosis factor therapy [J]. World J Gastroenterol,2017,23(34) :6197-6200. DOI:10.3748/wjg.v23.i34.6197.
[6] 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见 (2012年·广州) [J]. 中华内科杂志,2012,51 (10):818-831.
[7] 刘占举. 英夫利西单抗治疗克罗恩病的作用机制[J]. 中华内科杂志,2013,52 (12) :1065-1067.
[8] SEMINERIO JL,LOFTUS EV JR,COLOMBEL JF,et al. Infliximab for Crohn’s disease:the first 500 patients followed up through 2009[J]. Dig Dis Sci,2013,58 (3) :797-806. DOI:10.1007/s10620-012-2405-z.
[9] CAVIGLIA R,RIBOLSI M,RIZZI M,et al. Maintenance of remission with infliximab in inflammatory bowel disease:efficacy and safety long-term follow-up [J]. World J Gastroenterol,2007,13 (39) :5238-5244.
[10] 王智云,郑柳,张明红. 英夫利西单抗与硫唑嘌呤联用治疗克罗恩病临床疗效观察[J]. 实用临床医药杂志,2014,18 (1) :75-78.
[11]YARUR AJ,KANAGALA V,STEIN DJ,et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease [J]. Aliment Pharmacol Ther,2017,45 (7) :933-940. DOI:10.1111/apt.13970.
[12] WU XL,CHEN RP,TAO LP,et al. Infliximab combined with enteral nutrition for managing Crohn’s disease complicated with intestinal fistulas [J]. Gastroenterol Res Pract,2016,2016:5947926.
[13] YANG BL,CHEN YG,GU YF,et al. Long-term outcome of infliximab combined with surgery for perianal fistulizing Crohn’s disease[J]. World J Gastroenterol,2015,21 (8) :2475-2482. DOI:10.3748/wjg.v21.i8.2475.
[14] EHTESHAMI-AFSHAR S,NIKFAR S,REZAIE A,et al. A systematic review and meta-analysis of the effects of infliximab on the rate of colectomy and post-operative complications in patients with inflammatory bowel disease [J]. Arch Med Sci,2011,7 (6) :1000-1012. DOI:10.5114/aoms.2011.26612.
[15] 刘爱玲,吕红,钱家鸣. 英夫利西单抗治疗炎症性肠病失应答[J].协和医学杂志,2015,6 (2) :140-145.
[16] STEENHOLDT C,PALARASAH Y,BENDTZEN K,et al. Pre-existing IgG antibodies cross-reacting with the Fab region of infliximab predict efficacy and safety of infliximab therapy in inflammatory bowel disease [J]. Aliment Pharmacol Ther,2013,37 (12) :1172-1183. DOI:10.1111/apt.12330.
