月经状态对乳腺纤维腺体组织与背景实质强化的影响
2018-04-12胡晓欣顾雅佳彭卫军
胡晓欣 顾雅佳 姜 娈 李 强 尤 超 毛 健 彭卫军
(1复旦大学附属肿瘤医院放射诊断科 上海 200032; 2复旦大学上海医学院肿瘤学系 上海 200032;3中国科学院上海高等研究院高端医学影像技术研究中心 上海 201210)
在乳腺MR影像(T1非压脂序列)上,白色区域代表了脂肪组织,黑色区域为纤维腺体组织(fibrograndular tissue,FGT),FGT被证明与乳腺X线密度有高度的相关性[1-3],而后者与乳腺癌风险相关[4-5]。MR影像不仅能对FGT进行分析,增强前后的比对还能显示腺体纤维组织的血供状况,这一现象被称为背景实质强化(background parenchymal enhancement,BPE)。BPE是乳腺组织的正常表现,绝经前后均会出现。近期有研究发现BPE是一个比FGT更强的乳腺癌风险预测值,背景中度强化或显著强化对比极少强化或轻度强化的优势比(OR值)为10.1,明显优于乳腺X线密度分析的优势比(OR=4.7),说明BPE是一个与乳腺癌风险联系更强的风险因子[6]。
FGT和BPE不仅与乳腺癌风险相关,还与人体的激素水平相关。较早的研究发现FGT和BPE的变化与激素水平相关,特别是雌激素和孕激素,并受年龄、月经状况、月经周期、他莫西芬和芳香化酶抑制剂(aromatase inhibitors,AI)以及激素替代疗法的影响[7-12]。只有掌握了FGT和BPE随月经变化的规律才能更准确地对乳腺癌风险进行评估。另外对于影像诊断来说,BPE是一个对诊断有一定干扰的影像学表现。有研究表明BPE会降低乳腺MR影像的特异性,并增加MR检查的召回率[13]。如果能了解BPE在不同月经状态下的变化规律,选择最佳的MR检查时间,可能降低BPE对诊断的干扰并提高诊断效能。
就FGT及BPE的评估方法而言,以往的研究[7-12]均为主观目测法,医师间的一致性较差,如果可以对它们进行量化,则无论是在观察者之间,还是在研究人群间,均可以获得更准确、客观并且可重复的评估数据。因此,我们根据美国放射学会(American Collage of Radiology,ACR)的标准研发了一款全自动量化软件,来评估正常妇女不同月经状态对FGT与BPE的影响,其中BPE由以下两个方面予以表达:BPE容积比(BPE volume ratio,BPEV)和BPE程度比(BPE intensity ratio,BPEI)。
资 料 和 方 法
研究对象从2009年至2012年在复旦大学附属肿瘤医院做乳腺MR检查的14 033名女性中,筛选出乳腺MR检查正常、并且随后连续2年每年1次或乳腺MR检查或乳腺X线或超声检查正常者101人。其中绝经前47人,平均年龄41(24~53)岁;绝经后54人,平均年龄56 (46~78)岁。绝经前再按月经周期分为4组:月经第1周(月经第1~7天) 8人,平均年龄43(31~53)岁;第2周(月经8~14天)13人,平均年龄39(24~50)岁;第3周(月经15~21天)13人,平均年龄41 (27~49)岁;第4周(第22天至下次月经)13人,平均年龄38(29~49)岁;各组之间年龄差异无统计学意义(P>0.05)。所有入组妇女均未接受过内分泌治疗或激素替代疗法。
MR影像数据的获得由专门的乳腺MR技师使用Aurora 1.5T专用乳腺磁共振扫描仪(美国Aurora公司)及乳腺专用线圈完成扫描。患者取俯卧位,使双乳自然下垂,扫描范围包括双侧乳腺及腋窝区。MR增强对比剂采用Gd-DTPA,剂量为0.2 mmol/kg,采用高压注射器经手背静脉注入,流率为2.0 mL/s,其后以同样流率注入15 mL 0.9%NaCl溶液冲洗管内残留的Gd-DTPA。扫描序列包括三平面定位,T2权重压脂序列,T1权重不压脂序列。随后在T1权重压脂序列上完成平扫与增强扫描,注入对比剂后连续无间隔采集3个时相,分别代表增强早期、中期、晚期,每个时相扫描时间约为2 min,增强后总扫描时间约为6 min。所有扫描序列均在横断位上施行,扫描参数见表1。
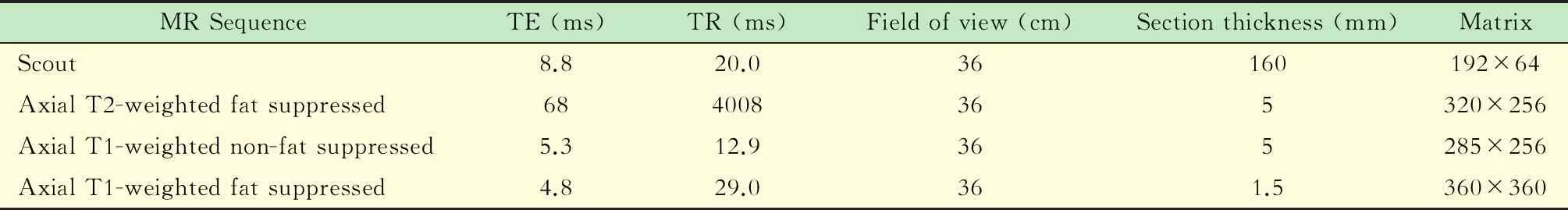
表1 1.5T乳腺专用MR扫描参数Tab 1 Scanning parameters of 1.5T dedicated breast MR systems
TE:Echo time;TR:Repetition time.
MR影像数据的分析我们研发了一款全自动量化软件来评估乳腺的FGT及BPE[14]。在乳腺磁共振图像中依据乳头、胸肌及乳房皮肤相关的特征点位置确定乳房相应的初始感兴趣区域。基于初始感兴趣区域的位置,实现乳房与胸壁线的全自动分割,然后根据提取的感兴趣区域确定的位置,结合脂肪组织和纤维腺体组织在磁共振图像中的三维灰度、梯度和形状特征信息,实现纤维腺体组织和乳房内脂肪组织的三维全自动分割;接下来采用非刚体配准算法实现注入造影剂前后磁共振图像序列的配准,进而计算注入造影剂前后磁共振图像序列的差值图像,在差值图像中分割出增强的纤维腺体组织(图1)。最后基于已分割的纤维腺体组织和乳房内脂肪组织,量化分析获得纤维腺体组织体积和乳房体积的百分比例,即纤维腺体组织比(fibroglandular tissue ratio,FGT)。
FGT=VFibroglandular tissue/Vbreast×100%
基于增强的纤维腺体组织的位置及其增强灰度值,量化分析获得强化的纤维腺体组织体积与总的纤维腺体组织体积的百分比例,即BPEV。
BPEV=VReinforced fibroglandular tissue/VTotal fibroglandular tissue×100%
基于纤维腺体组织增强前后的信号差值与增强前纤维腺体组织的信号值,量化分析获得增强前后纤维腺体组织的信号差值与增强前纤维腺体组织的信号值的百分比值,即BPEI。S1为增强后纤维腺体组织的信号值,S0为增强前纤维腺体组织的信号值。
BPEI=(S1-S0)/S0×100%
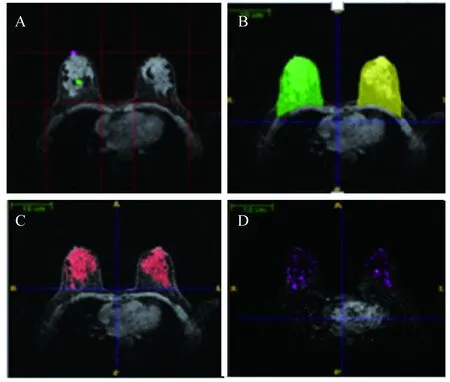
A:Volume of interest (VOI) of breasts;B:Whole breast segmentation (green for the right breast and yellow for the left breast);C:Fibroglandular tissue segmentation (red);D:Enhanced fibroglandular tissue segmentation (pink).
图1BPER测量流程图
Fig1BPERmeasurementflowchart
统计学方法所有统计学检验均使用SPSS 16.0软件。测量双侧乳房并求得平均值后使用Mann-Whitney U检验对绝经前后的FGT、BPEV和BPEI进行比较。绝经前各月经周期的FGT、BPEV和BPEI比较采用Kruskal-Wallis检验。
结 果
绝经前后FGT、BPEV和BPEI的比较绝经后FGT、BPEV和BPEI均较绝经前有显著下降(表2,图2)。其中,FGT从17.3%降至8% (P<0.001)。BPEV增强后各期均下降了1/3左右(P<0.001)。BPEI在增强中晚期也有显著下降(P<0.05),而增强早期下降不明显(P=0.058)。BPEV及BPEI在增强早期最低,增强晚期最高,其强化效率随增强后的时间延长而升高(图2)。
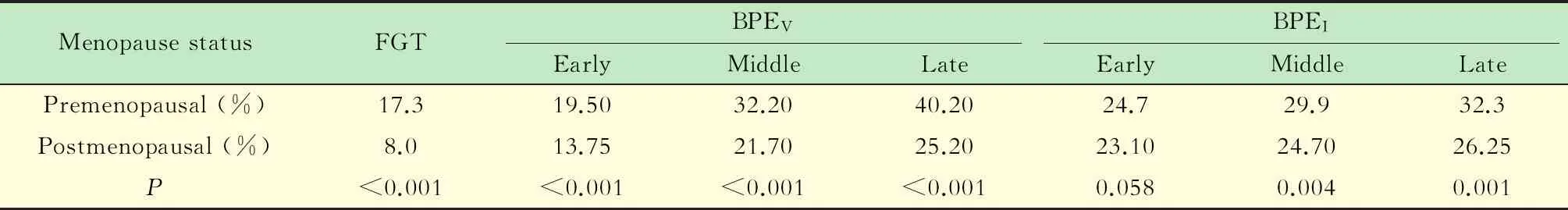
表2 绝经前后的FGT、BPEV和BPEI比较Tab 2 Comparison of premenopausal and postmenopausal FGT,BPEV and BPEI
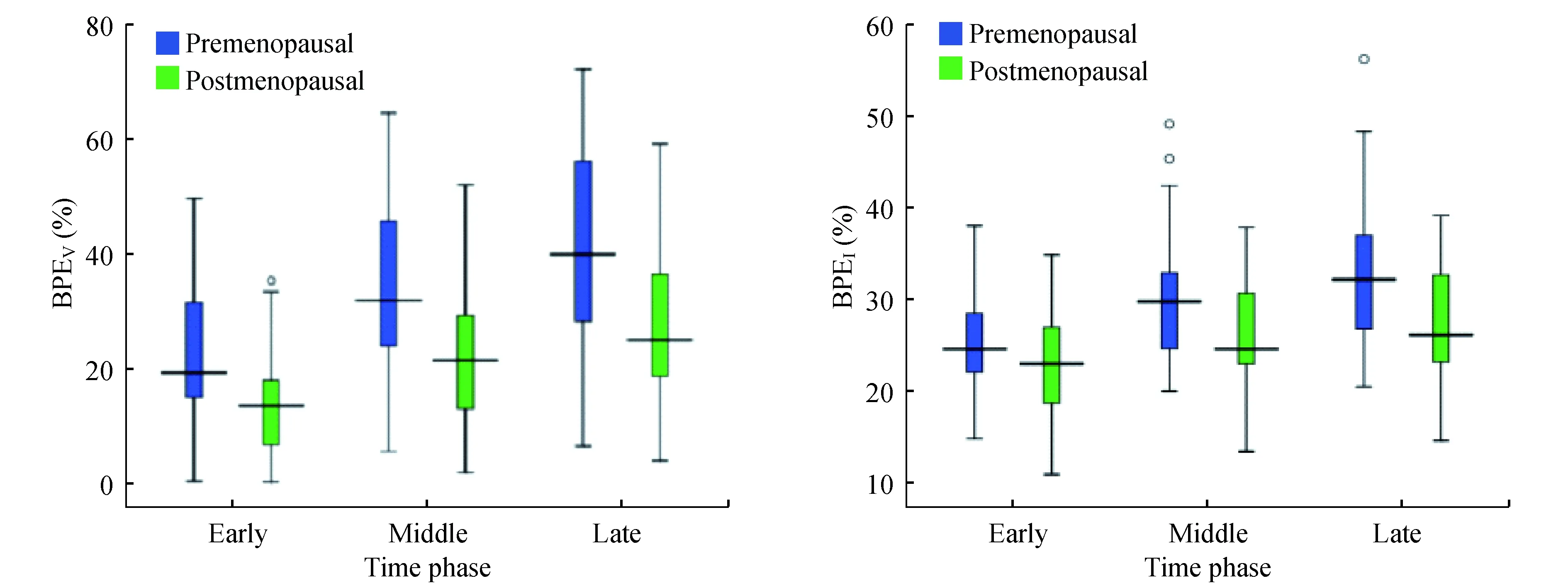
BPEVand BPEIdecreased after menopause.They increased with increasing enhanced time.
图2绝经前后的BPEV及BPEI比较
Fig2ComparisonofBPEVandBPEIbetweenpremenopausalandpostmenopausalstatus
各月经周期FGT、BPEV和BPEI的比较月经第1周的BPEI最高,第2周的最低,第3及第4周逐步升高(图3)。其中第1周与第2周的BPEI有显著差异(P<0.05)。FGT与BPEV在月经第1周也最高,第2~4周相对较低,但差异无统计学意义(表3)。
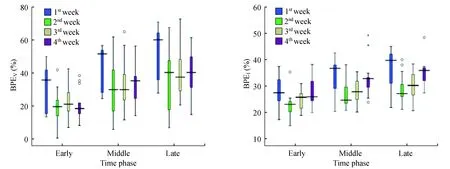
The maximum BPEIwas in the 1stweek,the minimum in the 2ndweek,and escalated in the 3rdand 4thweek.The BPEVand BPEIincreased with increasing enhanced time.
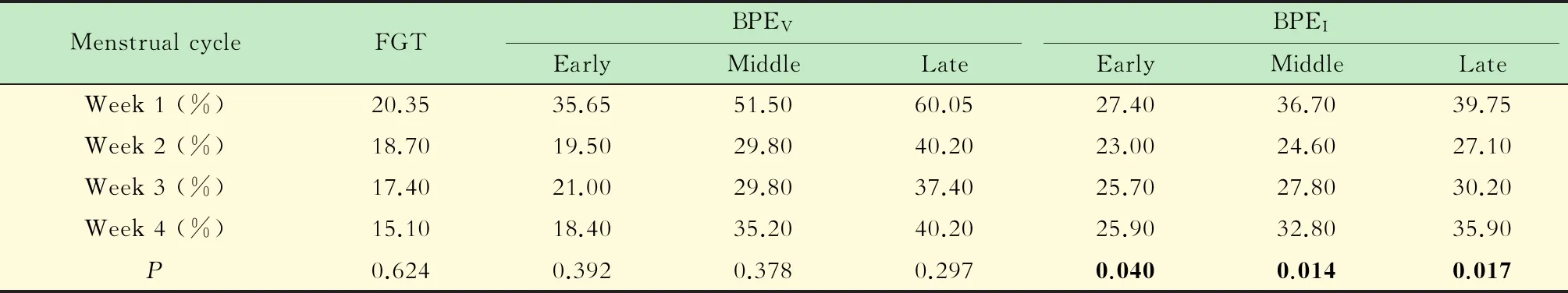
图3 各月经周期的BPEV及BPEI比较Fig 3 Comparison of BPEV and BPEI among each week of the menstrual cycle
讨 论
近年来有报道显示乳腺腺体密度与乳腺癌密切相关,密度≥75%对<10%的风险优势比(odds ratio,OR)达4.7[4-5]。2011年,King等[6]通过磁共振背景实质强化程度(目测四分法)来评估乳腺癌的风险程度,结果发现背景中度强化或显著强化对极少强化或轻度强化的OR值为10.1,明显优于MRI乳腺密度测量的值(OR=4.7),说明磁共振背景强化对乳腺上皮血供评估是一个与乳腺癌风险联系更强的风险因子。但Ablert等[15]的研究却得出了完全相反的结论,发现BPE在高危人群中反而较乳腺癌人群更高,认为BPE是一种影像特征而非风险预测因子。我们发现以上这些研究[6,15-18]均未充分考虑到月经状况对FGT及BPE的影响。先前基于病理标本或动物模型的研究证实乳腺纤维腺体组织随月经周期不同阶段而发生相应的变化[19-20]。如果在FGT或BPE与乳腺癌风险的相关性研究中不能掌握好月经状况的影响,那么研究就必然会出现偏向性,甚至得出完全相反的结论。
因此,本研究利用乳腺MR影像全自动量化分析法来评估妇女不同月经状态对乳腺纤维腺体组织的影响。结果发现,FGT,BPEV及BPEI在绝经后显著下降。在绝经前妇女中月经第1周的BPEI最高,第2周的最低。FGT及BPEV在整个月经周期中的波动无显著差异。
绝经后BPEV在增强早期就出现了显著下降,而BPEI在增强早期下降较小。这可能是由于增强早期造影剂主要留存于血管中,此时的BPEI由注入血管内的造影剂剂量所构成,主要反映造影剂在血液中的浓度,受受检者心脏输出量的影响。而进入增强中晚期,造影剂已渗透入腺体组织中,此时的BPEI则反映组织的摄取量。
以往对不同月经周期中BPE变化的研究[21-22]发现月经第2~3周(月经第8~21天)的BPE显著低于月经第4到第1周(月经第22天到下次月经第7天)。研究者认为月经第2周是接受乳腺MR检查的最佳时间,我们的研究也支持这一观点。在月经第2周正常乳腺组织较低的BPEI能将高摄取的病灶凸现出来,提高病变的检出率。而月经第1周BPEV与BPEI最高,病灶会被大范围高强化的腺体组织所遮挡,不利于病灶的检出。
本研究有一定的局限性。(1)绝经前各月经周期的样本量较少。由于磁共振对乳腺癌的筛查尚未推广,正常人群行乳腺MR检查的人数相对较少。虽然我们收集了14 033名女性的MR资料,但最终符合要求的正常人群仅101例。(2)MR动态增强扫描的时间分辨率较低(2 min),扫描期相相对较少。如果能增加增强后扫描次数,缩短扫描间隔,提高时间分辨率可能获得更多更早期的乳腺纤维腺体组织强化数据和变化规律。(3)本研究中应用的BPE测量软件还没有商业化,必须在特定的工作站上运行,目前还不能被广泛地应用。
我们的研究发现绝经后FGT、BPEV及BPEI显著下降。在一个月经周期中,第1周的BPEI最高,第2周最低。这一结果提示我们将来在对BPE或FGT与乳腺癌风险的研究中必须控制月经状况对研究的影响,特别是绝经状况,以避免不同的月经状态对研究产生的偏向性。为了避免高背景强化对诊断的影响,我们认为应尽量避免在月经第1周进行乳腺MR检查,最佳的检查时间应为月经第2周。
[1]WEI J,CHAN HP,HELVIE MA,etal.Correlation between mammographic density and volumetric fibroglandular tissue estimated on breast MR images [J].MedPhys,2004,31(4):933-942.
[2]NIE K,CHEN JH,CHAN S,etal.Development of a quantitative method for analysis of breast density based on three-dimensional breast MRI[J].MedPhys,2008,35(12):5253-5262.
[3]NIE K,CHANG D,CHEN JH,etal.Quantitative analysis of breast parenchymal patterns using 3D fibroglandular tissues segmented based on MRI[J].MedPhys,2010,37(1):217-226.
[4]BOYD NF,GUO H,MARTIN LJ,etal.Mammographic density and the risk and detection of breast cancer[J].NEnglJMed,2007,356(3):227-236.
[5]CUMMINGS SR,TICE JA,BAUER S,etal.Prevention of breast cancer in postmenopausal women:approaches to estimating and reducing risk [J].JNatlCancerInst, 2009,101(6):384-398.
[6]KING V,BROOKS JD,BERNSTEIN JL,etal.Background parenchymal enhancement at breast MR imaging and breast cancer risk [J].Radiology,2011,260(1):50-60.
[7]KAJIHARA M,GOTO M,HIRAYAMA Y,etal.Effect of the menstrual cycle on background parenchymal enhancement in breast MR imaging[J].MagnResonMedSci,2013,25,12(1):39-45.
[8]DEMARTINI WB,LIU F,PEACOCK S,etal.Background parenchymal enhancement on breast MRI:impact on diagnostic performance[J].AJRAmJRoentgenol,2012,198(4):W373-W380.
[9]KING V,GU Y,KAPLAN JB,etal.Impact of menopausal status on background parenchymal enhancement andbroglandular tissue on breast MRI [J].EurRadiol,2012,22(12):2641-2647.
[10]DELILLE JP,SLANETZ PJ,YEH ED,etal.Physiologic changes in breast magnetic resonance imaging during the menstrual cycle:perfusion imaging,signal enhancement,and influence of the T1 relaxation time of breast tissue[J].BreastJ,2005,11(4):236-241.
[11]KING V,KAPLAN J,PIKE MC,etal.Impact of tamoxifen on amount of fibroglandular tissue,background parenchymal enhancement,and cysts on breast magnetic resonance imaging [J].BreastJ,2012,18(6):527-534.
[12]KING V,GOLDFARB SB,BROOKS JD,etal.Effect of aromatase inhibitors on background parenchymal enhancement and amount of fibroglandular tissue at breast MR imaging [J].Radiology,2012,264(3):670-678.
[13]HAMBLY NM,LIBMAN L,DERSHAW DD,etal.Background parenchymal enhancement on baseline screening breast MRI:impact on biopsy rate and short-interval follow-up[J].AJRAmJRoentgenol,2011,196(1):218-224.
[14]JIANG L,HU X,XIAO Q,etal.Fully automated segmentation of whole breast using dynamic programming in dynamic contrast enhanced MR images [J].MedPhys,2017,44(6):2400-2414.
[15]ALBERT M,SCHNABEL F,CHUN J,etal.The relationship of breast density in mammography and magnetic resonance imaging in high-risk women and women with breast cancer[J].ClinImaging,2015,39(6):987-992.
[16]DONTCHOS BN,RAHBAR H,PARTRIDGE SC,etal.Are qualitative assessments of background parenchymal enhancement,amount of fibroglandular tissue on mr images,and mammographic density associated with breast cancer risk?[J].Radiology,2015,276(2):371-380.
[17]BARBARA BB,MATTHIAS D,PASCAL AB,etal.MRI background parenchymal enhancement is not associated with breast cancer [J].PLoSOne,2016,11(7):e0158573.
[18]SHANDONG W,WENDIE AB,MARGARITA LZ,etal.Breast MRI contrast enhancement kinetics of normal parenchyma correlate with presence ofbreast cancer[J].BreastCancerRes,2016,18(1):76.
[19]VOGEL PM,GEORGIADE NG,FETTER BF,etal.The correlation of histologic changes in the human breast with the menstrual cycle [J].AmJPathol,1981,104(1):23-34.
[20]POTTEN CS,WATSON RJ,WILLIAMS GT,etal.The effect of age and menstrual cycle upon proliferative activity of the normal human breast [J].BrJCancer,1988,58(2):163-170.
[21]KUHL CK,BIELING HB,GIESEKE J,etal.Healthy premenopausal breast parenchyma in dynamic contrast-enhanced MR imaging of the breast:normal contrast medium enhancement and cyclical phase dependency[J].Radiology,1997,203(1):137-144.
[22]KANG SS,KO EY,HAN BK,etal.Background parenchymal enhancement on breast MRI:influence of menstrual cycle and breastcomposition [J].JMagnResonImaging,2014,39(3):526-534.
