心脏死亡器官捐献肾移植术后肾功能延迟恢复的免疫抑制剂选择
2018-04-12周异群综述朱玉娴朱同玉审校
周异群(综述) 朱玉娴 朱同玉(审校)
(1上海罗氏制药有限公司 上海 201102; 2复旦大学附属中山医院泌尿外科 上海 200032)
肾移植术后,移植物功能延迟恢复(delayed graft function,DGF)可伴随急性排斥反应和慢性移植肾肾病发生,是移植物存活的主要障碍[1]。尸体供肾移植(deceased donor kidney transplant,DDKT)受者DGF发生率约50%。与脑死亡器官捐献(donation after brain death,DBD)相比,心脏死亡器官捐献 (donation after cardiac death,DCD)肾移植受者DGF和原发性无功能 (primary nonfunction,PNF)的发生率增加5.73倍,其主要原因是DCD供肾增加热缺血和冷缺血时间[2-3]。 DCD供肾热缺血时间<45 min有利于维持移植肾的长期功能,相比DBD供肾,再灌注损伤也是引发DCD供肾移植受者DGF和PNF的重要原因。而宿主炎症反应是持续性再灌注损伤的基础[3]。
为了预防缺血再灌注损伤(ischemia-reperfusion injury,IRI)和降低DGF的发生率,通常采用免疫抑制疗法来抑制免疫反应。免疫应答引起的缺血再灌注是造成DGF的主要原因。鉴于DCD供肾的DGF发生率高,尤其应重视降低早期排斥反应发生率。一些学者主张在DCD供肾移植中使用强效免疫抑制剂治疗,使移植物在DGF期间免于免疫损伤,且避免使用钙调神经磷酸酶抑制剂(calcineurin inhibitor,CNI)[4]。对DGF患者进行常规诱导治疗可预防早期排斥反应,有效的诱导治疗也可能减少初始缺血再灌注损伤。因此,白细胞IL-2受体拮抗剂(IL-2 receptor antagonists,IL-2RA)与抗胸腺细胞球蛋白(anti-thymocyte globulin,ATG)诱导治疗在1997—2002年间飙升了3倍[5]。免疫抑制疗法分为诱导治疗和维持治疗两部分。移植时,对于免疫高风险受者,诱导治疗可抑制移植排斥反应中抗原的识别和T细胞的激活[6]。免疫抑制剂诱导治疗通过抑制白细胞富集导致的血管充血以及内皮细胞损伤来降低DGF的发生率[3]。有研究显示未进行诱导治疗组DGF的发生率显著高于使用诱导治疗组[3]。目前使用较多的诱导治疗药物包括:ATG;(巴利昔单抗和赛尼哌),非T细胞耗竭性单克隆抗体,阻断IL-2受体(anti-CD52)。
诱导治疗T-淋巴细胞清除可以逆转缺血再灌注对慢性移植物失功的影响,尤其是在DGF高风险患者中,使用多克隆抗体使T淋巴细胞耗竭,可预防或降低缺血再灌注的作用和改善DGF[7-9]。常用的多克隆抗体有ATG,它有剂量依赖性耗竭T细胞的作用,同时具有剂量依赖性不良反应。
在一项前瞻性、随机的临床试验研究中,Goggins等[10]比较了ATG在术中和术后的使用对尸体供肾移植受者DGF的影响,结果表明,在血管重建之前使用ATG显著降低DGF的发生率。Noel等[11]在一项纳入227例HLA 致敏高风险肾移植受者的研究中发现,使用ATG组的DGF发生率显著低于使用达利珠单抗 (31.5%vs.44.6%,P=0.044) 。但是,Brennan等[12]研究表明,在延长冷缺血时间致组织损伤的高风险人群中,应用ATG并未降低DGF发生率。Requiao-Moura等[8]也发现在移植术中使用ATG未能预防DGF的发生。
尽管以上研究存在争论,但使用ATG诱导治疗DGF高危患者是合理的,因为急性排斥反应在这个亚群中发生率更高[13]。但同时ATG与强效免疫抑制治疗缺陷相关。使用ATG导致的感染并发症较为常见,最常见的是巨细胞病毒(cytomegalovirus,CMV)感染。有研究表明,ATG使用导致的CMV感染率是对照组的3.4倍[8]。
因此,为开发既能阻断T细胞增殖,又不消耗T淋巴细胞且不良反应小的抗体,已经进行了多方努力。单克隆抗体(如IL-2RA)由于其强效的高靶向性免疫抑制和最小的不良反应,已被证明具有较优的早期治疗效果[14-15]。
淋巴细胞的增殖起始于IL-2/IL-2R途径与CD25分子在淋巴细胞中选择性表达,这就表明CD25抑制剂可以降低缺血再灌注的发生率[15]。在移植标准风险人群中,IL-2RA与多克隆抗淋巴细胞抗体具有同等疗效[16]。Peng 等[17]进行了一项回顾性队列研究,旨在评估IL-2RA与ATG诱导治疗在DCD肾移植受者中的疗效和安全性。结果表明,两组DGF发生率无显著性差异,但术后6个月时,IL-2RA组的感染发生率显著低于ATG诱导治疗组(P=0.025)。Lebranchu等[15]进行了一项随机的单中心研究,旨在比较巴利昔单抗与抗胸腺细胞球蛋白诱导治疗在疗效和安全性方面的优劣,结果表明,两组DGF和急性排斥反应发生率相当,但巴利昔单抗组CMV感染发生率显著降低(P=0.005)。尽管近些年来ATG使用飙升,但其在降低低免疫风险肾移植受者的移植物失功率、DGF发生率以及提高受者存活率上并没有优势。表1比较了IL-2RA诱导治疗或透析与抗胸腺细胞球蛋白治疗的DGF发生风险。
欧洲和美国的专家建议,在治疗高免疫风险的患者时选用以淋巴细胞为靶向治疗目标的多克隆抗体,在治疗低免疫风险的患者时,选用以IL-2/IL-2R为靶向治疗目标的单克隆抗体[12,19-21]。因此,一些移植中心开始着手在诱导治疗前对肾移植患者的风险进行分层,鉴于DCD供肾移植受者DGF发生风险高的特点,风险分层模型对预测DGF发生是有益的。接受DCD供肾的受者发生DGF的风险高,但有些学者认为不能将DGF发生率高仅仅归因于DCD。Schadde等[22]定义高风险的标准包括群体反应性抗体(panel reactive antibodies,PRA)>20,非裔美国人肾移植。2012年Foster等[23]研究表明,成人尸体供肾移植受者被认为是高风险人群,被定义为进行DCD供肾移植,冷缺血时间>24 h,非裔美国人,PRA>20%,或者经历再次移植;低风险人群定义为本地供者,冷缺血时间<24 h,非-非裔美国人,以及PRA<20%。
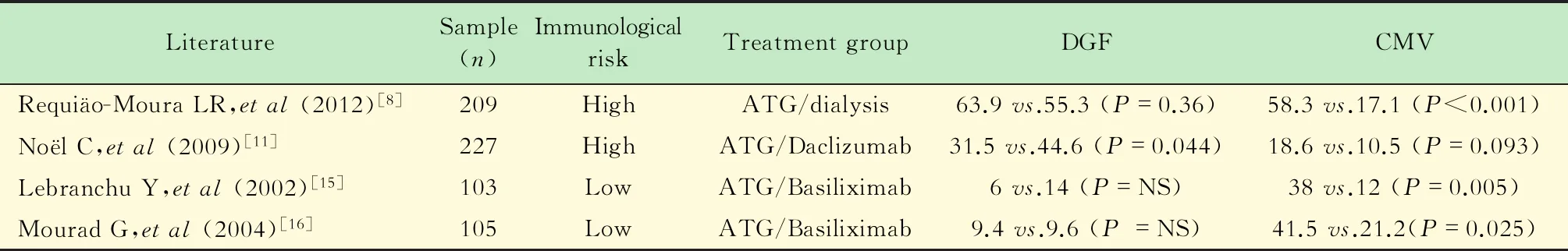
表1 尸体肾移植受者接受ATG,IL-2RA或透析等不同治疗方案的治疗效果Tab 1 Treatment effect of ATG,IL-2RA or dialysis on cadaver kidney transplant recipients
DGF:Delayed graft fuction;CMV:Cytomegalovirus;NS:No significance.
维持免疫抑制方案维持治疗方案旨在长期抑制急性排斥反应,防止移植物功能的恶化。为了有效抑制急性排斥反应,目前常用激素+MMF+CNIs三联方案[24]。但CNIs具有肾毒性,而DGF患者本身存在肾功能不全的情况,CNIs可能会延长DGF的修复时间,一般可采取延迟给药方案或减量使用[25-26]。英国器官移植学会指南指出[27],诱导治疗联合CNIs延迟/减量可能减少DGF的发生或缩短DGF持续时间。但是,CNI延迟或减量会增加急性排斥反应的发生风险,Gaynor等[28]分析术后1年的Tac水平与活检证实的急性排斥反应(biopsy-proven acute rejection,BPAR)的关系,研究显示,低Tac水平与BPAR的发生率高显著相关,估算的风险比为6.33。 Sawinski等[29]的一项Meta分析显示:与MMF+CNI维持治疗相比,MMF+CNI撤除增加BPAR发生风险。因此延迟/减量使用CNIs可减少DGF的发生,但也会增加BPAR的发生风险。
SRL对DGF的治疗作用尚存争议,Tahir等[38]对SRL的治疗作用进行了研究,8例ECD患者使用Tac+MMF±激素治疗无效,DGF持续时间延长(42.3±38.3)天,移植后(46.5±20.6)天转换为SRL+MMF±激素治疗,结果显示,SRL可改善患者肾功能。但也有研究显示SRL治疗与DGF显著相关,显著延长DGF的持续时间(P=0.01)[39-40]。因此,SRL对DGF的预防作用还有待进一步证实。
结语由于DCD供体肾移植引起DGF比较常见,免疫抑制剂降低早期排斥反应受到重视。由于DGF的发生率和肾移植受者风险的不同,免疫抑制剂方案也需相应调整。目前临床应对DGF高发生率,通常是给予CNI减量延迟方案,同时加强其他免疫抑制剂,如生物制剂及MPA类药物。需要注意的是,DGF的状态下,MPA类药物AUC比无DGF受者更低,此时MPA类药物的剂量更难以把握,因此,在临床实践中,需加强MPA类药物浓度监测以达到降低移植物排斥的风险。
[2]AKOH JA.Kidney donation after cardiac death[J].WorldJNephrol,2012,1(3):79-91.
[3]SIEDLECKI A,IRISH W,BRENNAN DC.Delayed graft function in the kidney transplant[J].AmJTransplant,2011,11(11):2279-2296.
[4]JOHNSON C,AHSAN N,GONWA T.Randomized trial of tacrolimus (Prograf) in combination with azathioprine or mycophenolate mofetil versus cyclosporine (Neoral) with mycophenolate mofetil after cadaveric kidney transplantation[J].Transplantation,2000,69(5):834-841.
[5]BUNNAPRADIST S,TAKEMOTO SK.Multivariate analyses of antibody induction therapies[J].ClinTranspl,2003,405-417.
[6]ISSA NC,FISHMAN JA.Infectious complications of antilymphocyte therapies in solid organ transplantation[J].ClinInfectDis,2009,48(6):772-786.
[7]PATEL HV,KUTE VB,VANIKAR AV,etal.Low-dose rabbit anti-thymoglobin globulin versus basiliximab for induction therapy in kidney transplantation[J].SaudiJKidneyDisTranspl,2014,25(4):819-822.
[9]CHAPAL M,FOUCHER Y,MARGUERITE M,etal.Preventing Delayed Graft Function by Driving Immunosuppressive InduCtion Treatment (PREDICT-DGF):study protocol for a randomized controlled trial[J].Trials,2015,16:282.
[10]GOGGINS WC,PASCUAL MA,POWELSON JA,etal.A prospective,randomized,clinical trial of intraoperative versus postoperative thymoglobulin in adult cadaveric renal transplant recipients[J].Transplantation,2003,76(5):798-802.
[11]NOЁL C,ABRAMOWICZ D,DURAND D,etal.Daclizumab versus antithymocyte globulin in high-immunological-risk renal transplant recipients[J].JAmSocNephrol,2009,20(6):1385-1392.
[12]BRENNAN DC,DALLER JA,LAKE KD,etal.Rabbit antithymocyte globulin versus basiliximab in renal transplantation[J].NEnglJMed,2006,355(19):1967-1977.
[13]OJO AO,WOLFE RA,HELD PJ,etal.Delayed graft function:risk factors and implications for renal allograft survival[J].Transplantation,1997,63(7):968-974.
[14]MOSER MA.Options for induction immunosuppression in liver transplant recipients[J].Drugs,2002,62(7):995-1011.
[15]LEBRANCHU Y,BRIDOUX F,BÜCHLER M,etal.Immunoprophylaxis with basiliximab compared with antithymocyte globulin in renal-transplant patients receiving MMF-containing triple therapy[J].AmJTransplant,2002,2(1):48-56.
[16]MOURAD G,ROSTAING L,LEGENDRE C,etal.Sequential protocols using basiliximab versus anti-thymocyte globulins in renal-transplant patients receiving mycophenolate mofetil and steroids[J].Transplantation,2004,78(4):584-590.
[17]NASHAN B.Antibody induction therapy in renal transplant patients receiving calcineurin-inhibitor immunosuppressive regimens:a comparative review[J].BioDrugs,2005,19(1):39-46.
[18]PENG W,LIU G,XIE W,etal.Interleukin-2 receptor antagonist compared with antithymocyte globulin induction therapy in kidney transplantation from donors after cardiac death[J].IntJClinPractSuppl,2015(183):23-28.
[19]CHEN G,GU J,QIU J,etal.Efficacy and safety of thymoglobulin and basiliximab in kidney transplant patients at high risk for acute rejection and delayed graft function[J].ExpClinTransplant,2013,11(4):310-314.
[20]KIM JM,JANG HR,KWON CH,etal.Rabbit antithymocyte globulin compared with basiliximab in kidney transplantation:a single-center study[J].TransplantProc,2012,44(1):167-170.
[21]KNIGHT RJ,KERMAN RH,SCHOENBERG L,etal.The selective use of basiliximab versus thymoglobulin in combination with sirolimus for cadaveric renal transplant recipients at low risk versus high risk for delayed graft function[J].Transplantation,2004,78(6):904-910.
[22]SCHADDE E,D′ALESSANDRO AM,KNECHTLE SJ,etal.Alemtuzumab induction and triple maintenance immunotherapy in kidney transplantation from donors after cardiac death[J].TransplInt,2008,21(7):625-636.
[23]FOSTER CE 3RD,WENG RR,PIPER M,etal.Induction therapy by anti-thymocyte globulin (rabbit) versus basiliximab in deceased donor renal transplants and the effect on delayed graft function and outcomes[J].TransplantProc,2012,44(1):164-166.
[24]中华医学会.临床治疗指南(器官移植学分册)[M].北京:人民卫生出版社,2010:237.
[25]SANDRINI S.Use of IL-2 receptor antagonists to reduce delayed graft function following renal transplantation:a review[J].ClinTransplant,2005,19(6):705-710.
[26]GONWA TA,MAI ML,SMITH LB,etal.Immunosuppression for delayed or slow graft function in primary cadaveric renal transplantation:use of low dose tacrolimus therapy with post-operative administration of anti-CD25 monoclonal antibody[J].ClinTransplant,2002,16(2):144-149.
[27]ANDREWS PA,BURNAPP L,MANAS D.Summary of the British Transplantation Society guidelines for transplantation from donors after deceased circulatory death[J].Transplantation,2014,97(3):265-270.
[28]GAYNOR JJ,CIANCIO G,GUERRA G,etal.Lower tacrolimus trough levels are associated with subsequently higher acute rejection risk during the first 12 months after kidney transplantation[J].TransplInt,2016,29(2):216-226.
[29]SAWINSKI D,TROFE-CLARK J,LEAS B,etal.Calcineurin inhibitor minimization,conversion,withdrawal,and avoidance strategies in renal transplantation:a systematic review and meta-analysis[J].AmJTransplant,2016,16(7):2117-2138.
[30]VAN GELDER T,SILVA HT,DE FIJTER H,etal.How delayed graft function impacts exposure to mycophenolic acid in patients after renal transplantation[J].TherDrugMonit,2011,33(2):155-164.
[31]VAN GELDER T,SILVA HT,DE FIJTER JW,etal.Comparing mycophenolate mofetil regimens for de novo renal transplant recipients:the fixed-dose concentration-controlled trial[J].Transplantation,2008,86(8):1043-1051.
[32]VAN GELDER T,HILBRANDS LB,VANRENTERGHEM Y,etal.A randomized double-blind,multicenter plasma concentration controlled study of the safety and efficacy of oral mycophenolate mofetil for the prevention of acute rejection after kidney transplantation[J].Transplantation,1999,68(2):261-266.
[33]VAN GELDER T,LE MEUR Y,SHAW LM,etal.Therapeutic drug monitoring of mycophenolate mofetil in transplantation[J].TherDrugMonit,2006,28(2):145-154.
[34]LE MEUR Y,BUCHLER M,THIERRY A,etal.Individualized mycophenolate mofetil dosing based on drug exposure significantly improves patient outcomes after renal transplantation[J].AmJTransplant,2007,7(11):2496-2503.
[35]KUYPERS DR,LE MEUR Y,CANTAROVICH M,etal.Consensus report on therapeutic drug monitoring of mycophenolic acid in solid organ transplantation[J].ClinJAmSocNephrol,2010,5(2):341-358.
[36]中华医学会.临床治疗指南(器官移植学分册)[M].北京:人民卫生出版社,2010:288.
[37]BUNCH DR,WANG S.Measurement of mycophenolic acid in plasma or serum by a commercial enzyme inhibition technique in comparison with a high performance liquid chromatography method[J].ClinChemLabMed,2008,46(9):1281-1284.
[38]TAHIR W,HAKEEM A,DAWRANT M,etal.Early sirolimus conversion as rescue therapy in kidneys with prolonged delayed graft function in deceased donor renal transplant[J].TransplantProc,2015,47(6):1610-1615.
[39]MC TAGGART RA,TOMLANOVICH S,BOSTROM A,etal.Comparison of outcomes after delayed graft function:sirolimus-based versus other calcineurin-inhibitor sparing induction immunosuppression regimens[J].Transplantation,2004,78(3):475-480.
[40]SIMON JF,SWANSON SJ,AGODOA LY,etal.Induction sirolimus and delayed graft function after deceased donor kidney transplantation in the United States[J].AmJNephrol,2004,24(4):393-401.
